- 2021-07-07 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖南省常德市一中2021届高三化学上学期第二次月考试题(Word版带解析)
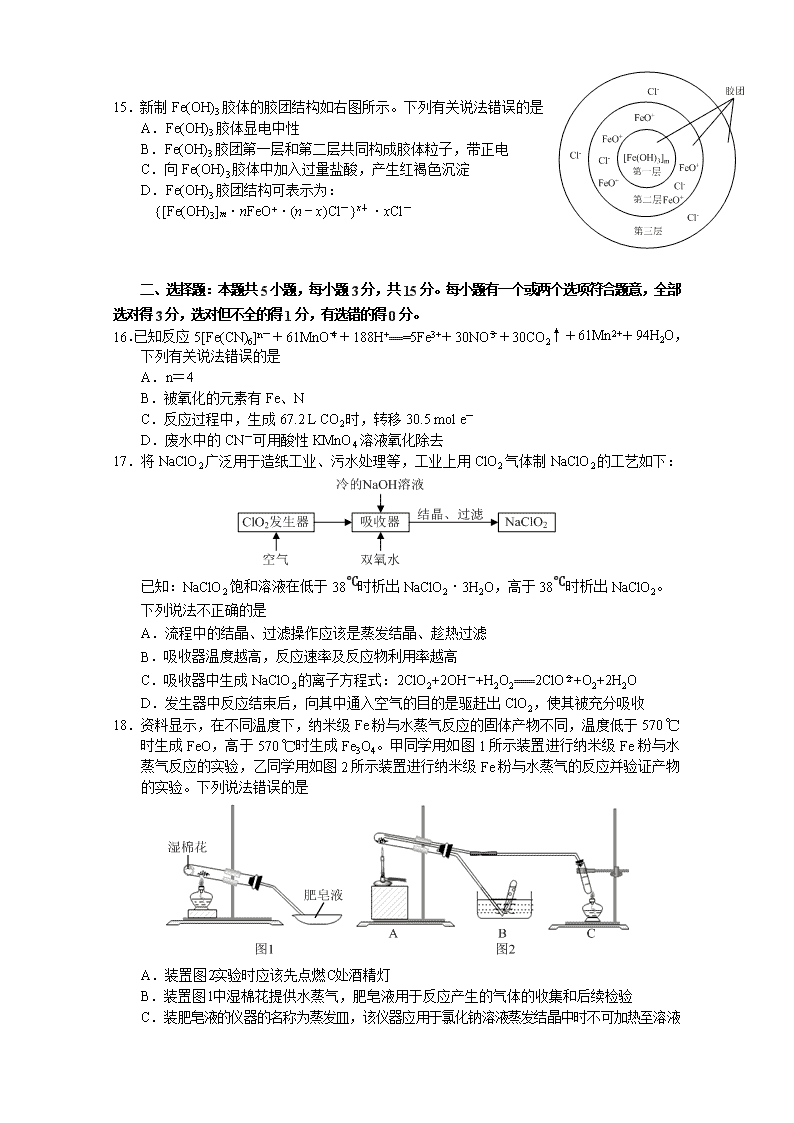
常德市一中2021届高三第二次月水平检测试卷 化 学 (时量:90分钟 满分:100分) 可能用到的相对原子质量:H 1 C 12 O 16 N 14 Na 23 S 32 Cl 35.5 Cu 64 一、选择题:本题共15小题,每小题2分,共30分。每小题只有一个选项符合题意。 1.生活因化学更加美丽,世界因化学更加精彩。下列与化学有关的说法正确的是 A.漂白精不可用作游泳池和环境消毒剂 B.腌制咸鸭蛋利用了半透膜的渗析原理 C.泡沫灭火器能用于电器起火灭火 D.95 %的医用酒精消毒液效果比75 %的好 2.中国古代文物不仅彰显了民族和文化自信,还蕴含了许多化学知识。下列说法错误的是 A.商代“四羊方尊”属于青铜制品,青铜是一种铜锡合金 B.宋代《莲塘乳鸽图》缂丝中使用的丝,主要成分是蛋白质 C.清代乾隆“瓷母”是指各种釉彩大瓶,主要成分是二氧化硅 D.东晋《洛阳赋图》中的彩色颜料铜绿,主要成分是碱式碳酸铜 3.一定条件下物质X、Y、Z之间存在如下转化关系,则X不可能为 A.Na B.C C.Si D.NH3 4.下列各组物质的分类正确的是 A.混合物:花生油、铝热剂、水玻璃、水银 B.电解质:明矾、冰醋酸、石膏、纯碱 C.酸性氧化物:CO2、CO、SO2、SiO2 D.强电解质:HCl、BaSO4、Fe(SCN)3 5.下列叙述错误的是 A.侯氏制碱法的工艺利用了物质溶解度的差异 B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 C.向紫色石蕊试液中加入过量Na2O2粉末,溶液只变蓝 D.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 6.设NA为阿伏加德罗常数的值。下列说法正确的是 A.1 mol月球表面的氦﹣3(3He)含有质子为3 NA B.1 L pH=1的H3PO4溶液中,含有0.1 NA 个H+ C.标准状况下,22.4 L CCl4中所含分子数为NA D.8.0 g Cu2S和CuO的混合物中原子数为0.1NA 7.室温下,下列各组离子在指定溶液中能大量共存的是 A.pH=2的溶液:Na+、Fe2+、I-、NO B.c(NaAlO2)=0.1 mol/L的溶液:K+、OH-、Cl-、SO C.常温下pH=7的溶液中:K+、NO、Al3+、Cl- D.由水电离出的c(H+)=1.0×10-12 mol·L-1的溶液:Na+、ClO-、HCO、K+ 8.下列叙述正确的是 A.Fe与S混合加热生成Fe2S3 B.NaHCO3的热稳定性大于Na2CO3 C.H2O2漂白原理与HClO相同 D.Mg在空气中燃烧只得到 MgO 9.下列有关离子方程式或离子共存说法正确的是 A.FeCl3溶液中滴加氨水:Fe3++3OH-===Fe(OH)3↓ B.淀粉﹣KI溶液中加入少量溴水,溶液变蓝色:Br2+2I-===2Br-+I2 C.向NaClO溶液中滴加几滴稀FeSO4溶液:2Fe2++2H++ClO-=== Cl-+2Fe3++H2O D.加入Al能放出H2的溶液中可能存在:Cl-、HCO、SO、NH 10.用如图装置进行实验,将A中浓盐酸逐滴加入到固体B(KMnO4)中,下列叙述正确的是 A.装置D可起到防倒吸作用 B.若C中盛紫色石蕊溶液,溶液变红 C.若C中盛饱和NaCl溶液,无明显现象 D.若C中盛少量淀粉碘化钾溶液,溶液一定变蓝 11.图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是 A.电解熔融MgCl2制Mg B.该流程中可以循环使用的物质是NH3和NH4Cl C.利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应 D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同 12.向以下六种饱和溶液中分别通入足量CO2,最终得到沉淀或析出晶体的一组是 ①Ca(NO3)2 ②NH3和NaCl ③Ba(OH)2 ④Na2SiO3 ⑤NaA1O2 ⑥Na2CO3 A.①③④⑥ B.②④⑤⑥ C.②③④⑥ D.①②③⑤ 13.下列除去杂质或物质检验的操作错误的是 A.CuCl2溶液中混有FeCl3:加入适量CuO后过滤 B.除去石英中少量的碳酸钙:用稀盐酸溶解后过滤、干燥 C.Cl2混有少量HCl:将混合气体通过盛饱和食盐水的洗气瓶 D.向某无色溶液中加入盐酸,有无色、无味的气体产生,则说明原 溶液中一定有CO 14.下列物质的转化在给定条件下能实现的是 A.MgCl2(aq) Mg(OH)2 MgO B.S SO3 H2SO4 C.SiO2 SiCl4 Si D.NH3 NO HNO3 15.新制Fe(OH)3胶体的胶团结构如右图所示。下列有关说法错误的是 A.Fe(OH)3胶体显电中性 B.Fe(OH)3胶团第一层和第二层共同构成胶体粒子,带正电 C.向Fe(OH)3胶体中加入过量盐酸,产生红褐色沉淀 D.Fe(OH)3胶团结构可表示为: {[Fe(OH)3]m·nFeO+·(n﹣x)Cl-}x+·xCl- 二、选择题:本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题意,全部选对得3分,选对但不全的得1分,有选错的得0分。 16.已知反应5[Fe(CN)6]n-+61MnO+188H+===5Fe3++30NO+30CO2↑+61Mn2++94H2O,下列有关说法错误的是 A.n=4 B.被氧化的元素有Fe、N C.反应过程中,生成67.2 L CO2时,转移30.5 mol e- D.废水中的CN-可用酸性KMnO4溶液氧化除去 17.将NaClO2广泛用于造纸工业、污水处理等,工业上用ClO2气体制NaClO2的工艺如下: 已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。 下列说法不正确的是 A.流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤 B.吸收器温度越高,反应速率及反应物利用率越高 C.吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2===2ClO+O2+2H2O D.发生器中反应结束后,向其中通入空气的目的是驱赶出ClO2,使其被充分吸收 18.资料显示,在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570 ℃时生成FeO,高于570 ℃时生成Fe3O4。甲同学用如图1所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用如图2所示装置进行纳米级Fe粉与水蒸气的反应并验证产物的实验。下列说法错误的是 A.装置图2实验时应该先点燃C处酒精灯 B.装置图1中湿棉花提供水蒸气,肥皂液用于反应产生的气体的收集和后续检验 C.装肥皂液的仪器的名称为蒸发皿,该仪器应用于氯化钠溶液蒸发结晶中时不可加热至溶液 蒸干 D.将装置图2反应后得到的黑色粉末(假定为均匀的)取出少量放入另一试管中,加入少量盐 酸,微热,再滴加几滴KSCN溶液,振荡,溶液没有出现血红色,则装置A的产物为FeO 19.某溶液中可能含有H+、Mg2+、Al3+、NH、Cl-、ClO-的几种离子(不考虑水的电离与离子的水解)。当向溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。下列说法正确的是 A.原溶液中一定含有的阳离子是H+、Al3+、NH B.反应最后形成的溶液中的溶质AlCl3 C.原溶液中H+与NH 的物质的量之比为2:3 D.原溶液中含有的阴离子是Cl-、ClO- 20.实验室模拟工业处理含铬废水,操作及现象如图1所示,反应过程中铬元素的化合价变化如图2。 已知:深蓝色溶液中生成了CrO5,CrO 为黄色。下列说法错误的是 A.0~5 s过程中,Cr2O 发生了氧化还原反应 B.30~80 s过程中,Cr元素被氧化,可能是剩余的H2O2所致 C.30 s时,溶液呈绿色是因为生成了CrO D.80 s时,在NaOH条件下,溶液中含铬微粒主要为CrO 三、非选择题:本题包括4小题,共55分 21.(16分) 金属材料在生活生产中应用极其广泛,回答下列问题。 (1)请写出Na2O2的电子式 , (填“是”或“不是”)碱性氧化物。 (2)工业上,粗盐需精制,为除去Ca2+需要加入的试剂为 。食盐中含有KIO3,可加入稀硫酸酸化的淀粉碘化钾溶液检测,若变蓝,则说明含有KIO3,写出相应反应的离子方程式 。等物质的量Cl2、H2O2、ClO2(还原产物为Cl-)消毒效率最高的是________。“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓HCl)不能混用,原因是 。 (3)已知硼酸是一元弱酸,存在电离方程式H3BO3+H2O⥫=⥬ B(OH)+H+,其与过量NaOH反应得到的盐的化学式为 。 (4)含重金属离子Cu2+的废水中,可加入Na2S溶液除去,写出Cu2+发生反应的离子方程式 。某温度条件下,CuSO4·xH2O失掉0.5个结晶水,失重3.87%,则x= 。 22.(12分) 连二亚硫酸钠,也称为保险粉,是一种白色砂状结晶或淡黄色粉末,熔点300℃(分解),溶于氢氧化钠溶液,在空气中易被氧化,在碱性介质中稳定存在。以Zn粉与SO2溶液反应制备“保险粉”的工艺如下: 回答下列问题: (1)“反应”和“转化”可利用右图所示装置完成(夹持装置已略)。 ①可用Cu与浓硫酸反应制SO2,写出相应化学方程式 。 ②控制反应温度为35~45 ℃的加热方式为 ,“反应”过程中可能会产生一种易燃气体,该气体为 (填化学式)。 ③试剂M为 (填化学式),滤渣的主要成分为 。 (2)选用洗涤Na2S2O4·2H2O。采取真空“脱水干燥”的原因是 。 (3)称取2.0 g Na2S2O4样品溶于冷水配成200 mL溶液,取出25.00 mL该溶液于锥形瓶中,用0.10 mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:2[Fe(CN)6]3-+S2O+4OH-=== 2[Fe(CN)6]4-+2SO+2H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00 mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。 23.(14分) 实验室用下图所示装置制备FeSO4,该物质应用广泛。 已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。 (1)实验装置 图中仪器a的名称为 。反应过程中会产生少量PH3气体,需使用封闭装置,用CuSO4溶液吸收PH3时会生成H3PO4和Cu,该反应的化学方程式为 。 (2)药品用量 将2 g Fe粉、10 mL 3 mol·L-1 H2SO4溶液加入烧瓶中反应。采取铁粉过量的原料配比的主要原因是 。 (3)制备FeSO4溶液 保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,除去残留固体,滤液经 、 ,过滤、洗涤、干燥,得到FeSO4·7H2O[已知:FeSO4·7H2O的溶解度随着温度升高增加程度大]。 (4)用途 ①制备(NH4)2Fe(SO4)2·6H2O 将FeSO4·7H2O溶于稀硫酸,向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50 mL乙醇中,继而析出晶体。上述过程中,溶于稀硫酸的目的是 ,后续加入乙醇的作用为 。 ②絮凝剂——聚合硫酸铁 向稀硫酸酸化的FeSO4溶液中缓慢滴加H2O2,此时发生反应的离子方程式为 ,继续在加热条件下反应一段时间,制得红棕色的聚合硫酸铁。 24.(13分) 察尔汗盐湖是我国最大的钾肥生成基地,生产钾肥过程中会产生大量的水氯镁石(MgCl2·6H2O)。为实现资源综合利用,以水氯镁石为原料制轻质氧化镁。其工艺如下: 按要求回答问题: (1)锂与镁元素性质相似,写出向Li2SO4溶液中滴加Na2CO3溶液的离子方程式为 。 (2)为了提高水浸速率,可采取的措施有 。 (3)“沉镁”的离子方程式为 ,“沉镁”采用的温度为90~95 ℃,温度不宜超过95 ℃的理由是 。 (4)(NH3与NH4HCO3的物质的量之比)与沉镁效率(h)的关系如图所示,指出沉镁的最佳范围为 。 (5)试说明 “煅烧”后得到疏松多孔的MgO的原因 。 (6)“滤液”中的主要成分为 ,可用于 (写出一种生活生产的应用)。 常德市一中2021届高三第二次月水平检测试卷化学答案解析 一、选择题:本题共15小题,每小题2分,共30分。每小题只有一个选项符合题意。 1.【答案】B 【解析】A.漂白精主要指较纯的次氯酸钙。常用作游泳池和环境消毒剂(不要没有生活气息,游泳池有时候那么刺鼻的气味),A项正确;B.鸭蛋有鸡蛋膜,属于半透膜,NaCl能够进入符合渗析原理,B项正确;C.泡沫灭火器产生CO2、H2O、Al(OH)3等不能用于电器起火,C项错误;D.75 %的消毒效果更好,95 % 的医用酒精容易让病菌表面形成一层膜,而不能继续进入。D项错误。 2.【答案】C 【解析】A.青铜是一种铜锡合金,黄铜含铜锌,A项正确;B.古代丝主要有两种,蛋白质和纤维素,此处提到乳鸽图,是动物丝,主要成分是蛋白质,来自植物是纤维素,B项正确;C.瓷指陶瓷,主要成分是硅酸盐,C项错误;D.铜绿即铜锈,主要成分是碱式碳酸铜,D项正确。 3.【答案】C 【解析】Na2O可与O2加热反应得到Na2O2 4.【答案】B 【解析】A.水银为纯净物,A错误;B.酸、碱、盐均为电解质,B正确;C.CO不是酸性氧化物;D.Fe(SCN)3是弱电解质。 5.【答案】C 【解析】C.向紫色石蕊试液中加入过量Na2O2粉末,溶液先变蓝后褪色 6.【答案】B 【解析】A.1 mol He含质子2NA,A项错误;B.pH=1,即c(H+)=0.1 mol/L,包含溶液所有的H+,则1 L溶液中含有0.1 NA 个H+,B项正确;标准状况下,CCl4是液体,常见的标况下非气体的还有甲醇、乙醇、HF、SO3、CH2Cl2、CHCl3等,C项错误;8.0 g Cu2S和CuO的混合物,可用极端假设法,假如只有8.0 g Cu2S计算原子数,假如只有8.0 g CuO计算原子数,原子数指的所有原子数嘛。计算会发现均为0.2NA,即8.0 g Cu2S和CuO的混合物所含原子数为0.2NA。 7.【答案】B 【解析】A.H+、NO能把Fe2+、I-氧化,不共存,不符合题意;C.常温下pH=7时,Al3+(一般pH=5即可)沉淀完全,不符合题意;D.水电离出的c(H+)=1.0×10-12 mol·L-1(中性水电离的是10-7 mol·L-1),说明水的电离被抑制了,即溶液属于强酸或强碱性环境,HCO 属于通杀系列,不符合题意。 8.【答案】C 【解析】A.Fe与S混合加热生成FeS,A项错误;B.NaHCO3的热稳定性小于Na2CO3,B项错误;C.H2O2与HClO均应具有强氧化性,而具有漂白性,C项正确;D.Mg在空气中可与O2、CO2、N2反应得到MgO、C、Mg3N2,D项错误。 9.【答案】B 【解析】A.FeCl3溶液中滴加氨水,发生反应应为Fe3++3NH3·H2O===Fe(OH)3↓+3NH,A项错误;过量的NaClO溶液呈碱性,Fe3+将以沉淀形式呈现,C项错误;D.加入Al能放出H2的溶液中可能是酸或强碱,注意一般不能含有硝酸根,否则不能产生H2,故HCO 一定不能存在,D项错误。 10.【答案】A 【解析】本题刻意降低难度,试问选项BCD你懂吗?装置B中将产生Cl2,B.若C中盛紫色石蕊溶液,溶液先变红后褪色,B项错误;C.若C中盛饱和NaCl溶液,应吸收挥发出来的HCl,将有NaCl晶体析出,HCl的溶解度更大,C项错误;D.若C中盛少量淀粉碘化钾溶液,Cl2可将I-产生的I2氧化为HIO3而致使不出现蓝色,D项错误。 11.【答案】C 【解析】本题也降低了难度,你能推出左侧第一个物质是Mg2Si吗?框图不给出的话。B.循环的物质就是既消耗有生成,B项正确;D.MgCl2蒸干(得不到的原因是水解产生HCl易挥发,促进了水解而沉淀)得到Mg(OH)Cl或Mg(OH)2,灼烧得到MgO,D项正确。 12.【答案】B 【解析】①Ca(NO3)2无沉淀,弱酸不能制强酸,②NH3和NaCl,属于侯氏制碱法,产生NaHCO3晶体,③Ba(OH)2,由于CO2过量,先沉淀后消失,④Na2SiO3,产生H2SiO3 沉淀,⑤NaA1O2 产生Al(OH)3沉淀,不溶于H2CO3,⑥Na2CO3,产生NaHCO3晶体。 13.【答案】D 【解析】本题略微显得有点是错题。D.向某无色溶液中加入盐酸,有无色、无味的气体产生,则说明原溶液中可能有CO、HCO。 14.【答案】A 【解析】不解释 15.【答案】C【解析】A.Fe(OH)3胶体显电中性,喝豆浆不电你撒,当初做氢氧化铁胶体实验,也没电你呀,A项正确。B.由图即可知,Fe(OH)3胶团第一层和第二层共同构成胶体粒子,带正电,B项正确;C.向Fe(OH)3胶体中加入过量盐酸,产生红褐色沉淀后,由于硫酸过量,沉淀会继续溶解,此外,胶体的聚沉对电解质溶液的种类和浓度都有不同的感觉,比如制备的氢氧化铁胶体里面就有电解质的嘛,但是不聚沉说明浓度不够,且不同离子带的电荷不同,聚沉效果不同,C项错误;D.看图说话,小学知识。 二、选择题:本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题意,全部选对得3分,选对但不全的得1分,有选错的得0分。 16.【答案】BC 【解析】A.由电荷守恒可知,n=4,正确;B.被氧化的元素有Fe、C、N,错误;C.未给标况,C项错误;D.没毛病。 【升维思考】若是本题考查你来配平,是否有耐心呢? 17.【答案】B 【解析】本题降低难度出场。因为B项足够简单,无论如何都不能作死的升高温度,还说好。A.流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤,需要趁热过滤的原因是,冷了,就是析出NaClO2·3H2O,A项正确;C.这个选项应该直接考H2O2作氧化剂,是否掉坑的人多些?D.赶气,就是赶走气体,若是你要这个气体,那就是确保吸收完全,若是你不要,那就是搞出去,不耽误自己的目的。 18.【答案】D 【解析】多个酒精灯经常出现点火先后问题,那么先点的往往是制气,好赶气,避免空气的感染。还可能是出现很多阀门或开关,然后自己可以尝试开、关,气体的走向。一定要假装自己是气体走动走动。D.可能会因为铁单质有剩余,导致并未出现红色,故不能说明装置A的产物为FeO。可能是Fe和Fe3O4。错误。 19.【答案】AC 【解析】这个题若是考一个定量计算的离子共存推断题,还可以增加复杂氧化还原反应的计算题,难度将加大。由图像可知,先无沉淀是,是H+反应,由于沉淀先产生后最后消失,说明不含Mg2+,且沉淀段和消失段,消耗NaOH体积比为3:1,说明含Al3+,而图像中还呈现一段无沉淀而平行于横坐标的过程,说明含有NH,故A项正确,H+与NH分别消耗的NaOH体积为2 mL,3 mL,故物质的量比为2:3。这种图像题的技巧就是弄明白反应的先后顺序即可。 20.【答案】AC 【解析】本题的关键是右侧的坐标轴图,化合价的变化。CrO5中Cr为+6,有4个﹣1的氧原子,其结构为。故A选项错误,发生的是非氧化还原反应。C.30 s时,溶液呈绿色是因为生成了Cr3+,而非CrO,溶液呈酸性,不会产生CrO。提请了解,Cr3+和Al3+类似,后面的性质你懂滴。D.80 s时,在NaOH条件下,溶液中含铬微粒主要为CrO,本选项降低了难度,题干已知信息不该告诉你颜色,毕竟选修4学过。降维打击。 三、非选择题:本题包括4小题,共55分 21.【答案】(16分,除标注外,每空2分) (1) 不是(1分) (2)Na2CO3 IO+5I-+6H+===3I2+3H2O ClO2 产生氯气,有毒 (3)Na[B(OH)4]或NaB(OH)4(1分) (4)Cu2++S2-===CuS↓ 4 【解析】史上最简单的填空题,送了16分。不解释。NaB(OH)4不要写NaBO2,说明你没有看信息。在靠记东西做题,理论上没有学过的不用记,而是学会基于基础去面对思考新题目,这个就是高考要求的“能力”。Cu2+与S2-由于能够结合成极难溶的沉淀,故不发生氧化还原反应,这个就是反应的竞争,由平衡常数说了算,沉淀极难溶,说明这个反应的平衡常数超级大。还有一个竞争那就是速率,你跑得快,别人慢,那自然发生你这个反应。今后的反应竞争由此说起。但是这个是选修4的一个重金属离子的除去的学习而已啊。 22.【答案】(12分,除标注外每空2分) (1)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O ②水浴加热 H2(1分) ③NaOH(1分) Zn(OH)2 (2)降低脱水温度,防止产品受热分解;隔绝空气防止产品被氧化 (3)83.5% 【解析】本题为工艺与实验的组合,从答题看,本届小朋友对信息的处理明显厉害许多。会利用题干信息处理题目。整体难度尽可能的考查已学知识,夯实元素,提振信心。 (2)问,真空有两层意思,一则减压干燥,有利于快速干燥(降低了水的沸点),二则隔绝了空气,防止了被氧化(要知道,加热可是会加速氧化的哦)。 【另请】久置的Na2S2O4可能因变质而混有Na2SO4,指出检验产品是否变质的具体操作,你会吗? (3)问,若是让你自己写方程式或者不给你配平,你是否可能因为方程式失误丢掉两空的分数呢? 由方程式可知由:2[Fe(CN)6]3-~S2O,[Fe(CN)6]3-的物质的量为0.10 mol/L×24.00 mL×10-3 mL/L,则25 mL 中含有Na2S2O4为 mol,然,原溶液为200 mL,存在陷阱,故最终2.0 g样品中含有含有Na2S2O4 ×8=0.0096 mol,故最终m(Na2S2O4)=1.67 g,则质量分数为×100%=83.5 %。注意:你知道质量分数,也可说纯度吗? 23.(14分,除标注外每空2分) (1)分液漏斗 4CuSO4+PH3+4H2O===4Cu+H3PO4+4H2SO4 (2)防止Fe2+被氧化 (3)蒸发浓缩(1分) 冷却结晶(1分) (4)①抑制Fe2+水解(继而防止被氧化) 降低(NH4)2Fe(SO4)2·6H2O 的溶解度,促进析出(有利于析出)②2Fe2++H2O2+2H+===2Fe3++2H2O 【解析】本题依旧主导基础知识的落实。(2)问,若将“铁粉过量”四字去掉,你会计算前面给的数据而得知铁粉过量的结果继而分析出是防止Fe2+被氧化吗?(3)问,“保持温度70~80℃,至反应无明显气泡产生,停止加热,过滤,除去残留固体”,你可知这里“过滤”是有讲究的,应为“趁热过滤”,若是考这一空,有多少同学能够达到“趁热”呢?不趁热,硫酸亚铁晶体(绿矾)可能因为冷了一哈哈而析出。(4)问,必须讲到降低谁的溶解度,方可得分。②问絮凝剂——聚合硫酸铁的化学式可认为是Fe2(OH)6-2n(SO4)n,若是要写生成它的离子方程式,你是否能够写出呢?本题属于降维考查。 24.(13分,除标注外每空2分) (1)2Li++CO===Li2CO3↓ (2)升温、将氯镁矿石研磨成粉 (3)2H2O+2Mg2++3NH3+HCO===Mg(OH)2·MgCO3↓+3NH或H2O+2Mg2++2NH3+2HCO===Mg(OH)2·MgCO3↓+CO2↑+2NH 防止温度过高,氨气逸出,碳酸氢铵分解(或碳酸铵受热分解。其中碳酸铵来自氨气与碳酸氢铵反应得来) (4)1.2~1.3(1.25附近皆可) (5)分解过程中产生大量CO2、水蒸气(1分)(6)NH4Cl(1分) 氮肥(1分) 【解析】编创了一个简单的流程,毕竟现阶段的你,还需要一定的工艺流程题的量变。 (1) 说什么和说明类似的题,你就可以先感受你学过的物质的性质,就很容易做出。镁离子和碳酸根是阔以产生碳酸镁沉淀滴。(2)这个属于预处理,直接记。但是不要说玻璃棒搅拌,工业生产你会用玻璃棒去搅拌?不如就答搅拌即可,造孽。(3)这一问离子方程式书写的答案有多种,但是绝对不能有生成NH3·H2O的情况,若是溶液碱性过强,将只有Mg(OH)2产生。温度不宜过高,要从速率、物质分解、挥发等三大角度优先思考(具有短期效益,长期效益请看工艺流程总结的学案)。(5)想想面包疏松多孔即可。(6)这一步分析说什么碳酸铵、氨水的都是没有经过前面思考的,氯离子被你扔哪去了?氯化铵的主要用途氮肥。 【整体评价】本次试卷,难度较小(毕竟第一次给大家出题,得温柔点),难得选项基本第一个选项就是答案,并且难一点的空都给的是1分哈^_^。主要注重基础知识的考查。题目要新样子,考点要旧知识。高考题的特点就是“新中有旧,旧中有新”,唯一不变的是抓好基础。同志们,加油!查看更多