2019届一轮复习鲁科版3-专项突破(七)Na2CO3、NaHCO3的定量计算与图像分析教案
(七)Na2CO3、NaHCO3的定量计算与图像分析
(对应学生用书第51页)
[考纲知识整合]
1.Na2CO3、NaHCO3与酸反应的定量比较
(1)速率:相同条件下,NaHCO3与盐酸反应放出CO2的速率比Na2CO3与盐酸反应快。
(2)耗酸量:等质量或等物质的量的Na2CO3与NaHCO3均为前者耗酸量多。
(3)CO2生成量比较
①等物质的量的Na2CO3、NaHCO3分别与足量的盐酸反应,产生CO2的量相等。
②等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多。
③等物质的量的HCl与足量的Na2CO3、NaHCO3分别反应,NaHCO3产生的CO2多。
2.Na2CO3、NaHCO3与酸反应的4种图像
(1)Na2CO3溶液中逐滴加入盐酸(图1)
(Oa=ab)
图1
有关离子方程式Oa段:CO+H+===HCO;
ab段:HCO+H+===CO2↑+H2O。
(2)NaHCO3溶液中逐滴加入盐酸(图2)
图2
离子方程式:HCO+H+===CO2↑+H2O。
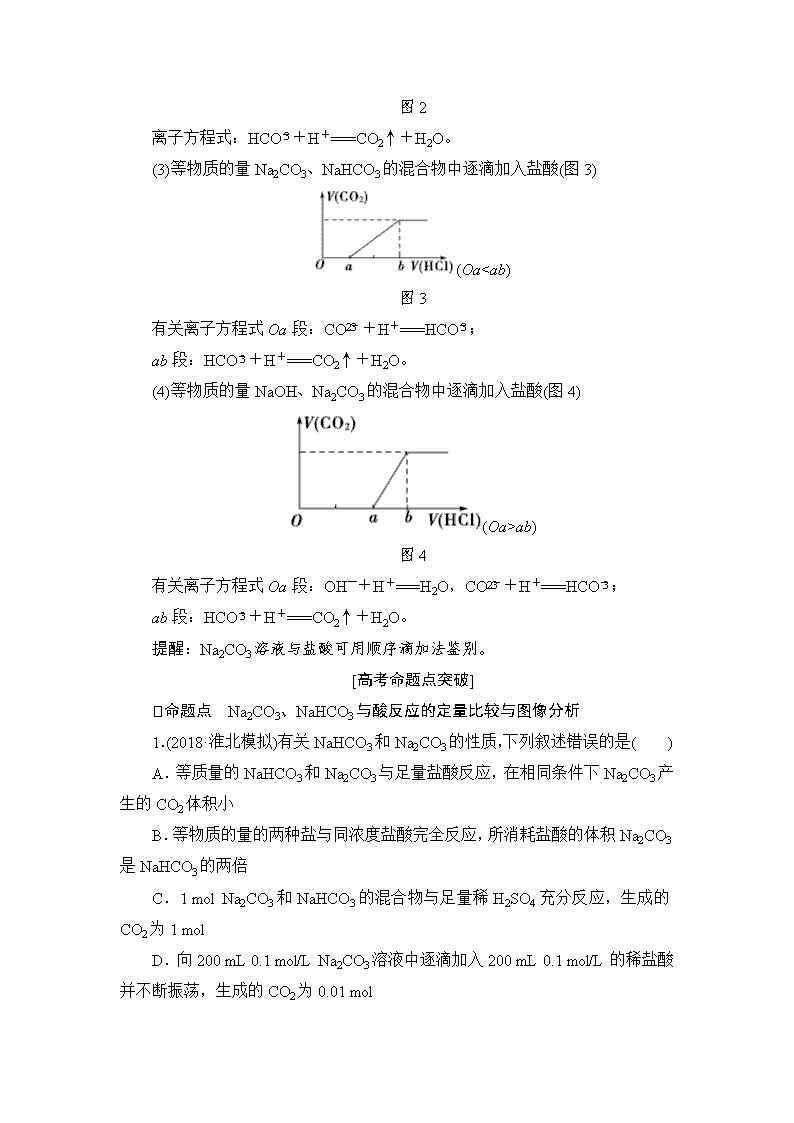
(3)等物质的量Na2CO3、NaHCO3的混合物中逐滴加入盐酸(图3)
(Oa
ab)
图4
有关离子方程式Oa段:OH-+H+===H2O,CO+H+===HCO;
ab段:HCO+H+===CO2↑+H2O。
提醒:Na2CO3溶液与盐酸可用顺序滴加法鉴别。
[高考命题点突破]
命题点 Na2CO3、NaHCO3与酸反应的定量比较与图像分析
1.(2018·淮北模拟)有关NaHCO3和Na2CO3的性质,下列叙述错误的是( )
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3
是NaHCO3的两倍
C.1 mol Na2CO3和NaHCO3的混合物与足量稀H2SO4充分反应,生成的CO2为1 mol
D.向200 mL 0.1 mol/L Na2CO3溶液中逐滴加入200 mL 0.1 mol/L的稀盐酸并不断振荡,生成的CO2为0.01 mol
D [D项,反应原理为CO+H+===HCO,HCO+H+===CO2↑+H2O,故不会生成CO2。]
2.(2018·岳阳模拟)分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图所示(分A、B两种情况):
(1)在A情况下,溶质是________(填化学式),其物质的量之比为________。
(2)在B情况下,溶质是________(填化学式),其物质的量之比为________。
(3)原氢氧化钠溶液的物质的量浓度为________。
【解析】 CO2与NaOH溶液反应时,据CO2量与NaOH量的相对多少,有这样两个阶段:①CO2+2NaOH===Na2CO3+H2O,此时溶质可能为NaOH和Na2CO3或只有Na2CO3(刚好反应);②Na2CO3+CO2+H2O===2NaHCO3,此时溶质可能为Na2CO3和NaHCO3或只有NaHCO3;据图分析:B情况最终生成的CO2(其实就是最初通入的与NaOH溶液反应的CO2)是A情况的2倍。(3)当加入150 mL盐酸时,恰好完全反应,此时溶液中溶质为NaCl。据物料守恒有n(NaOH)=n(Na+)=n(Cl-)=0.2 mol·L-1×0.15 L=0.03 mol,所以c(NaOH)==1.5 mol·L-1。
【答案】 (1)NaOH、Na2CO3 1∶1
(2)Na2CO3、NaHCO3 1∶1
(3)1.5 mol·L-1