- 2021-07-07 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省哈尔滨师范大学附属中学2020届高三6月复课线下考查理综化学试题
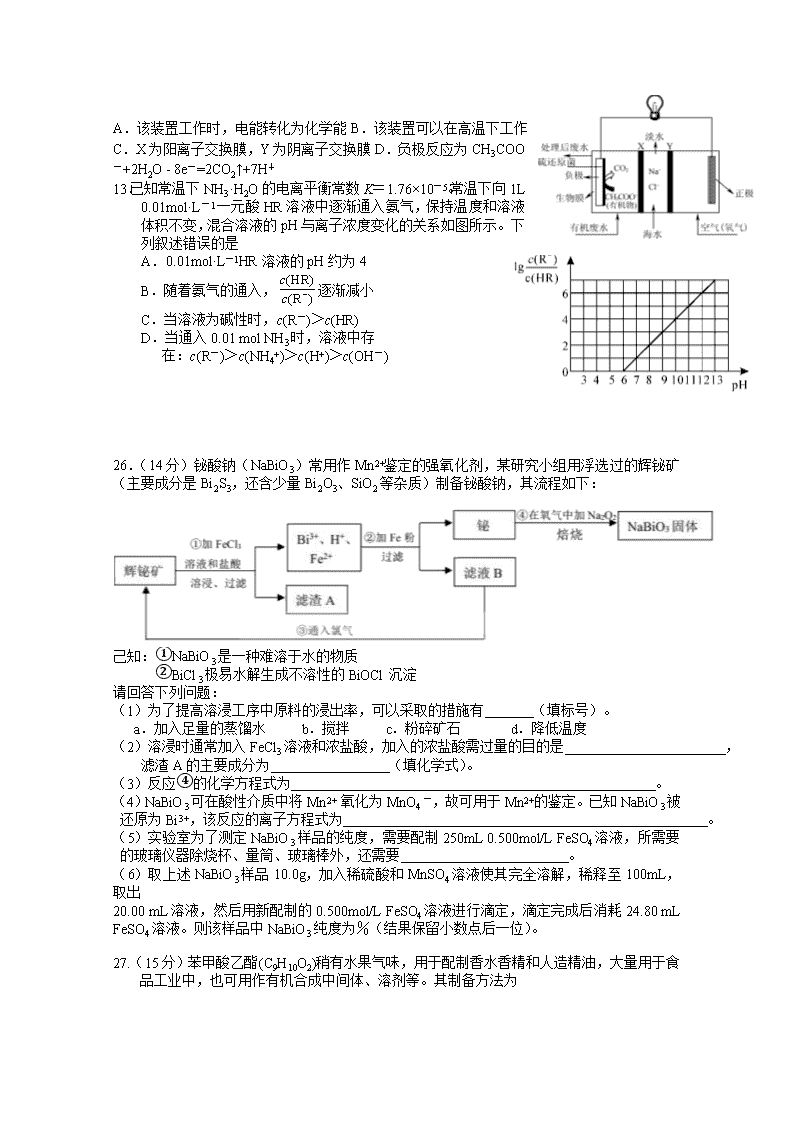
哈师大附中 2017 级高三复课线下考查卷 理科综合能力测试化学 本试卷共 38 题,共 300 分,共 12 页。考试结束后,将本试卷和答題卡一并交回。 注意事項: 1.答题前考生务必将自己的姓名、准考证号填写在答題卡上,认真核对条形码上的姓名、 准考证号,并将条形码粘贴在答題卡的指定位置上。 2.选择题答案使用 2B 铅笔填涂,如需改动,用橡皮擦干净后,再选涂其他答案标号;非选 择题答案使用 0.5 毫米黑色中性(签字)笔或碳素笔书写,字体工整,笔迹清楚。 3.请按照题号在各题的答答题区域(黑色线框)内作答,超出答题区域书写的答案无效。 4.保持卡面清洁,不折叠,不破损。 5.做选考题时,考生按照题目要求作答,并用 2B 铅笔在答题卡上把所选题目对应的题号 涂黑。 可能用到的相对原子质量: N 14 O 16 Na 23 Fe 56 Bi 209 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项中,只有一项 是符合题目要求的。 7.化学与生产、生活及社会发展密切相关,下列有关说法错误的是 A.“血液透析”和“静电除尘”利用了胶体的不同性质 B.燃煤中加入 CaO 可以减少酸雨的形成 C.从海水中提取物质都必须通过化学反应才能实现 D.在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 8.氮及其化合物的性质是了解工农业生产的重要基础。设 NA 为阿伏加德罗常数的值,下列 有关说法错误的是 A.标准状况下,5.6LNO 与 5.6LO2 充分混合后的分子数为 0.5NA B.标准状况下,22.4L15NH3 含有的质子数为 10NA C.13.8g NO2 与足量水反应,转移的电子数为 0.2NA D.常温下,1L0.1 mol·L−1NH4NO3 溶液中含有的氮原子数为 0.2NA 9.X、Y、Z、W 是四种原子序数依次增大的短周期元素,W 的最外层电子数比 X 的最外层 电子数少 1 个,X、Y、Z 组成一种化合物(ZXY)2 的结构式如图所示。下列说法错误的是 A.Y 和 W 的简单离子的半径大小:W<Y B.Y 的氧化物对应的水化物可能是弱酸 C.氢化物的沸点:X 一定小于 Z D.化合物(ZXY)2 中所有原子均满足 8 电子稳定结构 10.阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体 M ( ),下列说法正确的是 A.与环戊醇互为同系物 B.分子中所有碳原子共平面 C.能使酸性高锰酸钾溶液和溴水褪色,且反应类型相同 D.可用碳酸钠溶液鉴别乙 酸和 M 11.下列说法正确的是 A.将 SO2 通入滴有酚酞的 NaOH 溶液中可检验其漂白性 B.欲除去 H2S 气体中混有的 HCl,可将混合气体通入饱和 NaHS 溶液 C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇 D.用 pH 试纸分别测定等物质的量浓度的 NaCN 和 NaClO 溶液的 pH,可比较 HCN 和 HClO 的酸性强弱 12.ZulemaBorjas 等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是 A.该装置工作时,电能转化为化学能 B.该装置可以在高温下工作 C.X 为阳离子交换膜,Y 为阴离子交换膜 D.负极反应为 CH3COO -+2H2O - 8e-=2CO2↑+7H+ 13.已知常温下 NH3·H2O 的电离平衡常数 K=1.76×10-5。常温下向 1L 0.01mol·L-1 一元酸 HR 溶液中逐渐通入氨气,保持温度和溶液 体积不变,混合溶液的 pH 与离子浓度变化的关系如图所示。下 列叙述错误的是 A.0.01mol·L-1HR 溶液的 pH 约为 4 B.随着氨气的通入, 逐渐减小 C.当溶液为碱性时,c(R-)>c(HR) D.当通入 0.01 mol NH3 时,溶液中存 在:c(R-)>c(NH4+)>c(H+)>c(OH-) 26.(14 分)铋酸钠(NaBiO3)常用作 Mn2+鉴定的强氧化剂,某研究小组用浮选过的辉铋矿 (主要成分是 Bi2S3,还含少量 Bi2O3、SiO2 等杂质)制备铋酸钠,其流程如下: 己知:①NaBiO3 是一种难溶于水的物质 ②BiCl3 极易水解生成不溶性的 BiOCl 沉淀 请回答下列问题: (1)为了提高溶浸工序中原料的浸出率,可以采取的措施有 (填标号)。 a.加入足量的蒸馏水 b.搅拌 c.粉碎矿石 d.降低温度 (2)溶浸时通常加入 FeCl3 溶液和浓盐酸,加入的浓盐酸需过量的目的是 , 滤渣 A 的主要成分为 (填化学式)。 (3)反应④的化学方程式为 。 (4)NaBiO3 可在酸性介质中将 Mn2+ 氧化为 MnO4 一,故可用于 Mn2+的鉴定。已知 NaBiO3 被 还原为 Bi3+,该反应的离子方程式为 。 (5)实验室为了测定 NaBiO3 样品的纯度,需要配制 250mL 0.500mol/L FeSO4 溶液,所需要 的玻璃仪器除烧杯、量筒、玻璃棒外,还需要 。 (6)取上述 NaBiO3 样品 10.0g,加入稀硫酸和 MnSO4 溶液使其完全溶解,稀释至 100mL, 取出 20.00 mL 溶液,然后用新配制的 0.500mol/L FeSO4 溶液进行滴定,滴定完成后消耗 24.80 mL FeSO4 溶液。则该样品中 NaBiO3 纯度为%(结果保留小数点后一位)。 27.(15 分)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食 品工业中,也可用作有机合成中间体、溶剂等。其制备方法为 (HR) (R ) c c − + C2H5OH +H2O 已知: 物质 颜色、状态 沸点(℃) 密度(g·cm-3) 相对分子质量 苯甲酸 无色、片状晶体; 100 ℃会迅速升华 249 1.265 9 122 苯甲酸乙酯 无色澄清液体 212.6 1.05 150 乙醇 无色澄清液体 78.3 0.789 3 46 环己烷 无色澄清液体 80.8 0.731 8 84 图 I 图 II 实验步骤如下: ①在 100 mL 圆底烧瓶中加入 12.20 g 苯甲酸、25 mL 乙醇(过量)、20 mL 环己烷,以及 4 mL 浓硫酸,混合均匀并加入沸石,按图 I 所示装好仪器,控制温度在 65~70 ℃加热回流 2h。 反应时环己烷-乙醇-水会形成“共沸物”(沸点 62.6 ℃)蒸馏出来。再利用分水器不断分离 除去反应生成的水,回流环己烷和乙醇。 ②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的 液体不再明显增加,停止加热。 ③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入 Na2CO3 至溶液呈中性。 ④用分液漏斗分出有机层,水层用 25 mL 乙醚萃取分液,然后合并有机层。加入氯化钙, 对粗产品进行蒸馏(装置如图 II 所示)。低温蒸出乙醚后继续升温,接收 210~213 ℃的馏分。 ⑤检验合格,测得产品体积为 12.86 mL。 (1)步骤①中加入沸石的目的是;使用分水器不断分离除去水的目的是 ______________________________________________________。 (2)步骤②中继续加热的温度应控制在________(填标号)。 A.65~70 ℃ B.78~80 ℃ C.85~90 ℃ D.215~220 ℃ (3)步骤③中若 Na2CO3 加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产 生该现象的原因是_____________________________。 (4)步骤④中分液操作叙述正确的是________(填标号)。 A.向盛有水层的分液漏斗中加入乙醚,盖好玻璃塞,将分液漏斗倒转,用力振荡 B.振荡几次后需打开分液漏斗的下口活塞放气 C.经几次振荡并放气后,手持分液漏斗静置待液体分层 D.液体分层后,将分液漏斗上的玻璃塞打开,或使塞上的凹槽对准漏斗上的小孔 E.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出 (5)图 II 中仪器 A 的名称是,步骤④中氯化钙的作用是。 (6)该实验产品的产率为________________(结果保留三位有效数字)。 28. (14 分)汽车尾气中含有 CO、NOx 等有毒气体,对汽车加装尾气净化装置,可使有毒气 体相互反应转化为无毒气体。 I.已知 4CO(g)+2NO2(g) 4CO2(g)+N2(g)∆H=﹣1200 kJ•mol﹣1 (1)该反应在 (填“高温、低温或任何温度”)下能自发进行。 (2)对于该反应,改变某一反应条件(温度 T1>T2),下列图象正确的是 (填标号)。 (3)某实验小组模拟上述净化过程,一定温度下,在 2L 的恒容密闭容器中,起始时按照 甲、乙两种方式进行投料。甲:NO 2 0.2mol,CO 0.4mol ;乙: NO 2 0.1mol ,CO 0.2mol。 经过一段时间后达到平衡状态。 ①N2 的平衡体积分数:甲 乙( 填“>、=、<或不确定”,下同)。 ②NO2 的平衡浓度:甲 乙。 ③甲中 CO 的转化率为 50%,该反应的平衡常数为 。 II.柴油汽车尾气中的碳烟(C)和 NOx 可通过某含钴催化剂催化消除。不同温度下,将模 拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O) 与 NO 的相关数据结果如图所示。 气体(10mol) 模拟尾气 NO O2 He 碳烟 物质的量(mol) 0.025 0.5 9.475 一定量 (4)375℃时,测得排出的气体中含 amol O2 和 0.0525 mol CO2,已知 X 为 N2,Y 为 N2O, 则 a= 。 (5)实验过程中采用 NO 模拟 NOx,而不采用 NO2 的原因是 。 35.[化学—选修 3:物质结构与性质](15 分) 铁被称为“第一金属”,硫被称为“生命元素”,它们形成的物质种类非常丰富,在生产、生 活中 用途广泛。 (1)基态 S 原子有种能量不同的电子,其价电子排布图为。 (2)硫能形成 S2O32-、SO32-等多种含氧酸根,试推测 S2O32-的空间构型为, SO32-的中心原子杂化方式为。 (3) SCN-与 Fe3+能发生显色反应,该反应常用作检验 Fe3+的存在。 ①铁元素位于元素周期表的区。 ②SCN-的三种元素的电负性由大到小的顺序为(用元素符号表示)。 写出与 SCN-互为等电子体的分子的分子式(任写一种)。 ③Fe(SCN)3 中不存在的化学键有(填标号)。 A.离子键 B.极性键 C.非极性键 D.配位键 E. 键 F. 键 (4)部分卤化铁的熔点如下表所示: 卤化铁 FeF3 FeCl3 熔点/℃ 1100 306 解释表中物质之间熔点差异的原因。 (5)某种离子型铁的氧化物晶胞如图所示,它由 A、B 两种方块组成。 ①该氧化物中 Fe2+、Fe3+、O2-个数的最简整数比为 。 ②己知该晶体的密度为 d g·cm-3,阿伏加德罗常数的值为 NA,则晶胞参数 a 为 nm(用 含 d 和 NA 的代数式表示)。 36.【化学—选修 5:有机化学基础】(15 分) 1, 3-环己二酮( )常用作医药中间体,用于有机合成。1, 3-环己二酮的一种合 成路线如图所示。 回答下列问题: (1)甲的分子式为 。 (2)丙中含有官能团的名称是。 (3)反应①所需的试剂和条件是;②的反应类型是。 (4)丁的结构简式为。 (5)写出丙与新制氢氧化铜悬浊液反应的化学方程式。 (6)符合下列条件的乙的同分异构体共有种。 ①能发生银镜反应 ②能与 NaHCO3 溶液反应 其中核磁共振氢谱峰面积之比为 1∶1∶2∶6 的一种同分异构体的结构简式为 _______________(任写一种)。 σ π 复课考查化学答案: 题号 7 8 9 10 11 12 13 答案 C A C D B D D 26.(1) bc(2 分) (2)防止 FeCl3 及 BiCl3 水解,提高原料的浸出率(2 分,不答 FeCl3 不扣分) SiO2、S (2 分,各 1 分) (3)2Bi + Na2O2 + 2O2 === 2NaBiO3(2 分) (4)5NaBiO3+2Mn2++14H+=== 2MnO4﹣+5Na++5Bi3++7H2O (2 分) (5)250mL 容量瓶、胶头滴管 (2 分,各 1 分) (6)86.8 (2 分) 27.(15 分,除标注外,其余每空均为 2 分) (1)防止暴沸(1 分);有利于平衡不断向正反应方向移动,提高苯甲酸乙酯产率 (2)C (3)苯甲酸乙酯中混有苯甲酸,在受热至 100 ℃时发生升华 (4)ABD(3 分) (5)蒸馏烧瓶(1 分),干燥有机层 (6)90.0% 28.(14 分,每空 2 分) I.(1)低温; (2)CD; (3)①>;②>;③10L/mol II.(4)0.45; (5)NO2 气体中有 N2O4,不便进行定量测定。 35.(15 分) (1)(每空 1 分)5, (2)(每空 1 分)四面体形,sp3 (3)①d (1 分)②N>S>C(1 分) CO2(或 CS2)(1 分)③AC (2 分) (4) FeF3 为离子晶体,FeCl3 为分子晶体,离子键强于分子间作用力,因此 FeF3 熔点大于 FeCl3 熔点(2 分) 焙烧 (5)①1:2:4 (2 分)② (2 分) 36. (15分)(1)C6H11Br(2分) (2)醛基、羰(酮)基(2分) (3)氢氧化钠醇溶液,加热(2分) 氧化反应(1分) (4) (2 分) (5) CHO+2Cu(OH)2+NaOH COONa+Cu2O↓+3H2O (2 分) (6)12(2 分) 或 (2 分) nm102328a 73 ×⋅ ×= dN A查看更多