- 2021-07-07 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学实验综合作业(江苏专用)
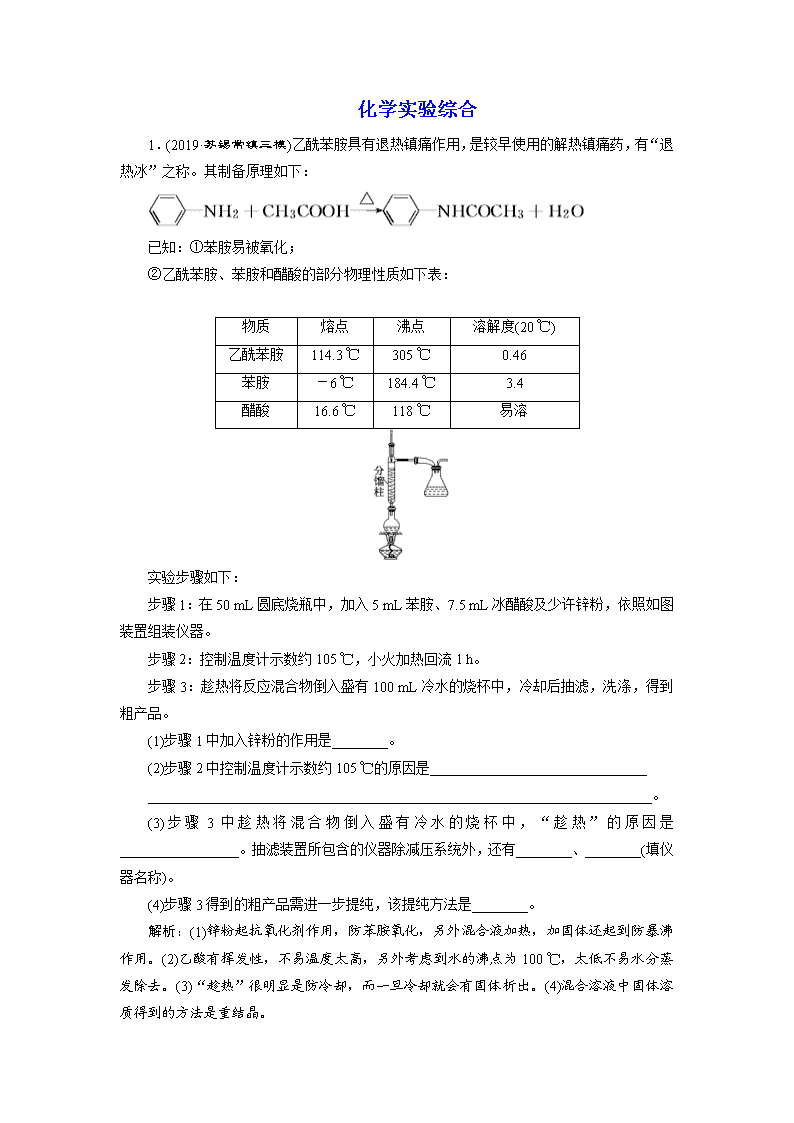
化学实验综合 1.(2019·苏锡常镇三模)乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下: 已知:①苯胺易被氧化; ②乙酰苯胺、苯胺和醋酸的部分物理性质如下表: 物质 熔点 沸点 溶解度(20 ℃) 乙酰苯胺 114.3 ℃ 305 ℃ 0.46 苯胺 -6 ℃ 184.4 ℃ 3.4 醋酸 16.6 ℃ 118 ℃ 易溶 实验步骤如下: 步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。 步骤2:控制温度计示数约105 ℃,小火加热回流1 h。 步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。 (1)步骤1中加入锌粉的作用是________。 (2)步骤2中控制温度计示数约105 ℃的原因是_______________________________ ________________________________________________________________________。 (3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是_________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。 (4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。 解析:(1)锌粉起抗氧化剂作用,防苯胺氧化,另外混合液加热,加固体还起到防暴沸作用。(2)乙酸有挥发性,不易温度太高,另外考虑到水的沸点为100 ℃,太低不易水分蒸发除去。(3)“趁热”很明显是防冷却,而一旦冷却就会有固体析出。(4)混合溶液中固体溶质得到的方法是重结晶。 答案:(1)防止苯胺被氧化,同时起着沸石的作用 (2)温度过高,未反应的乙酸蒸出,降低反应物的利用率;温度过低,又不能除去反应生成的水 (3)若让反应混合物冷却,则固体析出沾在瓶壁上不易处理 吸滤瓶 布氏漏斗 (4)重结晶 2.(2019·苏州一模)氯化镍(NiCl2·6H2O)常用于电镀、陶瓷等工业,某实验室以单质Ni为原料制取氯化镍的实验步骤如下: 已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。 ②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。 (1)在三颈烧瓶中(装置见图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。 ①反应过程中,为提高稀硝酸的利用率,在不改变投料比的情况下,可采取的合理措施有____________________。 ②向A装置中通入空气的作用是搅拌、______________。 ③若镍粉过量,判断反应完成的现象是_____________________________________。 (2)将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。 ①沉淀反应的离子方程式为______________________________________。 ②检验NiCO3·Ni(OH)2沉淀是否洗涤完全的方法是 ________________________________________________________________________ ________________________________________________________________________。 (3)在NiCO3·Ni(OH)2固体中混有少量Fe(OH)3。请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,边加边搅拌,________________________________________________________________________ ________________________________________________________________________。 [NiCl2的溶解度曲线如图所示。实验中须选用的仪器和试剂:pH计、盐酸、乙醇等] 解析:(1)①反应过程中,为提高稀硝酸的利用率,在不改变投料比的情况下,可减缓硝酸的滴加速率或适当降低温度。②向A装置中通入空气的作用是搅拌、将生成的NO氧化为硝酸(或使产生的NO部分转化为NO2,便于NOx被NaOH溶液完全吸收)。③若镍粉过量,即硝酸量不足,将不再产生NO2,要判断反应是否完成,观察三颈烧瓶内有无红棕色气体出现,因此判断反应完成的现象是三颈烧瓶内无红棕色气体出现。 (2)①2Ni2++4HCO===NiCO3·Ni(OH)2↓+3CO2↑+H2O。 ②反应后溶液中含Na2SO4,检验NiCO3·Ni(OH)2沉淀是否洗涤完全,即检验NiCO3·Ni(OH)2洗涤后滤液中是否含SO 。故方法是:取最后一次洗涤液,向其中滴加盐酸酸化的BaCl2溶液,若无明显现象则已洗涤干净。 (3)在NiCO3·Ni(OH)2固体中混有少量Fe(OH)3,加入盐酸后Fe(OH)3转化为Fe3+,NiCO3·Ni(OH)2转化为Ni2+,要除去Fe3+,而Ni2+不沉淀,则用pH计测定反应液3.2查看更多
相关文章
- 当前文档收益归属上传用户