化学卷·2019届河南省商丘市第一高级中学高二10月份月考+化学试卷(解析版)
全*品*高*考*网, 用后离不了!
商丘市一高2017-2018学年第一学期10月份考试
高二化学试卷
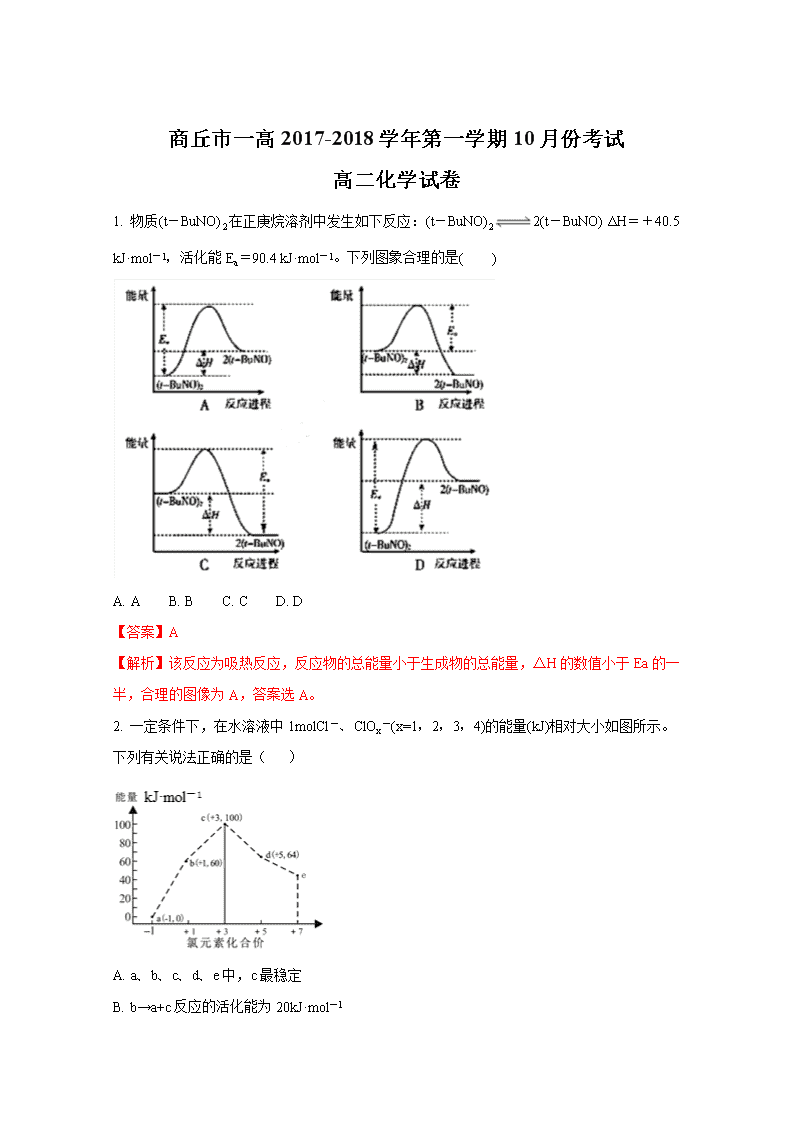
1. 物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)22(t-BuNO) ΔH=+40.5 kJ·mol-1,活化能Ea=90.4 kJ·mol-1。下列图象合理的是( )
A. A B. B C. C D. D
【答案】A
【解析】该反应为吸热反应,反应物的总能量小于生成物的总能量,ΔH的数值小于Ea的一半,合理的图像为A,答案选A。
2. 一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为20kJ·mol-1
C. b→a+d反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=+116kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11:1:2
【答案】D
【解析】根据氯元素的化合价,a、b、c、d、e依次代表Cl-、ClO-、ClO2-、ClO3-、ClO4-。A项,能量越低越稳定,a、b、c、d、e中a最稳定,错误;B项,b→a+c的反应为2ClO-(aq)=Cl-(aq)+ClO2-(aq),反应的ΔH=生成物的总能量-反应物的总能量=0kJ/mol+100kJ/mol-260kJ/mol=-20kJ/mol,无法计算该反应的活化能,错误;C项,b→a+d反应为3ClO-(aq)=2Cl-(aq)+ClO3-(aq),反应的ΔH=生成物的总能量-反应物的总能量=20kJ/mol+64kJ/mol-360kJ/mol=-116kJ/mol,错误;D项,反应中必存在电子守恒n(Cl-)=n(ClO-)+5n(ClO3-),当溶液中a、b、d的浓度之比为11:1:2时电子守恒式成立,正确;答案选D。
点睛:本题的关键是弄清a、b、c、d、e所代表的离子并准确的书写反应的离子方程式,结合ΔH=生成物的总能量-反应物的总能量进行计算。注意氧化还原反应中得失电子守恒的应用。
3. 下列说法正确的是( )
A. KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B. 向Cr2O72- + H2O 2CrO42-+ 2H+ 的平衡体系中滴加10~20滴6mol/LNaOH溶液颜色由橙色变黄色
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2(g)2NH3(g) △H=-38.6kJ·mol-1
D. 已知:
共价键
C-C
C=C
C-H
H-H
键能/ kJ·mol-1
348
610
413
436
则可以计算出反应的ΔH为-384 kJ·mol-1
【答案】B
【解析】A项,氯酸钾溶于水自身电离出钾离子和氯酸根离子,能导电是电解质;SO3
溶于水后和水反应生成硫酸,硫酸电离出阴阳离子而使其溶液导电,电离出阴阳离子的物质是硫酸而不是三氧化硫,所以SO3是非电解质,A错误。B项,Cr2O72-为橙色,CrO42-为黄色,加入NaOH溶液,中和氢离子,氢离子浓度降低,平衡向右移动,溶液由橙色变黄色,B正确;C项,该反应是可逆反应,反应进行不完全,无法确定19.3kJ到底是多少molN2与H2的反应,C错误;D项,反应,苯环中的化学键是六个完全相同的碳碳键,介于单双健之间的一种特殊化学键,表中提供的键能数据不能计算该反应的焓变,D错误。
4. 下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=—1 367.0 kJ·mol-1(燃烧热)
B. NaOH(aq)+HI(aq)=NaI(aq)+H2O(l) ΔH=—57.3 kJ·mol-1(中和热)
C. S(s)+O2(g)=SO3(g) ΔH=-296.8 kJ·mol-1(燃烧热)
D. 2NO2=O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
【答案】B
5. 研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4 min~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
A. 2.5 μmol·L-1·min-1和2.0 μmol·L-1
B. 2.5 μmol·L-1·min-1和2.5 μmol·L-1
C. 3.0 μmol·L-1·min-1和3.0 μmol·L-1
D. 5.0 μmol·L-1·min-1和3.0 μmol·L-1
【答案】B
【解析】试题分析:由图可知,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,
所以4~8 min期间,反应速率为10μmol/L÷4min=2.5μ mol/(L•min);
由图可知,0~4 min期间,反应物浓度变化为(40-20)μmol/L=20μmol/L,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,可知,每隔4分钟,浓度变化量降为原来的一半,所以8~12min浓度变化为5μ mol/L,12~16min浓度变化为2.5μ mol/L,
所以16min时浓度为10μ mol/L-5μ mol/L-2.5μ mol/L=2.5μ mol/L;项B符合题意。
考点:化学反应速率的计算
6. 下列说法中不正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A. 2 个 B. 3 个 C. 4 个 D. 5个
【答案】C
【解析】①反应速率用于衡量化学反应进行的快慢,故①正确;②平衡状态是动态平衡,可逆反应达到化学平衡状态时,正、逆反应速率不为0,故②错误;③决定反应速率的主要因素是反应物的性质,故③正确;④适当增大反应物浓度,提高反应温度都能增大反应速率,故④正确;⑤催化剂具有选择,而且催化剂不可以使平衡移动,故⑤错误;⑥可逆反应A(g)B(g)+C(g),增大压强,物质A、B、C的浓度增大,正反应速率和逆反应速率都增大,故⑥错误;⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率和逆反应速率都减小,只是,逆反应速率减小的程度更大,故⑦错误。故选B。
7. 700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(CO)/mol
n(H2O)/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是 ( )
A. 反应在t1 min内的平均速率为v(H2)=mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
【答案】C
【解析】A、t1 min内H2的平均反应速率与CO的平均反应速率相同,CO的物质的量的变化为0.40 mol,反应在t1 min 内的平均速率为v(CO)=mol·L-1·min-1,选项A错误;B、对比表中数据可知t1时已经达平衡,根据t1时的数据可求得n(CO2)=0.40 mol,n(H2)=0.40 mol,所以该温度下的平衡常数为K==1。因为在相同温度下,所以平衡常数不变,由平衡常数解得平衡时n(CO2)=0.40 mol,选项B错误;C、增大反应物水蒸气的浓度,平衡正向移动,CO转化率增大,水蒸气的转化率降低,水蒸气的体积分数增大,选项C正确;D、温度升高,平衡常数减小,说明温度升高平衡逆向移动,说明正反应为放热反应,选项D错误。答案选C。
8. 在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下2NO2(g)N2O4(g) △H<0]:
容器
物质
起始浓度/(molL-1)
平衡浓度/(molL-1)
Ⅰ
N2O4
0.100
0.040
NO2
0
0.120
Ⅱ
N2O4
0
0.0142
NO2
0.100
0.0716
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)
0
D. 4NH3+5O24NO+6H2O △H<0
【答案】D
【解析】A项,压强一定时升高温度,平衡逆向移动,NH3的质量分数减小,温度一定时增大压强,平衡正向移动,NH3的质量分数增大,与图像不符;B项,压强一定时升高温度,平衡逆向移动,HI的质量分数减小,温度一定时增大压强,平衡不移动,HI的质量分数不变,与图像不符;C项,压强一定时升高温度,平衡正向移动,SO2的质量分数增大,与图像不符,温度一定时增大压强,平衡逆向移动,SO2的质量分数减小;D项,压强一定时升高温度,平衡逆向移动,NO的质量分数减小,温度一定时增大压强,平衡逆向移动,NO的质量分数减小,与图像吻合;答案选D。
点睛:本题的图像采用“定一议二”法分析:(1)任取一曲线,压强相同,升高温度X的质量分数减小;(2)横坐标上任取一点(温度相同),作横坐标的垂直线与两曲线相交,增大压强X的质量分数减小。
10. 在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)2C(g) ΔH<0,某时刻达到平衡后,在时刻改变某一条件,其反应过程如图所示。下列说法正确的是( )
A.
B. I、Ⅱ两过程达到平衡时,A的体积分数I>II
C.时刻改变的条件是向密闭容器中加C
D. I、II两过程达到平衡时,平衡常数IC>A=D=E
B. 若从A点到D点,可采用:温度不变在水中加入少量的酸
C. 若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D. 若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
【答案】C
【解析】试题分析:A.Kw只与温度有关,温度越高Kw越大,温度相同,Kw相等,Kw间的关系:B>C>A=D=E,A正确;B.从A点到D点,c(H+)增大,溶液酸性增强,可采用在水中加入少量酸的方法,B正确;C.A点到C点,c(H+)= c(OH—)>10-7mol/L,因此溶液温度逐渐升高,C错误;D.若处在B点时,Kw=10-12, pH(酸)+pH(碱)=12的硫酸与KOH溶液等体积混合溶液显中性,D正确。本题选不正确的,故选C。
考点:考查了水的电离平衡及其影响因素的相关知识。
15. 25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )
A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,随温度升高而减小
D. a→c过程中水的电离程度始终增大
【答案】C
【解析】根据图知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱;A.Ka(HA)= c(H+)c(A-)/ c(HA)=10-3×10-3/0.1=1×10-5mol/L,A错误;B.b点二者恰好反应,溶液显中性,则c (B+)=c(A-)>c(OH-)=c(H+),B错误;C.c(A−)/c(OH−)•c(HA)=1/Kh,水解平衡常数只与温度有关,升高温度促进水解,水解平衡常数增大,因此该比值随温度升高而减小, C正确;D.酸或碱抑制水的电离,盐类水解促进水的电离,所以b点水电离出的c(H+)>10-7mol/L,而a、c两点水电离出的c(H+)<10-7mol/L,D错误;答案选C。
点睛:本题考查酸碱混合溶液定性判断,侧重考查学生图象分析及判断能力,明确各个数据含义及各点溶液中溶质成分及其性质是解本题关键,易错选项是D,注意酸碱盐对水电离平衡的影响变化规律。
16. 某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
【答案】A
【解析】①pH=1的强酸溶液,加水稀释后,溶液中c(H+)减小,OH-浓度会增大,错误;②NH4Cl溶液中存在水解平衡:NH4++H2ONH3·H2O+H+,浓度越大水解程度越小,1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量前者大于后者,错误;③NaOH属于强碱完全电离使溶液呈碱性,CH3COONa、NaClO、NaHCO3都属于强碱弱酸盐,由于水解使溶液呈碱性,酸性由强到弱的顺序为:CH3COOHH2CO3HClO,则水解能力:CH3COO-HCO3-ClO-,pH相等的四种溶液溶质的物质的量浓度由小到大顺序为:d < b < c < a,正确;④由于pH=8.3,说明HCO3-的水解能力大于HCO3-的电离能力,NaHCO3溶液中:c(Na+) > c(HCO3-) > c(H2CO3)> c(CO32-),错误;⑤若一元酸为强酸,两者恰好完全反应生成强酸强碱盐,溶液呈中性,c(OH-)=c(H+);若一元酸为弱酸,反应后酸过量,溶液呈酸性,c(OH-) c(H+),正确;⑥溶液中存在电荷守恒式c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液pH=4说明CH3COOH的电离程度大于CH3COO-的水解程度,混合溶液中:c(CH3COO-)c(Na+)c(CH3COOH),则溶液中c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+),正确;正确的有③⑤⑥,答案选A。
17. 若用AG来表示溶液的酸度,其表达式为:AG=lg]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
A. 该滴定实验最好选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大
D. 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH−)
【答案】D
【解析】A、 0.1 mol/L 的MOH溶液,AG=-8,AG=lg],=10-8,c(H+)C(OH― )=10-14,C(OH― )=10-3
mol/L,MOH为弱碱,恰好反应时溶液显酸性,选甲基橙作指示剂,故A错误;B、AG=0时,c(H+)=C(OH― )=10-7,溶液呈中性时,溶液的中所加HCl小于10mL,故B错误;C、滴定过程中从A点到D点,溶液中水的电离程度先逐渐变大,后逐渐减小,故C错误;D、若B点加入的盐酸溶液体积为5mL,则所得溶液中含等物质量的MOH、MCl,根据质子守恒有:c(M+)+2c(H+)=c(MOH)+2c(OH−),或根据电荷守恒和物料守恒两式加减消元消去Na+ 的浓度,故D正确;故选D。
18. 改变0.1二元弱酸溶液的pH,溶液中的、、的物质的量分数随pH的变化如图所示已知]。下列叙述错误的是( )
A. pH=1.2时,
B.
C. pH=2.7时,
D. pH=4.2时,
【答案】D
【解析】A、根据图像,pH=1.2时,H2A和HA-相交,则有c(H2A)=c(HA-),故A说法正确;B、pH=4.2时,c(A2-)=c(HA-),根据第二步电离HA-H++A2-,得出:K2(H2A)=c(H+)×c(A2-)/c(HA-)= c(H+)=10-4.2,故B说法正确;C、根据图像,pH=2.7时,H2A和A2-相交,则有c(H2A)=c(A2-),故C说法正确;D、根据pH=4.2时,c(HA-)=c(A2-),且物质的量分数约为0.48,而c(H+)=10-4.2,可知c(HA-)=c(A2-)>c(H+),故D说法错误。
19. (1)1L 0.05mol/LNaHCO3溶液与足量的盐酸完全反应,放出10kJ的热量,写出此反应的热化学方程式________________________________________________________
(2)写出明矾溶液与碳酸氢钠溶液反应的离子方程式______________
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3
,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象_________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5mol·L−1)时,溶液中c(Ag+)为_______mol·L−1,此时溶液中c(CrO42−)等于__________mol·L−1。(已知Ag2 CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
【答案】 (1). NaHCO3(aq)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) △H= -200kJ/mol (2). Al3++3HCO3-=Al(OH)3↓+3CO2↑ (3). 当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变 (4). 2×10-5 (5). 5 ×10-3
【解析】试题分析:本题考查热化学方程式的书写,双水解反应离子方程式的书写,外界条件对化学平衡的影响,溶度积的计算。
(1)n(NaHCO3)=0.05mol/L1L=0.05mol,1molNaHCO3参加反应放出的热量为=200kJ,反应的热化学方程式为NaHCO3(aq)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) △H= -200kJ/mol。
(2)明矾溶液和碳酸氢钠溶液发生双水解反应,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑。
(3)当少量酸性物质进入血液中,H+浓度增大,平衡向右移动,使H+浓度变化较小,血液的pH基本不变;当少量碱性物质进入血液中,OH-与H+反应,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。
(4)当溶液中Cl-恰好沉淀完全时,Ksp(AgCl)=c(Ag+)·c(Cl-)=2.010-10,c(Ag+)=2.010-10(1.0×10−5)=2.010-5(mol/L)。Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=2.0×10−12,c(CrO42-)=2.0×10−12(2.010-5)2=510-3(mol/L)。
20. I.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定装置如图
(1)图中A的名称是:_____________________________
(2)若实验过程中酸碱添加过慢,所得△H将________(填:偏大、偏小或者无影响)
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
实验次数
起始温度t1/℃
终止温度
t2/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=_____________(取小数点后一位).
II.为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
(4)请完成此实验设计,其中:V6=________,V8=___________
(5)该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因________________________。
III.利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定物质的量浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:移取ymL BaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba
2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
(6)BaCl2溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量盐酸滴至锥形瓶外,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。
【答案】 (1). 环形玻璃搅拌棒 (2). 偏大 (3). -53.5kJ/mol (4). 7 (5). 9.5 (6). Zn与CuSO4反应生成了Cu,Zn 和Cu形成了原电池加快反应速率 (7). (8). 偏小
【解析】试题分析:本题考查中和热的测定、数据处理和误差分析,实验探究外界条件对化学反应速率的影响,间接酸碱滴定和误差分析。
I.(1)图中A的名称为环形玻璃搅拌棒。
(2)由于中和热的ΔH0,若实验过程中酸碱添加过慢,热量损失过多,所得ΔH将偏大。
(3)四次实验的温度差依次为4℃、6.1℃、3.9℃、4.1℃,第2次实验产生明显实验误差不参与求平均,所以第1、3、4三次实验的温度差平均值为(4℃+3.9℃+4.1℃)3=4℃,实验过程中放出的热量Q=cmΔt=4.18J/(g•℃)(1g/cm350mL+1g/cm330mL)4℃=1337.6J;反应过程中硫酸过量,生成n(H2O)=n(NaOH)=0.5mol/L0.05L=0.025mol,则中和热ΔH=-=-53.5kJ/mol。
II.(4)实验目的是探究硫酸铜的量对氢气生成速率的影响,用控制变量法,控制其他条件完全相同,改变硫酸铜的量,则V1=V2=V3=V4=V5=30mL,每次实验中溶液总体积为30mL+10mL+0mL=40mL,则V6=40mL-30mL-3mL=7mL,V8=40mL-30mL-0.5mL=9.5mL。
(5)当加入少量CuSO4溶液时,生成氢气的速率会大大提高,主要原因是Zn与CuSO4反应生成了Cu,Zn 、Cu与稀硫酸形成了原电池加快反应速率。
III.(6)步骤I中消耗H+物质的量为bV0/1000mol,则xmLNa2CrO4溶液中n(CrO42-)=bV0/1000mol;步骤II中消耗H+物质的量为bV1/1000mol,则与BaCl2反应后剩余的n(CrO42-)=bV1/1000mol,与BaCl2反应的n(CrO42-)=(bV0-bV1)/1000mol,n(BaCl2)=(bV0-bV1)/1000mol,c(BaCl2)=(bV0-bV1)/1000mol=mol/L。若步骤Ⅱ中滴加盐酸时有少量盐酸滴至锥形瓶外,V1偏大,Ba2+浓度测量值将偏小。
点睛:本题的两个注意点:I中进行中和热测定的数据分析时,对明显有实验误差的第2次温度差不参与求温度差的平均值。II中设计实验方案探究硫酸铜的量对化学反应速率的影响时采用“控制变量法”。
21. 氧和氮是大气的主要成分,氮的化合物在工业上均有重要的应用。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:________________
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是__________________。(填序号)
①单位时间内生成n molN2的同时生成2n molNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态。
为提高H2的转化率,实际生产中宜采取的措施有________(填字母)。
A.及时移出氨 B.最适合催化剂活性的适当高温
C.适当增大压强 D.循环利用和不断补充氮气
E.减小压强 F.降低温度
(3)电厂烟气脱氮的主反应①: 4NH3(g)+6NO(g)5N2(g)+6H2O(g),副反应②: 2NH3(g)+8NO(g)5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400K~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是_____________________________
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2 L
的恒容密闭容器中充入2mol N2H4,发生反应N2H4(g)N2(g)+2H2(g),(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=_______________。
肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2_______ (填“大于”或“小于”) p1。
【答案】 (1). H2O(l)=H2(g)+ O2(g) ΔH=+286 kJ/mol (2). ①③⑤⑥ (3). ABCD (4). 反应①为放热反应,温度升高平衡左移,N2含量降低;反应②为吸热反应,温度升高平衡右移,N2O含量升高 (5). 1 (6). 大于
【解析】试题分析:本题盖斯定律的应用,化学平衡的标志,化学平衡常数的计算,图像分析以及化学反应速率和化学平衡理论的实际应用。
(1)将三个热化学方程式编号:
H2SO4(aq)=SO2(g)+H2O(l)+O2(g) ΔH1=+327kJ·mol-1(①式)
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+ H2SO4(aq) ΔH2=-151 kJ·mol-1(②式)
2HI(aq)=H2(g)+I2(s) ΔH3=+110 kJ·mol-1(③式)
应用盖斯定律,将①式+②式+③式得H2O(l)=H2(g)+O2(g) ΔH=ΔH1+ΔH2+ΔH3=+327kJ/mol-151kJ/mol+110kJ/mol=+286kJ/mol,水分解制备氢气的热化学方程式为H2O(l)=H2(g)+ O2(g) ΔH=+286 kJ/mol。
(2)①单位时间内生成n molN2的同时生成2n molNH3,表明正、逆反应速率相等,说明反应达到平衡状态;②1个N≡N键断裂的同时,有6个N—H键形成,只表示了正反应,不能说明反应达到平衡状态;③1个N≡N键断裂的同时,有3个H—H键形成,表示正、逆反应速率相等,说明反应达到平衡状态;④该反应中所有物质都是气体,气体的质量始终不变,容器的容积不变,混合气体的密度始终不变,混合气体的密度不再改变不能说明反应达到平衡状态;⑤建立平衡的过程中气体分子物质的量减小,
恒容时混合气体的压强减小,平衡时气体物质的量不变,混合气体的压强不变,混合气体的压强不再改变说明反应达到平衡状态;⑥混合气体的质量始终不变,建立平衡过程中气体物质的量减小,混合气体的平均相对分子质量增大,平衡时气体物质的量不变,混合气体的平均相对分子质量不变,混合气体的平均相对分子质量不再改变说明反应达到平衡状态;能说明反应已达到平衡状态的为①③⑤⑥。
A项,及时移出氨平衡正向移动,提高H2的转化率,实际生产中使用;B项,最适合催化剂活性的适当高温可加快反应速率,实际生产中使用;C项,适当增大压强,一方面加快反应速率,另一方面平衡正向移动,提高H2的转化率,实际生产中使用;D项,循环利用和不断补充氮气,平衡正向移动,提高H2的转化率,实际生产中使用;E项,减小压强,平衡逆向移动,H2转化率降低,且反应速率慢,实际生产中不使用;F项,降低温度,虽然平衡正向移动,提高H2的转化率,但反应速率慢,实际生产中不使用;答案选ABCD。
(3)由图像知,升高温度N2的含量降低,反应①为放热反应;升高温度N2O的含量增加,反应②为吸热反应。则在400K~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是:反应①为放热反应,温度升高平衡左移,N2含量降低;反应②为吸热反应,温度升高平衡右移,N2O含量升高。
(4)设从起始到平衡过程中转化N2H4的物质的量为x,用三段式
N2H4(g)N2(g)+2H2(g)
n(起始)(mol) 2 0 0
n(转化)(mol) x x 2x
n(平衡)(mol) 2-x x 2x
由图像知平衡时=3,=3,解得x=1mol,则平衡时N2H4、N2、H2的物质的量浓度依次为0.5mol/L、0.5mol/L、1mol/L,反应的平衡常数K=c(N2)·c2(H2)]/c(N2H4)==1。
肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝,说明分解生成NH3,反应的方程式为3N2H4(g)4NH3(g)+N2(g),其他条件不变时增大压强,平衡逆向移动,N2H4的体积分数增大,图像中相同温度下,p2平衡时N2H4的体积分数大于p1,则p2大于p1。
22. 已知醋酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+ K=1.75×10-5。
(1)计算0.01mol/L的CH3COOH溶液的pH=_________。(已知lg1.75=0.24)
(2)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___________mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=______________mol/L。
(3)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(4)SOCl2是一种液态化合物,向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有雾形成,产生可以使品红溶液褪色的气体,往溶液中滴加AgNO3溶液,有白色沉淀析出,请写出SOCl2与水反应的化学方程式______________________________,蒸干AlCl3溶液不能得到无水AlCl3,用SOCl2和AlCl3·6H2O混合加热可以得到无水AlCl3,试解释原因______________________
(5)常温下,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
【答案】 (1). 3.38 (2). 10-10 (3). 10-4-10-10 (4). bcef (5). SOCl2+H2O=SO2↑+2HCl↑ (6). SOCl2与AlCl3·6H2O中的结晶水作用生成无水AlCl3及SO2和HCl ,SO2和HCl抑制AlCl3水解 (7). 1.25×10-3 或0.00125
【解析】试题分析:本题考查电离平衡常数和水解平衡常数的计算,外界条件对弱电解质电离平衡的影响,盐类水解的应用。
(1)根据CH3COOH的电离方程式,溶液中c(H+)c(CH3COO-),c(CH3COOH)=0.01mol/L-c(CH3COO-)0.01mol/L,K=c2(H+)/0.01=1.75×10-5,c(H+)=(mol/L),pH=-lgc(H+)=-lg=3.38。
(2)0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合恰好完全反应,所得溶液为CH3COONa溶液,溶液的pH=10,溶液中c(H+)=110-10mol/L,c(OH-)=110-4mol/L,由于CH3COO-的水解促进了水的电离,该混合溶液中由水电离出的c(OH-)等于溶液中的c(OH-),为110-4mol/L。溶液中的电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-4-10-10)mol/L。
(3)a项,加入少量0.10 mol·L-1的稀盐酸,电离平衡逆向移动,CH3COOH电离程度减小
;b项,加热CH3COOH溶液,升高温度电离平衡正向移动,CH3COOH电离程度增大;c项,加水稀释促进CH3COOH的电离,CH3COOH的电离程度增大;d项,加入少量冰醋酸,虽然电离平衡正向移动,但CH3COOH的电离程度减小;e项,加入少量镁粉,Mg与H+反应,电离平衡正向移动,CH3COOH的电离程度增大;f项,加入少量0.10 mol·L-1的NaOH溶液,OH-与H+反应,电离平衡正向移动,CH3COOH的电离程度增大;使CH3COOH电离程度增大的是bcef。
(4)SOCl2与水作用产生可以使品红溶液褪色的气体,说明生成SO2,往溶液中滴加AgNO3溶液,有白色沉淀析出,说明反应后的溶液中有Cl-,SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑。蒸干AlCl3溶液不能得到无水AlCl3,用SOCl2和AlCl3·6H2O混合加热可以得到无水AlCl3,这是因为SOCl2与AlCl3·6H2O中的结晶水作用生成无水AlCl3及SO2和HCl ,SO2和HCl抑制AlCl3水解。
(5)K=c(NH3·H2O)·c(H2CO3)]/c(NH4+)·c(HCO3-)]= c(NH3·H2O)·c(H2CO3)·c(H+)·c(OH-)]/c(NH4+)·c(HCO3-)·c(H+)·c(OH-)]=Kw/(KbKa1)==1.2510-3。