- 2021-07-07 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届江西省九江第一中学高二上学期期末考试(2018
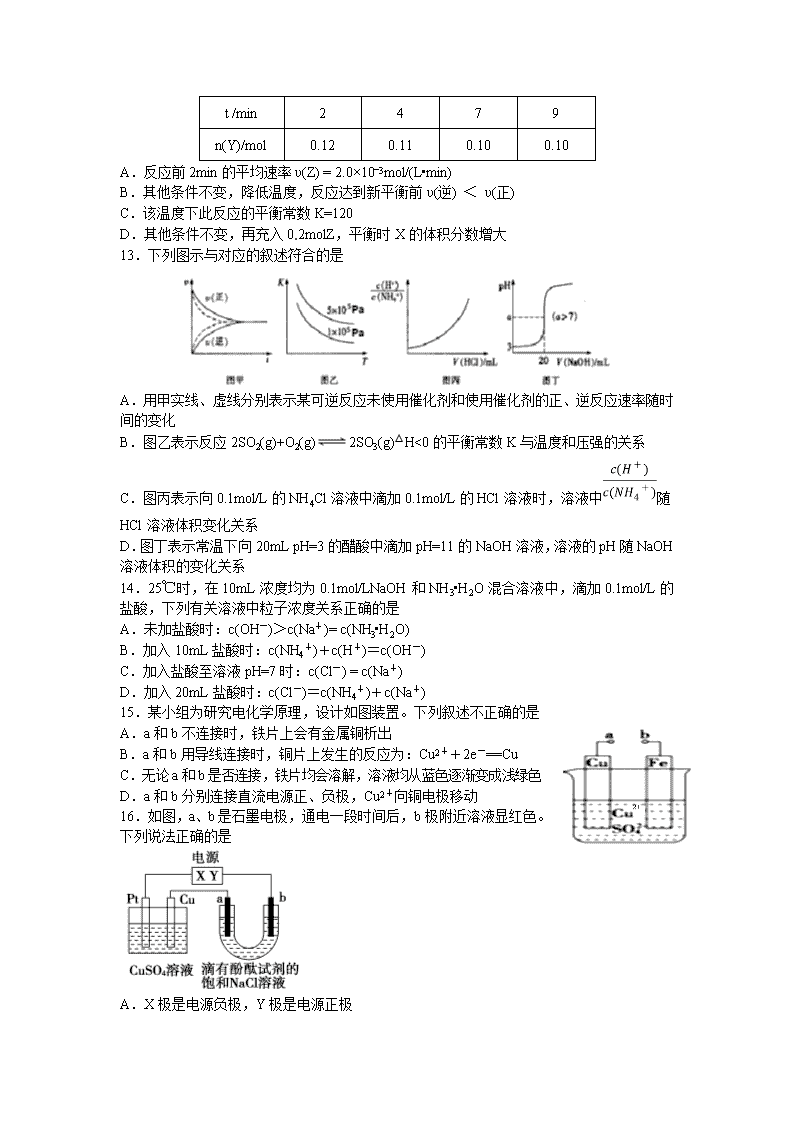
九江一中2017—2018学年上学期期末考试 高二化学试卷 注意事项: 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,答题时间90分钟。答题前,考生务必将自己的姓名、考生号填写在答题卡上。 2.第Ⅰ卷(选择题)答案必须使用2B铅笔填涂;第Ⅱ卷(非选择题)必须将答案写在答题卡上,写在本试卷上无效。 3.考试结束,将答题卡交回,试卷由个人妥善保管。 可能用到的相对原子质量: H:1 C:6 O:8 Na:23 S:32 Fe:56 Cu:32 第Ⅰ卷(选择题 共48分) 一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意) 1.化学是一门实用性很强的科学,与社会、环境、生活等密切相关。下列说法正确的是 A.明矾净水与自来水的杀菌消毒原理是一样的 B.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 C.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化 D.糖类、油脂、蛋白质都是高分子化合物,它们都能发生水解反应 2.下列食用品的有效成分正确的是 A.C6H12O6 B.Na2CO3 C.CH3COOH D.Al(OH)3 3.下列说法正确的是 A.反应物的热效应与是否使用催化剂无关 B.4NO2(g)+O2(g)=2N2O5 (g)的过程属于熵增加过程 C.由C(石墨)= C(金刚石)△H﹥0,可知金刚石比石墨稳定 D.对任何化学反应来说,反应速率越大,反应现象就越明显 4.化学中有许多的 “守恒或相等”,下列说法中不满足守恒或相等的是 A.化学反应中,参加反应物总质量与生成物总质量 B.化学反应中,反应物总能量与生成物总能量 C.溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数 D.溶液中,稀释前溶质质量与稀释后溶质质量 5.下列关于有机物说法不正确的是: A. 命名为3-甲基-1-丁炔 B.沸点比较:乙醇>丙烷>乙烷 C.属于芳香烃且属于苯的同系物 D.含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 6.下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃只有一种的是 A.CH3Cl B. C. D. 7.有关热化学方程式书写与对应表述均正确的是 A.稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) △H = +57.3 kJ·mol-1 B.已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 C.密闭容器中,0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol-1 D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g) △H= —38.6kJ·mol-1 8.常温下,下列各组离子可能大量共存的是 A. pH=1的溶液中:K+、Cu2+、Cl-、CO32- B.0.1mol/L FeCl3溶液中:Al3+、SO42-、I-、SCN- C.使pH 试纸变红的溶液中:Fe2+、Mg2+、NO3-、Cl- D.由水电离产生的c(H+)=1×10-13mol/L的溶液中:Cl-、NO3-、Ba2+、Na+ 9.下列溶液,其电离方程式不正确的是 A.NH3•H2O = NH4+ + OH- B.NaOH = Na+ + OH- C.CH3COOH CH3COO- + H+ D.NaHSO4 = Na+ + H++SO42- 10.某校学生配置标准浓度的NaOH溶液来测定未知浓度的盐酸溶液,下列有关操作和说法正确的是 . A.用图甲所示装置准确称得2.21g NaOH固体 B.用图乙所示操作转移NaOH溶液到容量瓶中 C.用图丙所示操作排除碱式滴定管中的气泡 D.用图丁所示装置以NaOH标准液滴定未知浓度盐酸溶液 11.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是 (1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl (4) 向水中加入明矾晶体 (5) 向水中加入NaHCO3固体 (6) 向水中加KHSO4固体 A.(4) B.(1) (4) (6) C.(1) (3) (6) D.(4) (6) 12.在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g) 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是 t /min 2 4 7 9 n(Y)/mol 0.12 0.11 0.10 0.10 A.反应前2min的平均速率υ(Z) = 2.0×10-3mol/(L•min) B.其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正) C.该温度下此反应的平衡常数K=120 D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大 13.下列图示与对应的叙述符合的是 A.用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化 B.图乙表示反应2SO2(g)+O2(g)2SO3(g)△H<0的平衡常数K与温度和压强的关系 C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中随HCl溶液体积变化关系 D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系 14.25℃时,在10mL浓度均为0.1mol/LNaOH和NH3•H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是 A.未加盐酸时:c(OH-)>c(Na+)= c(NH3•H2O) B.加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-) C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+) D.加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+) 15.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是 A.a和b不连接时,铁片上会有金属铜析出 B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-==Cu C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 D.a和b分别连接直流电源正、负极,Cu2+向铜电极移动 16.如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是 A.X极是电源负极,Y极是电源正极 B.电解过程中CuSO4溶液的pH逐渐增大 C.a极的电极反应是2Cl--2e-=Cl2↑ D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体 第Ⅱ卷(非选择题 共52分) 二、填空题(共52分) 17.(10分) (1)(CH3)2CHCH(CH3)2的系统命名为___________________; (2)有机物的结构可用“键线式”简化表示,CH3-CH=CH-CH3的键线式为________; (3)下列化合物分子中,在核磁共振氢谱图中能给出一种信号的是( ) A.CH3CH2CH3 B. CH3COCH2CH3 C.CH3CH2OH D.CH3OCH3 (4)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是 ( ) A.红外光谱 B. 1H核磁共振谱 C.质谱法 D.与钠反应 (5)已知乙烯分子是平面结构, 1,2-二氯乙烯可形成和两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是( ) A.1-丙烯 B.4-辛烯 C.1-丁烯 D.2-甲基-1-丙烯 18.(12分) 有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2 (SO4)3 ⑤CH3COOH ⑥NaHCO3 (1)25℃时,0.1mol·L-1①溶液呈 性,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示); (2)常温(填“>”、“=”或“<”)下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”),溶液的pH:③_________⑥(填“>”、“=”或“<”); (3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式); (4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。 A.c(H+) B. C.c(H+)·c(OH-) 19.(12分) 373K时,某 1L密闭容器中加入2mol NH3 发生如下可逆反应:2NH3(g)N2(g)+3 H2(g)。其中物质H2的物质的量变化如下图所示。 (1)前 20 s内NH3(g)的平均反应速率为 ; (2)373K时该反应的平衡常数的值为 ; (3)若在此平衡体系中再加入 1mol的NH3,与原平衡比较,新平衡时 NH3的转化率 (填“增大”或“减小”,下同),NH3的平衡浓度 。 (4)将原平衡升温至 473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3 的2倍,该反应的正反应为(填“放热反应”或 “吸热反应”) ,为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同) 。 a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2 20.(12分) 某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。 (1)查阅资料知:NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3-+3HSO3-==3SO42-+I-+3H+,则第二步反应的离子方程式为________________; (2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。 编号 0.01mol/LNaHSO3溶液/mL 0.01mol/L KIO3 溶液/mL H2O/mL 反应温度 /℃ 溶液变蓝所用时间t/s ① 6.0 10.0 4.0 15 t1 ② 6.0 14.0 0 15 t2 ③ 6.0 a b 25 t3 实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”); 实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________; (3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的SO42—对反应起催化作用,故设计实验验证,试完成下表中内容。 实验步骤(不要求写出具体操作过程) 预期实验现象和结论 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率υ(甲) 在烧杯乙中先加入少量① ,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率υ(乙) ②若υ(甲) υ(乙),则假设不成立 ③若υ(甲) υ(乙),则假设成立 (填“>”、“=”或“<”) 21.(6分). A、B、C三种强电解质,它们在水中电离出的离子如下表所示: 阳离子 Cu2+ Na+ 阴离子 NO3- SO42- Cl- 右上图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了32g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图2所示。据此回答下列问题: (1)M为电源的__________极(填“正”或“负”); (2)写出甲烧杯中反应的化学方程式____________________; (3)计算电极f上生成的气体在标准状况下的体积 。 九江一中2017—2018学年上学期期末测试参考答案 高二·化学 一、 选择题(每空3分) 题号 1 2 3 4 5 6 7 8 9 10 答案 B C A B D B C D A C 题号 11 12 13 14 15 16 答案 A B C B D C 二、 填空题(除有标明为1分外,其余每空2分) 17.(10分)(1)2,3—二甲基丁烷 (2) (3)D (4)C (5)B 18.(12分)(1)中 < NH4++H2ONH3·H2O+H+ (2)相同 > (3)Al2(SO4)3 (4)B 19. (12分)(1) 0.02mol/(L·s) (2) 0.48 (3) 减小 增大 (4)吸热反应 ab 20.(12分) (1)IO3—+5I—+6H+=3I2+3H2O (2)KIO3溶液的浓度 > 10.0(1分) 4.0(1分) (3)①Na2SO4粉末 ②=(1分) ③<(1分) 21.(6分) (1) 负 (2) 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ (3) 5.6L查看更多