- 2021-07-06 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版第23讲弱电解质的电离平衡学案
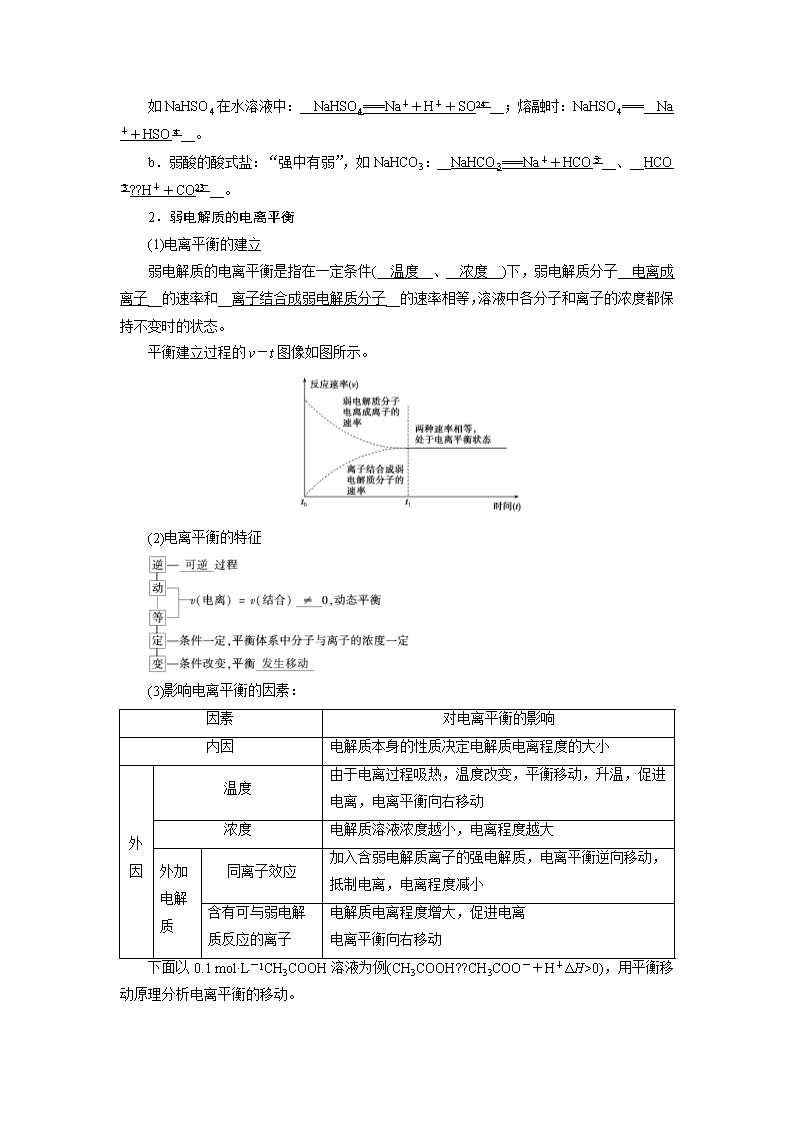
第八章 水溶液中的离子平衡 第23讲 弱电解质的电离平衡 考纲要求 学法点拨 1.了解电解质的概念,了解强电解质和弱电解质的概念。 2.理解电解质在水中的电离以及电解质溶液的导电性。 3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。 本讲内容的高考考点主要有三个,一是强弱电解质的判断与比较;二是外界条件对电离平衡的影响,往往结合图象进行考查,同时考查溶液的pH变化及溶液的导电性;三是电离平衡常数,主要命题角度为电离平衡常数的计算及应用。 考点一 弱电解质的电离平衡 Z 1.强、弱电解质 (1)定义与物质类别 (2)与化合物类别的关系 强电解质主要是大部分__离子__化合物及某些__共价__化合物,弱电解质主要是某些__共价__化合物。 (3)电离方程式的书写——“强等号,弱可逆,多元弱酸分步离” ①强电解质:如H2SO4:__H2SO4=2H++SO__ ②弱电解质: a.一元弱酸,如CH3COOH:__CH3COOH??CH3COO-+H+__。 b.多元弱酸,分步电离,分步书写且第一步电离程度远远大于第二步的电离程度,如H2CO3:__H2CO3??H++HCO HCO??H++CO__。 c.多元弱碱,分步电离,一步书写。如Fe(OH)3:__Fe(OH)3??Fe3++3OH-__。 ③酸式盐: a.强酸的酸式盐 如NaHSO4在水溶液中:__NaHSO4===Na++H++SO__;熔融时:NaHSO4===__Na++HSO__。 b.弱酸的酸式盐:“强中有弱”,如NaHCO3:__NaHCO3===Na++HCO__、__HCO??H++CO__。 2.弱电解质的电离平衡 (1)电离平衡的建立 弱电解质的电离平衡是指在一定条件(__温度__、__浓度__)下,弱电解质分子__电离成离子__的速率和__离子结合成弱电解质分子__的速率相等,溶液中各分子和离子的浓度都保持不变时的状态。 平衡建立过程的v-t图像如图所示。 (2)电离平衡的特征 (3)影响电离平衡的因素: 因素 对电离平衡的影响 内因 电解质本身的性质决定电解质电离程度的大小 外因 温度 由于电离过程吸热,温度改变,平衡移动,升温,促进电离,电离平衡向右移动 浓度 电解质溶液浓度越小,电离程度越大 外加电解质 同离子效应 加入含弱电解质离子的强电解质,电离平衡逆向移动,抵制电离,电离程度减小 含有可与弱电解质反应的离子 电解质电离程度增大,促进电离 电离平衡向右移动 下面以0.1 mol·L-1CH3COOH溶液为例(CH3COOH??CH3COO-+H+ΔH>0),用平衡移动原理分析电离平衡的移动。 改变条件 平衡移 动方向 c(CH3COOH) n(H+) c(H+) c(CH3COO-) 电离 程度 导电 能力 电离平 衡常数 加水稀释 __右移__ __减小__ __增大__ __减小__ __减小__ __增大__ __减弱__ __不变__ 加少量冰醋酸 __右移__ __增大__ __增大__ __增大__ __增大__ __减小__ __增强__ __不变__ 通入HCl气体 __左移__ __增大__ __增大__ __增大__ __减小__ __减小__ __增强__ __不变__ 加NaOH固体 __右移__ __减小__ __减小__ __减小__ __增大__ __增大__ __增强__ __不变__ 加CH3COONa固体 __左移__ __增大__ __减小__ __减小__ __增大__ __减小__ __增强__ __不变__ 加入镁粉 __右移__ __减小__ __减小__ __减小__ __增大__ __增大__ __增强__ __不变__ 升高温度 __右移__ __减小__ __增大__ __增大__ __增大__ __增大__ __增强__ __增大__ 特别提醒: (1)稀醋酸加水稀释时,溶液中的各离子浓度并不是都减小,如c(OH-)是增大的。 (2)电离平衡右移,电解质分子的浓度不一定减小,如稀醋酸中加入冰醋酸。 (3)电离平衡右移,电离程度也不一定增大。 3.电离度: (1)概念:一定条件下,当弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来弱电解质总分子数的百分数。 (2)表达式:α=×100%。 (3)意义:衡量弱电解质的电离程度,在相同条件下(浓度、温度相同),不同弱电解质的电离度越大,弱电解质的电离程度越大。 (4)一元弱酸(HA)、一元弱碱(如NH3·H2O)中电离度(α)与c(H+)、c(OH-)的关系。 设一定温度下,浓度为c mol·L-1醋酸的电离度为αa。 CH3COOH??CH3COO-+H+ 起始/mol·L-1 c 0 0 变化/mol·L-1 c·αa cαa cαa 平衡/mol·L-1 c-cαa≈c cαa cαa 则c(H+)=cαa Ka==cα 同理:对于一元弱碱(如NH3·H2O),c(OH-)=cαb。 X 1.判断正误,正确的画“√”,错误的画“×”。 (1)溶液导电能力弱的电解质一定是弱电解质。( × ) (2)稀醋酸中加入少量醋酸钠能增大醋酸的电离程度。( × ) (3)温度升高,弱电解质的电离平衡右移。( √ ) (4)弱电解质溶液中存在溶质分子,而强电解质溶液中不存在溶质分子。( √ ) (5)AgCl的水溶液不导电,而CH3COOH的水溶液能导电,故AgCl是弱电解质,CH3COOH是强电解质。( × ) (6)一定条件下,CH3COOH??CH3COO-+H+达到平衡时,c(H+)=c(CH3COO-)。( × ) (7)向0.1 mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起溶液中c(H+)减小。( √ ) (8)弱电解质的导电能力一定小于强电解质。( × ) (9)熔融时是否导电是区别强电解质与弱电解质的标准。( × ) (10)除水的电离平衡外,醋酸溶液中存在电离平衡,而盐酸中不存在电离平衡( √ ) (11)醋酸溶液中,CH3COOH达到电离平衡时,溶液中检测不出CH3COOH分子( × ) (12)电离平衡右移,电解质分子的浓度一定减小( × ) (13)向稀氨水中加入盐酸,盐酸与NH3·H2O反应,使NH3·H2O??NH+OH-平衡左移( × ) (14)氨水中,当c(NH)=c(OH-)时,表示氨水已达到电离平衡( × ) 2.向0.1 mol·L-1的H2S溶液中加入适量水,下列物理量增大的是( A ) A.电离度 B.c(H+) C.c(S2-) D.c(H2S) 3.常温下向0.1 mol·L-1的氨水中加入少量试剂X后,溶液的碱性减弱,则X不可能是下列哪种物质( D ) A.H2O B.HCl C.NH4Cl D.NaOH 4.稀释某一弱电解质溶液时,所有微粒浓度都会减小吗? 答案:对于弱电解质的电离平衡体系的相关微粒,其浓度都是减小的。但由于还存在H2O的电离平衡,对弱酸溶液稀释时,c(OH-)会增大;对弱碱溶液稀释时,c(H+)会增大。 题组一 弱电解质的判断 1.(2016·上海单科)能证明乙酸是弱酸的实验事实是( B ) A.CH3COOH溶液与Zn反应放出H2 B.0.1 mol/L CH3COONa溶液的pH大于7 C.CH3COOH溶液与Na2CO3反应生成CO2 D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红 [解析] A.只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B.该盐水溶液显碱性,由于NaOH是强碱,故可以证明乙酸是弱酸,正确;C.可以证明乙酸的酸性比碳酸强,但不能证明其是弱酸,错误;D.可以证明乙酸具有酸性,但是不能证明其酸性强弱,错误。 2.(2018·广东启迪教育段考)下列事实一定能证明HNO2是弱电解质的是( C ) ①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2和NaCl不能发生反应 ④常温下0.1 mol·L-1HNO2溶液的pH=2.1 ⑤NaNO2和H3PO4反应,生成HNO2 ⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8 A.①④⑥ B.①②③④ C.①④⑤⑥ D.全部 [解析] 常温下NaNO2溶液pH大于7,说明亚硝酸钠是强碱弱酸盐。则HNO2是弱电解质,故①正确;②溶液的导电性与离子浓度及离子所带电荷数有关,用HNO2溶液做导电实验,灯泡很暗,不能证明HNO2为弱电解质,故②错误;③HNO2和NaCl不能发生反应,只能说明不符合复分解反应发生的条件,但不能说明HNO2是弱电解质,故③错误;④常温下0.1 mol·L-1HNO2溶液的pH=2.1,说明HNO2不能完全电离,即说明HNO2为弱电解质,故④正确:⑤较强酸可以制取较弱酸。NaNO2和H3PO4反应,生成HNO2,说明HNO2的酸性弱于H3PO4,则HNO2为弱电解质,故⑤正确;⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8,说明HNO2为弱电解质,故⑥正确。 萃取精华: 判断强、弱电解质的方法 1.电解质是否完全电离 在溶液中强电解质完全电离,弱电解质部分电离。据此可以判断HA是强酸还是弱酸,如:若测得0.1 mol/L的HA溶液的pH=1,则HA为强酸;若pH>1,则HA为弱酸。 2.是否存在电离平衡 强电解质不存在电离平衡,弱电解质存在电离平衡,在一定条件下电离平衡会发生移动。 (1)一定pH的HA溶液稀释前后pH的变化: 将pH=3的HA溶液稀释100倍后,再测其pH,若pH=5,则为强酸,若pH<5,则为弱酸。 (2)升高温度后pH的变化:若升高温度,溶液的pH明显减小,则是弱酸。因为弱酸存在电离平衡,升高温度时,电离程度增大,c(H+)增大。而强酸不存在电离平衡, 升高温度时,只有水的电离程度增大,pH变化幅度小。 3.酸根离子(或弱碱阳离子)是否能发生水解 强酸根离子不水解,弱酸根离子易发生水解,据此可以判断HA是强酸还是弱酸。可直接测定NaA溶液的pH:若pH=7,则HA是强酸;若pH>7,则HA是弱酸。 题组二 电离平衡及影响因素 3.(2018·山西太原一中检测)稀氨水中存在电离平衡:NH3·H2O??NH+OH-,若要使平衡逆向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( C ) ①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体 A.①②③⑤ B.③⑥ C.③ D.③⑤ [解析] 若在稀氨水中加入NH4Cl固体,c(NH)增大,平衡逆向移动,c(OH-)减小,①不符合题意:硫酸中的H+与OH-反应.使c(OH-)减小。平衡正向移动,②不符合题意;当在稀氨水中加入NaOH固体后,c(OH-)增大,平衡逆向移动,③符合题意;若在稀氨水中加入水,平衡正向移动,但c(OH-)减小,④不符合题意;加热,平衡正向移动,c(OH-)增大。⑤不符合题意:加入少量MgSO4固体发生反应Mg2++2OH-===Mg(OH)2↓,溶液中c(OH-)减小,平衡正向移动,⑥不符合题意。 4.(2018·吉林长春高三检测)下列说法正确的是( B ) A.2 L 0.5 mol·L-1的亚硫酸溶液中含有的H+离子数为2NA B.CH3COOH溶液加水稀释后,溶液中的值减小 C.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 D.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 [解析] H2SO3为弱酸,不完全电离,H+离子数小于2NA,A错误;加水稀释时,电离平衡CH3COOH??CH3COO-+H+向右移动,电离程度增大,但溶液中n(CH3COOH)减小,c(H+)减小,而n(CH3COO-)增大,故的值减小,pH增大,B正确,C错误;D中,因醋酸是弱电解质,稀释过程中醋酸的电离平衡右移,CH3COOH又电离出部分H+,故稀释到原体积的10倍后,溶液的pH小于4,错误。 5.(2018·湖南益阳高三检测)H2S水溶液中存在电离平衡H2S??H++HS-和HS-??H++S2-。若向H2S溶液中( C ) A.加水,平衡向右移动,溶液中氢离子浓度增大 B.通入过量SO2气体,平衡向左移动,溶液pH增大 C.滴加新制氯水,平衡向左移动,溶液pH减小 D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 [解析] 加水稀释促进电离,但氢离子浓度减小,A项错误;通入SO2,发生反应:2H2S+SO2===3S↓+2H2O,平衡左移,当SO2过量时,溶液显酸性,而且酸性比H2S强,pH减小,B项错误;滴加新制氯水,发生反应Cl2+H2S===2HCl+S↓,平衡向左移动,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应S2+Cu2+===CuS↓,平衡右移,氢离子浓度增大,D项错误。 6.(2018·河南八市质检)25 ℃时,用蒸馏水稀释1 mol·L-1醋酸,下列各项始终保持增大趋势的是( A ) A. B. C. D.c(H+)·c(CH3COO-) [解析] 稀释过程中,c(CH3COO-)和c(H+)减小,c(OH-)增大,故A项正确;加水稀释,CH3COOH对水电离的抵制效果减弱,故c(H+)减小幅度小于c(CH3COO-),减小;=,稀释过程中c(H+)减小,故C项错误;稀释过程中,c(CH3COO-)和c(H+)均减小,c(CH3COO-)·c(H+)减小,故D项错误。 [易错警示] 向冰醋酸中加水形成溶液一直到溶液被稀释的过程中,各种变化如下:醋酸的电离程度一直增大,电离产生的H+、CH3COO-数目一直增大,但c(CH3COO-)、c(H+)先增大后减小,c(OH-)先减小后增大,c(CH3COOH)一直减小。 考点二 电离平衡常数 Z 1.表达式 (1)对于一元弱酸HA:HA??H++A-,平衡常数 Ka=____。 (2)对于一元弱碱BOH:BOH??B++OH-,平衡常数 Kb=____。 2.特点 (1)电离平衡常数(也叫电离常数)只与温度有关,升高温度,K值__增大__。 (2)多元弱酸的各级电离平衡常数的大小关系是第一步__≫__第二步__≫__第三步……,故其酸性取决于第__一__步电离。 3.意义:相同条件下,K值越大,表示该弱电解质__越易__电离, 所对应的酸性或碱性相对__越强__。 4.(1)填写下表 弱电解质 电离方程式 电离常数 NH3·H2O __NH3·H2O??NH+OH-__ Kb=1.7×10-5 CH3COOH __CH3COOH??CH3COO-+H+__ Ka=1.7×10-5 HClO __HClO??H++ClO-__ Ka=4.7×10-8 (2)CH3COOH酸性__大于__HClO酸性(填“大于”“小于”或“等于”),判断的依据:__相同条件下,电离常数越大,电离程度越大,c(H+)越大,酸性越强,k(CH3COOH)> k(HClO)__。 (3)磷酸是三元中强酸 ①磷酸的电离方程式是__H3PO4??H++H2PO,H2PO??H++HPO,HPO??H++PO__。 ②电离平衡常数表达式是:Ka1=____,Ka2=____,Ka3=____。 ③比较大小:Ka1__>__Ka2__>__Ka3。 特别提醒: (1)电离平衡常数与化学平衡常数一样,只与温度有关,与其他条件无关。 (2)依据电离平衡常数除了可以比较弱电解质的电离能力外,还能判断电离平衡的移动方向。 (3)在运用电离平衡常数表达式进行计算时,浓度必须是平衡时的浓度。 X 1.判断正误,正确的画“√”,错误的画“×”。 (1)在一定温度下,不同浓度的同一弱电解质,其电离平衡常数一定相同( √ ) (2)电离平衡常数越小,表示弱电解质的电离能力越弱( √ ) (3)电离平衡右移,电离平衡常数一定增大。( × ) (4)温度不变,向NH3·H2O溶液中加入NH4Cl,平衡左移,电离平衡常数减小。( × ) (5)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大。( × ) (6)H2CO3的电离常数表达式:Ka=( × ) (7)要增大某种弱电解质的电离平衡常数,只能采取升高温度的方法( √ ) (8)对于CH3COOH??CH3COO-+H+,在一定温度下,加入盐酸平衡左移,电离平衡常数减小( × ) (9)对于NH3·H2O??NH+OH-,K=,表达式中的NH一定是氨水电离提供的( × ) (10)多元弱酸各步电离平衡常数相互关系为K1查看更多