- 2021-07-06 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高中化学选修6课件-第二单元 物质的获取-课题二 物质的制备
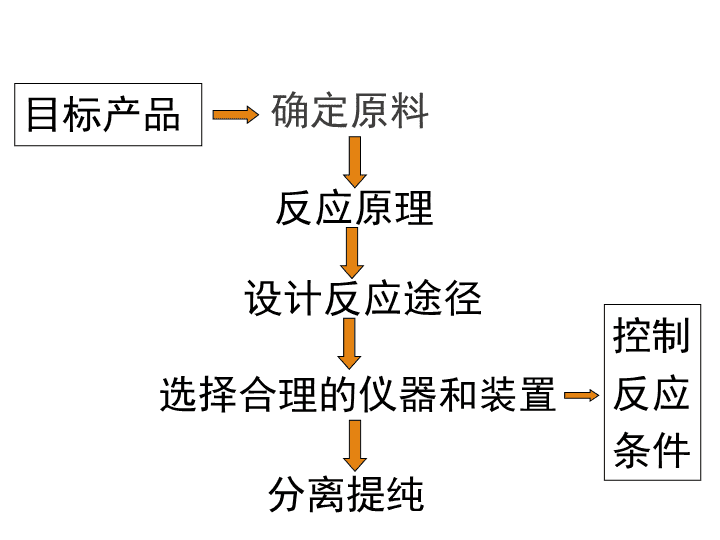
2021年3月25日星期四 课题二 物质的制备 第二单元 物质的获取 1.能够通过化学反应产生二氧化碳气体的物质有哪些? 2.制取CO2气体的实验中,以什么物质为反应物(原料)?为什么? 3.反应的装置是如何选择和安装的? 4.如果要制备干燥的气体产物,应如何设计装置? ①CaCO3+HCl ②CaCO3 ③Na2CO3+H2SO4 ④NaHCO3 ⑤C+O2 ⑥CxHyOz+O2 思考与交流 CaCO3+HCl 酸性:浓硫酸、P2O5、硅胶 一.制备物质的一般的方法 确定原料 反应原理 设计反应途径 选择合理的仪器和装置 分离提纯 控制 反应 条件 目标产品 1.确定原料 Cl2 NaCl:含有“Cl” (1)原料中含有目标产物的组分或新化合物中的 某个“子结构” 。 例如 (2)原料也可以是一些废弃物 2.设计反应路径 例如用铜制取硝酸铜的最佳方案:用铜制取硝酸 铜的最佳方案: ①铜 +浓硝酸 ②铜 +稀硝酸 ③铜 +氧→氧化铜 ; 氧化铜 +硝酸→硝酸铜 根据提高原子利用率、减少环境污染、简化 操作的原则 ,选择最佳反应路线。 3.优化条件 试剂和用量都相同时,操作方法不同,现象和结果 可能不同. 归纳 设计物质制备的实验方案时,应该 遵循的优化原则是: 原料廉价,原理绿色, 条件优化,仪器简单, 分离方便,提纯快捷。 1、实验原理:反应方程式为 浓硫酸的H+可以用作酯化反应的催化剂。由于该 反应是可逆反应,为了提高乙酸乙酯的产量,必须尽 量使化学反应向有利于生成乙酸乙酯的方向进行,所 以浓硫酸除了做酯化反应的催化剂以外还具有吸水性, 可以吸收酯化反应中生成的水,使化学平衡向生成物 方向进行,更有利于乙酸乙酯的生成。 实验2-5 乙酸乙酯的制备及反应条件探究 2、实验记录表: (1)不能,因为乙酸和乙醇的酯化反应是可逆反应,当反应达到 平衡后,各组分的浓度保持不变,不改变影响化学平衡的条件,乙 酸乙酯的含量不会增加。 (2)欲提高乙酸的转化率,可以采取的措施有:增加乙醇的用量, 使化学平衡向正反应方向移动,可以提高乙酸的利用率;增加浓硫 酸的用量,利用浓硫酸吸水使化学平衡向正反应方向移动;加热将 生成的乙酸乙酯及时蒸出,通过减少生成物的浓度使化学平衡向正 反应方向移动。 中起了催化剂、吸水剂的作用,而稀硫酸、稀盐酸等无机酸仅起了催化剂的作用,没 有促进化学平衡向酯化反应方向移动的作用。由于酯化反应为可逆反应,而稀硫酸、稀 盐酸等无机酸催化酯化反应的效果较浓硫酸差,因此探索乙酸乙酯发生水解反应时,不 利于酯化反应的稀无机酸催化剂有利于酯的水解。因此,乙酸乙酯的水解用稀无机酸的 催化效果比用浓硫酸的效果好;同时由于乙酸乙酯水解生成了乙 酸: 如果用无机碱催化乙酸乙酯的水解,会使碱与生成的酸反应,降低生成物乙酸的浓 度,从而使化学平衡更容易向水解的方向移动,所以,乙酸乙酯水解的适宜条件为无机 酸或无机碱催化,最佳条件是用无机碱催化乙酸乙酯水解。 (3)在酯化实验中,三种不同条件下酯化反应进行的快慢不同:没有酸催化时,几乎 没有乙酸乙酯生成;浓硫酸催化时生成的乙酸乙酯的量最多,形成相同厚度的有机层时 间最短;稀硫酸或稀盐酸催化时,生成少量的乙酸乙酯,形成相同厚度的有机层时间较 长,说明浓硫酸在反应查看更多