2017-2018学年河南省中原名校(即豫南九校)高二上学期第二次联考化学试题
相关相对原子质量: H-1 O-16 Na -23 S-32
一、选择题(本题共18小题,每小题3分,共54分)
1、下列关于说法正确的是( )
A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和在点燃条件下的△H不同
B.CO(g)的燃烧热△H =-283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
C.热化学方程式未注明温度和压强时,△H表示标准状况下的数据
D.在加热或点燃条件下才能进行的化学反应一定为吸热反应
2、醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
A.CH3OH的标准燃烧热为△H=192.9kJ·mol-1
B.反应①中的能量变化如图所示CH3OH转变成H2的过程一定要吸收能量
C. 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ/mol
D. CH3OH转变成H2:的过程一定要吸收能量
3、下列说法正确的是( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g)+N2(g)2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq)+FeCl3(aq)Fe(SCN)3(aq)+3KCl(aq),加入KC1
固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B.①④ C.②④ D.无
4、下列变化过程,属于放热反应的是( )
①工业合成氨 ②酸碱中和反应 ③水蒸气变成液态水
④固体NaOH溶于水 ⑤Na在Cl2中燃烧 ⑥食物腐败 ⑦浓H2SO4稀释
A. ①②③④⑤⑥⑦ B. ②③④⑤ C. ①②⑤⑥ D. ①②⑤⑥⑦
5、在一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下的反应并建立平衡: A(g) 2B(g),2B(g)C(g)+2D(g)。测得平衡时各物质的浓度是:c(A)=0.5mol·L-1, c(B)=0.3 mol·L-1,c(C)=0.15 mol·L-1,则最初加入的A物质的量是( )
A.l.8mol B. l.6mol C.l.2mol D. 0.9mol
6、在一定条件下,lmolX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
A.达到平衡时,3v正(Y)=2v逆(Z)
B.反应一段时间后,X与Y的转化率之比为1:3
C. X的体积分数不变,说明反应己达到平衡状态
D.达到平衡后,若从平衡体系中移走部分的Z则v正增大v逆减小
7、下列说法正确的是( )
A.零下10摄氏度液态水结冰属于自发过程,因为这是一个熵增的过程
B.在化学平衡、电离平衡、水解平衡中,平衡常数都随温度的升高而增大
C.升髙温度和使用正催化剂都可降低反应活化能而使化学反应速率加快
D.使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大
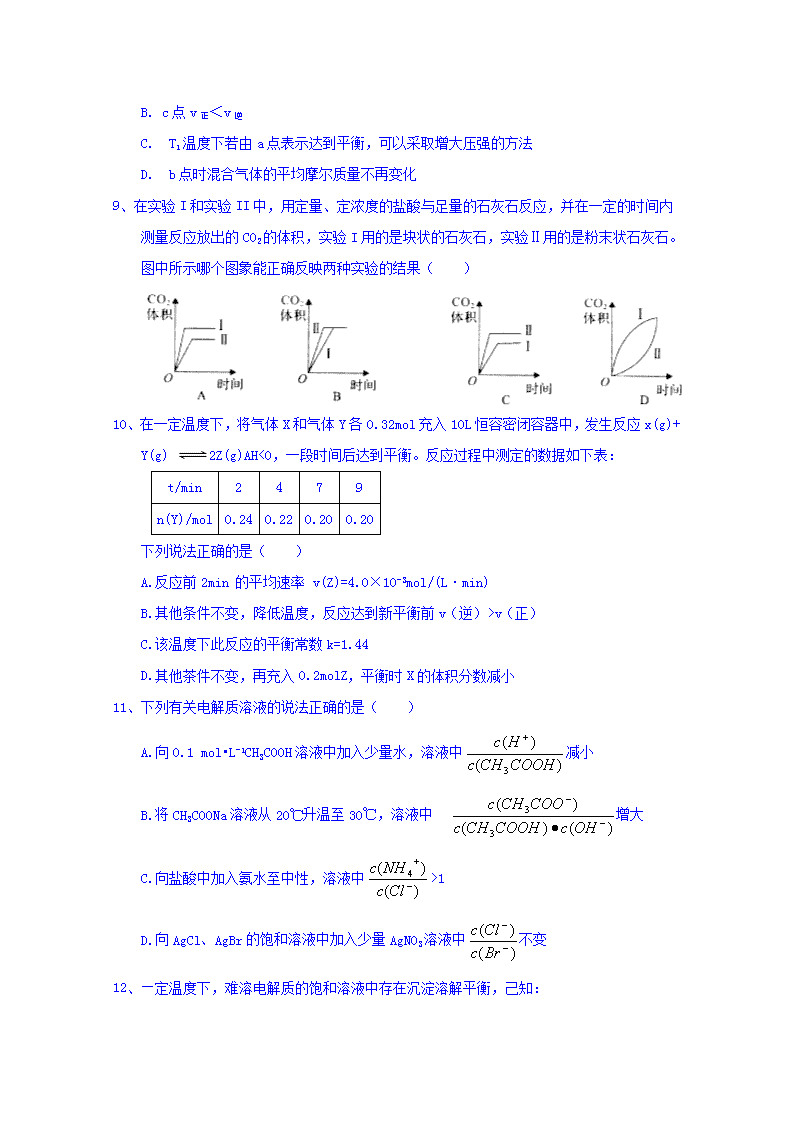
8、有一反应:2A+B2C,其中A、B、C均为气体,如图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,则下列描述正确的是( )
A. 该反应是放热反应
B. c点v正<v逆
C. T1温度下若由a点表示达到平衡,可以采取增大压强的方法
D. b点时混合气体的平均摩尔质量不再变化
9、在实验I和实验II中,用定量、定浓度的盐酸与足量的石灰石反应,并在一定的时间内测量反应放出的CO2的体积,实验I用的是块状的石灰石,实验Ⅱ用的是粉末状石灰石。图中所示哪个图象能正确反映两种实验的结果( )
10、在一定温度下,将气体X和气体Y各0.32mol充入10L恒容密闭容器中,发生反应x(g)+ Y(g) 2Z(g)AH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.24
0.22
0.20
0.20
下列说法正确的是( )
A.反应前2min 的平均速率 v(Z)=4.0×10-3mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数k=1.44
D.其他茶件不变,再充入0.2molZ,平衡时X的体积分数减小
11、下列有关电解质溶液的说法正确的是( )
A.向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大
C.向盐酸中加入氨水至中性,溶液中>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中不变
12、—定温度下,难溶电解质的饱和溶液中存在沉淀溶解平衡,己知:
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
KSP(25℃)
8.0×10-16
2.2×10-20
4.0×10-38
25℃时,对于CuSO4、FeSO4、Fe2(SO4)3、各0.5mol的1L混合溶液,根据上表数据断,下列说法不正确的是( )
A.向混合溶液中加入适量氨水,并调节pH在3~4后过滤,可获得纯净的CuSO4溶液
B.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+c(Fe3+)]>5:4
D.在pH=5的溶液中.Fe3+不能大量存在
13、在常温下,pH=2的氯化铁溶液,PH=2的硫酸溶液,pH=12的氨水溶液,pH=12的碳酸钠溶液,水的电离程度分别为a、b、c、d,则这四种溶液中,水的电离程度大小比较正确的是( )
A. a=d>b=c B. a=d>c>b C. b=c>a=d D. b=c>a>d
14、常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①含有大量Fe3+的溶液:Na+、SCN-、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、NO3-、S2-、K+
③水电离的H+浓度为10-12 mol·L-1,的溶液中:NH4+、Na+、SO42-、HCO3-
④加入Mg能放出H2的溶液中:Mg2+、NO3-、NH4+、K+、SO42-
⑤澄清溶液中:Fe3+、NO3-、Na+、Cl-、SO42-
⑥c(H+)/c(OH-)=l×10-12的溶液中:K+、Na+、CO32-、NO3-
⑦使甲基橙变红的溶液中:Cu2+、SO42-、NH4+、NO3-、Cl-
A.①③⑤⑦ B. ①④⑤⑥ C. ②④⑤⑥ D. ②⑤⑥⑦
15、下列溶液中浓度关系正确的是( )
A.纯碱溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B. 0.2 mol·L-1CH3COOH溶液和0.1mol·L-1NaOH溶液等体积混合:c(CH3COO-) + 2c(OH-)=2c(H+)+c(CH3COOH)
C.等浓度的 CH3COOH、CH3COONa 等体积混合,溶液 pH<7,c(CH3COO-)+c(OH-)
c(NH3 • H2O)>c(Cl-)>c(OH-)>c(H+)
16、在15mL0.l mol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
A.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B.在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C.在D 点:c(HCOO-)+ c(HCOOH)>2c(K+)
D.B→C,水的电离程度先增大后减小
17、工业废气H2S经资源化利用后可回收能量并得到单.质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )
A.电极a为电池的负极
B.电极b上的电极反应式为:O2+4H++4e-=2H2O
C.若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
D.若电路中通过2mol电子,则电池内部释放632kJ热能
18、锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
A.电池工作一段时间后,乙池溶液的总质量增加
B.铜电极上发生氧化反应
C.电池工作一段时间后,甲池的c(SO42-)减小
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
二、填空题(本大题包括4 小题,共46 分)
19、(9 分)请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下0.1 mol•L-1 的NaOH 溶液中,由水电离出的c(OH-)=__________ mol•L-1。
(2)在25℃下;将amol·L-1的NaX溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HX 的电离常数 Ka=________。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-aKJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-bKJ·mol-1 (b>0)
若用标准状况下5. 6LCO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为_____ mol,放出的热量为_________ KJ(用含有a和b的代数式表示)。
(4)已知AgCl、Ag2CrO4 (砖红色) 的Ksp分别为2×10-10和2.0×10-12。分析化学中,测定含氯的中性溶液中Cl- 的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀_________,当溶液中Cl- 恰好完全沉淀(浓度等于1.0×10-5 mol·L-1) 时,此时溶液中c(CrO42-)等于__________ mol•L-1。
20、(12 分)结合下表回答下列问题(均为常温下的数据):
酸
电离常数(Ka)
酸
电离常数(Ka)
酸
电离常数(Ka)
酸
电离常数(Ka)
CH3
1.8×10-5
H2CO
K1=4.4×10-7
H2C2O 4
K1=5.4×10-2
H2S
K1=1.3×10-7
COOH
3
K2=4.7×10-11
K2=5.4×10-5
K2=7.1×10-15
HClO
3×10-8
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 mol•L-1的H2C2O4溶液与0.1 mol•L-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:
CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 mol•L-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
21、(13分)I.在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)=- 2C(g)+ 2D(g),2 分钟末反应达到平衡状态,生成了0.6mol D,回答下列问题:
(1)用D表示2min内的平均反应速率为____________,A的转化率为_____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度_________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各4/3mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入_____________mol B 物质。
(4)若向原平衡体系中再投入1molA和ImolB,B的转化率(填“增大”、“减少”或“不变”)。
II.有人设计出利用CH3OH 和O2的反应,用铂电极在KOH 溶液中构成原电池。电池的总反应类似于CH3OH 在O2中燃烧,则:
(1)每消耗ImolCH3OH 可以向外电路提供___________mole-;
(2)负极电极反应式为________________________。
(3)电池放电后,溶液的PH_________(填“增大”、“减少”或“不变”)。
22、(12 分)利用如图所示装置测定中和热的实验步骤如下:
①用量简量取30mL0.50 mol•L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.50mol•L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)如果用30mL0.50mol/L 硫酸与70mL0.50mol/LNaOH 溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”),简述理由_____________________。
(2)某实验小组配制0.50mol/LNaOH 溶液,若实验中大约要使用245mLNaOH 溶液,至少需要称量NaOH 固体_____________________g。
(3)若用KOH 代替NaOH,对测定结果___________(填“有”或“无”) 影响;若用醋酸代替HCl做实验,对测定结果_____________(填“ 有”或“无”)影响。
(4)① 近似认为0.50 mol•L-1硫酸和0.50 mol•L-1NaOH溶液密度都是1g·cm3,中和后溶液温度上升了4℃,生成溶液的比热容c=4.18J ·(g·℃)-1 ,则中和热△H= ______(小数点后保留一位有效数字)。
②上述实验结果与-57.3kJ·mol-1 有偏差,产生偏差的原因可能是____________(填字母)。
A.实验装置保温隔热效果差
B.量取NaOH 溶液体积时仰视读数
C.分多次把NaOH 溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH 溶液起始温度后直接测定盐酸的温度
一、选择题(本题共18小题,每小题3分,共54分)
1-10 BCDCB CDDBC 11-18 DAADB CDA
二、填空题(本大题包括4小题,共46分)
19、(9分)
(1)10-11 (1分)
(2)> (1分) (a-0.01)×10-5(1分)
(3)0.5 (1分) (1分)
(4)AgCl (2分) 5×10-3 (2分)
20、(12分,每空2分)
(1)HC2O4-
(2)AC
(3)c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
(4)> =
(5)5
21、(13分)
Ⅰ.(1)0.15mol∙L-1∙min-1 (2分) 45% (2分)
(2)增大 (2分)
(3) (2分)
(4)不变(1分)
Ⅱ.(1)6 (1分)
(2)CH3OH-6e-+8OH-=CO32-+6H2O (2分)
(3)减小(1分)
22、(12分)
(1)不相等(1分) 相等 (1分)
中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关(2分)
(2)5.0 (2分)
(3)无 (1分) 有(1分)
(4)① -53.5kJ·mol-1 (2分) ②ACD(2分)