- 2021-07-06 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届湖北省宜昌市夷陵中学高二上学期月考化学试卷(8月份) (解析版)
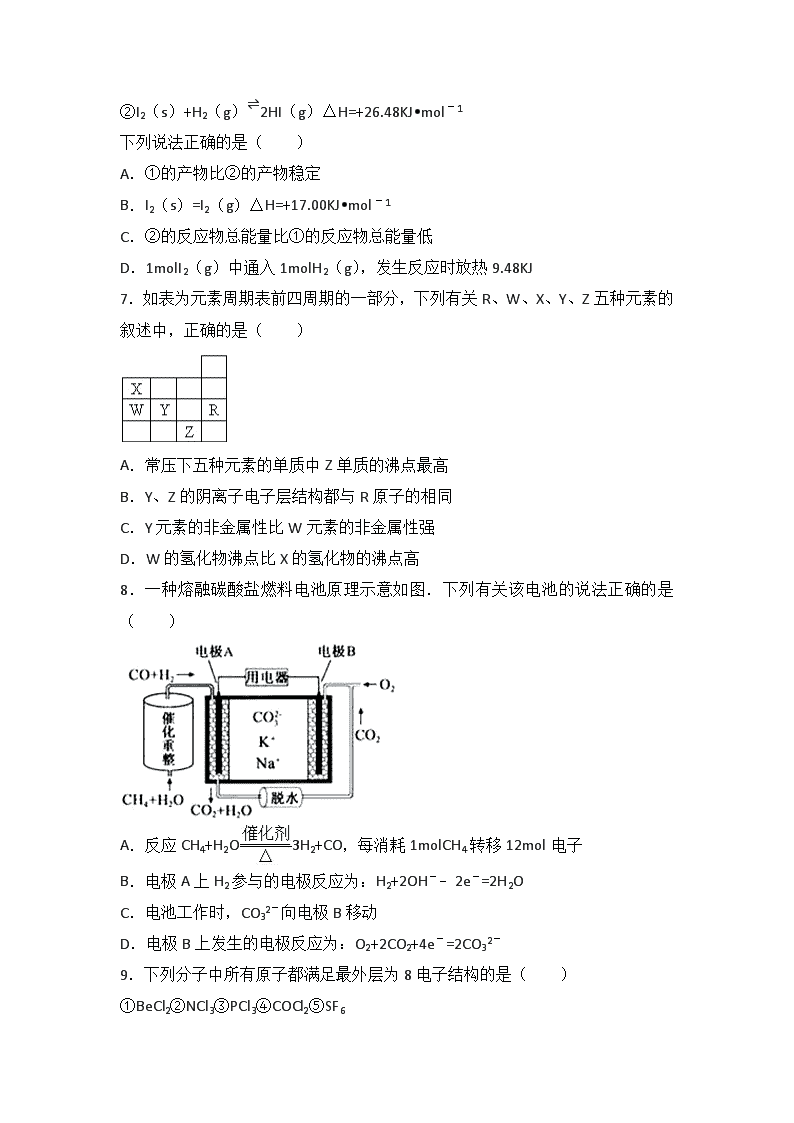
2016-2017学年湖北省宜昌市夷陵中学高二(上)月考化学试卷(8月份) 一、选择题(包括16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1.下列做法能体现理性、低碳、环保生活理念的是( ) A.要求处理垃圾,但是又极力反对建造垃圾焚烧处理厂行为 B.夏天盖着被子吹空调 C.尽量购买本地的、当季的食物,减少食物的加工过程 D.开着5.6L排量的汽车直播声讨北京的雾霾天气 2.下列化学用语正确的是( ) A.NH4Br的电子式: B.S2﹣的结构示意图: C.乙酸的分子式:CH3COOH D.原子核内有18个中子的氯原子:37Cl 3.下列物质中,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( ) A.NH4NO3 B.AlCl3 C.Na2CO3 D.Al2O3 4.下列离子方程式书写正确的是( ) A.铜和稀硝酸反应 Cu+4H++NO3﹣=Cu2++2H2O+NO↑ B.碳酸氢钠和过量的澄清石灰水反应 2HCO3﹣+2OH﹣+Ca2+=CaCO3↓+2H2O+CO32﹣ C.Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ D.氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH﹣=AlO2﹣+2H2O 5.在pH=1的溶液中,可以大量共存的离子组是( ) A.K+、Na+、SO42﹣、HCO3﹣ B.Fe2+、Na+、SO42﹣、NO3﹣ C.Na+、K+、AlO2﹣、Cl﹣ D.NH4+、Mg2+、SO42﹣、Cl﹣ 6.与氢气反应的热化学方程式是 ①I2(g)+H2(g)⇌2HI(g)△H=﹣9.48KJ•mol﹣1 ②I2(s)+H2(g)⇌2HI(g)△H=+26.48KJ•mol﹣1 下列说法正确的是( ) A.①的产物比②的产物稳定 B.I2(s)=I2(g)△H=+17.00KJ•mol﹣1 C.②的反应物总能量比①的反应物总能量低 D.1molI2(g)中通入1molH2(g),发生反应时放热9.48KJ 7.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) A.常压下五种元素的单质中Z单质的沸点最高 B.Y、Z的阴离子电子层结构都与R原子的相同 C.Y元素的非金属性比W元素的非金属性强 D.W的氢化物沸点比X的氢化物的沸点高 8.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( ) A.反应CH4+H2O3H2+CO,每消耗1molCH4转移12mol电子 B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O C.电池工作时,CO32﹣向电极B移动 D.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣ 9.下列分子中所有原子都满足最外层为8电子结构的是( ) ①BeCl2②NCl3③PCl3④COCl2⑤SF6 ⑥XeF2⑦CS2⑧CH4⑨CF2Cl2⑩S2Cl2. A.②④⑦⑧⑨⑩ B.②③④⑦⑨⑩ C.①③④⑦⑩ D.③④⑤⑦⑨⑩ 10.对于反应A(g)+3B(g)⇌2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( ) A.v(D)=0.4mol/(L•s) B.v(C)=30mol/(L•min) C.v(B)=0.4mol/(L•min) D.v(A)=0.15mol/(L•s) 11.下列实验方法能够实现的是( ) A.用10ml量筒量取7.5ml稀盐酸 B.用托盘天平称取25.20gNaCl晶体 C.用蒸发结晶的方法由硫酸铜溶液制取蓝帆 D.用100ml容量瓶配置0.5mol/l的Na2CO3溶液 12.一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s)+CO2⇌2CO(g),不能判断反应已经达到化学平衡状态的是( ) A.v(CO2)=v(CO) B.容器中总压强不变 C.容器中混合气体的密度不变 D.各组分浓度不再随时间而变化 13.某有机物X的结构简式为,下列说法错误的是( ) A.X难溶于水 B.X的分子式为C11H14O2 C.组成为﹣C4H9的烃基有3种 D.X能发生加成反应、取代反应 14.下列有关有机物的叙述不正确的是( ) A.C4H8O2的酯有4种结构 B.淀粉和纤维素互为同分异构体 C.乙醇和葡萄糖均能发生酯化反应 D.用氢氧化钠溶液可以鉴别地沟油和矿物油 15.下列关于海水资源综合利用的说法中,不正确的是( ) A.从海水中富集镁元素可用Ca(OH)2沉淀法 B.海水淡化的方法主要有蒸馏法、离子交换法、电渗析法 C.从海水中提取溴单质的过程中用氯气做还原剂 D.从海水中获得粗盐可用蒸发结晶法 16.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S.T.P)的气体.所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为( ) A.68.6% B.77.8% C.81.4% D.无法计算 二、非选择题(本题包括4小题,共52分) 17.A、B、C、D、E都是短周期主族元素,原子半径D>A>E>B,其中D、B处在同一主族,A、C、E处在同一周期,E原子核内质子数等于A、B原子核内质子之和,C原子最外层上的电子数是B原子最外层电子数的4倍,且D为金属,D和E的一种化合物为淡黄色,试回答 (1)C的元素在元素周期表中的位置 .D、E、A简单离子半径由大到小的顺序是 (用具体的离子符号表示) (2)A、C、E能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是 (用具体的分子式表示) (3)E与B形成的四原子分子的结构式是 ,已知B与A可形成AB5的物质,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,它的电子式为 . (4)请写出两个由以上5种元素中部分元素形成的物质,发生置换反应方程式 、 . 18.向2L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)⇌pC(g)+qD(g) 已知:平均反应速率VC=;反应2min 时,A的浓度减少了,B的物质的量减少了mol,有a mol D生成. 回答下列问题: (1)反应2min内,VA= ,VB ; (2)化学方程式中,x= 、y= 、p= 、q= ; (3)反应平衡时,D为 2amol,则B的转化率(转化率=)为 ; (4)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较: 反应速率 (填“增大”、“减小”或“不变”),理由是 . 19.氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题 (1)若用水制取氢气,以下研究方向不正确的是 A.构成水的氢和氧都是可以燃烧的物质,因此可以研究在水不分解的情况下,使氢元素成为一种能源 B.设法使太阳光聚焦,产生高温,使水分解产生氢气 C.寻找高效催化剂,使水分解产生氢气,同时释放能量 D.寻找特殊化学物质用于开发廉价能源,以分解水制取氢气 (2)氢氧燃料电池是符合绿色化学概念的新型发电装置.其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.在导线中电子流动方向为 (用a、b表示).B电极发生的电极反应式为 .若消耗标准状况下5.6LH2,则通过导向中的电子数为 (3)若氢气的燃烧过程中,破坏1molH2中的化学键消耗的能量为Q1KJ,破坏1molO2中的化学键为Q2KJ,形成1molH2O中的化学键释放的能量为Q3kJ,下列关系式正确的是 A.Q1+Q2>Q 3 B.Q1+Q2<Q 3 C.2Q1+Q2>2Q 3 D.2Q1+Q2<2Q 3. 20.有机物在生产、生活中扮演着重要的角色,研究有机物具有重要的意义. 结合已学知识,回答下列问题. (1)乙烯的结构式是 (2)下列说法中不正确的是 (填序号) a.氯乙烯(CH2=CHCl)中六个原子在同一平面上 b.乙烯分子中的碳碳双键是两条相同的碳碳单键 c.长途运输水果时,可用酸性高锰酸钾溶液吸收水果释放的乙烯,以保持水果新鲜 d.除去乙烷中的乙烯,可以选用酸性高锰酸钾溶液 (3)实验室制取的乙烯中混有SO2等气体杂质.下列试剂中,可用于检验乙烯中混有的SO2的是 (填序号) a.溴水 b.酸性高锰酸钾溶液 c.品红溶液. 21.已知乙烯能发生以下转化 (1)D物质所含官能团的名称是 ; (2)反应②(B﹣C)的反应类型是 ,其化学方程式是 ; (3)B和D生成乙酸乙酯的反应类型是 ,其化学方程式是 . 2016-2017学年湖北省宜昌市夷陵中学高二(上)月考化学试卷(8月份) 参考答案与试题解析 一、选择题(包括16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1.下列做法能体现理性、低碳、环保生活理念的是( ) A.要求处理垃圾,但是又极力反对建造垃圾焚烧处理厂行为 B.夏天盖着被子吹空调 C.尽量购买本地的、当季的食物,减少食物的加工过程 D.开着5.6L排量的汽车直播声讨北京的雾霾天气 【考点】"三废"处理与环境保护. 【分析】体现理性、低碳、环保生活理念,应减少污染物的排放,合理使用资源,节约能源等,以此解答该题. 【解答】解:A.焚烧易燃垃圾,可用于发电,一味反对不理性,故A错误; B.夏天盖着被子吹空调,浪费能源,不理性,不低碳,故B错误; C.尽量购买本地的、当季的食物,减少食物的加工过程,可节约能源,低碳环保,故C正确; D.开着5.6L排量的汽车排放汽车尾气,导致雾霾,故D错误. 故选C. 2.下列化学用语正确的是( ) A.NH4Br的电子式: B.S2﹣的结构示意图: C.乙酸的分子式:CH3COOH D.原子核内有18个中子的氯原子:37Cl 【考点】电子式. 【分析】A.铵根离子和溴离子都需要标出所带电荷和原子的最外层电子,溴离子为阴离子,电子式中需要标出最外层的8个电子; B.硫离子的核外电子总数18,最外层为8个电子; C.分子式中不需要标出官能团结构,图为该物质的结构简式; D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数. 【解答】解:A.溴化铵是离子化合物,由铵根离子与溴离子构成,电子式为:,故A错误; B.硫离子的核电荷数为16,核外电子总数为18,最外层为8个电子,硫离子的结构示意图为:,故B正确; C.乙酸分子中含2个C、4个H,2个O,且含羧基,结构简式为CH3COOH,分子式为C2H4O2,故C错误; D.原子核内有l8个中子的氯原子的质量数=质子数+中子数=17+18=35,该原子可以表示为:,故D错误; 故选B. 3.下列物质中,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( ) A.NH4NO3 B.AlCl3 C.Na2CO3 D.Al2O3 【考点】两性氧化物和两性氢氧化物. 【分析】既能跟盐酸反应、又能跟氢氧化钠溶液反应的物质有Al、两性氢氧化物、两性氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质,据此分析解答. 【解答】解:A.硝酸铵为强酸的铵盐,能和NaOH溶液反应但和稀盐酸不反应,故A错误; B.氯化铝是强酸弱碱盐,能和NaOH溶液反应但和稀盐酸不反应,故B错误; C.碳酸钠是强碱弱酸盐,能和稀盐酸反应但和NaOH溶液不反应,故C错误; D.氧化铝属于两性氧化物,能和稀盐酸、NaOH溶液反应生成盐和水,故D正确; 故选D. 4.下列离子方程式书写正确的是( ) A.铜和稀硝酸反应 Cu+4H++NO3﹣=Cu2++2H2O+NO↑ B.碳酸氢钠和过量的澄清石灰水反应 2HCO3﹣+2OH﹣+Ca2+=CaCO3↓+2H2O+CO32﹣ C.Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ D.氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH﹣=AlO2﹣+2H2O 【考点】离子方程式的书写. 【分析】A.离子方程式两边总电荷不相等,违反了电荷守恒; B.氢氧化钙过量,反应后不会剩余碳酸根离子; C.铁与盐酸反应生成的是亚铁离子,不是铁离子; D.氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水. 【解答】解:A.铜和稀硝酸反应生成硝酸铜、NO气体和水,正确的离子方程式为:3 Cu+4H++2NO3﹣=3Cu2++2H2O+2NO↑,故A错误; B.碳酸氢钠和过量的澄清石灰水反应,反应生成碳酸钙沉淀、氢氧化钠和水,正确的离子方程式为:HCO3﹣+OH﹣+Ca2+=CaCO3↓+H2O,故B错误; C.Fe投入盐酸中生成氯化亚铁和氢气,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误; D.氢氧化铝溶于氢氧化钠溶液生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,故D正确; 故选D. 5.在pH=1的溶液中,可以大量共存的离子组是( ) A.K+、Na+、SO42﹣、HCO3﹣ B.Fe2+、Na+、SO42﹣、NO3﹣ C.Na+、K+、AlO2﹣、Cl﹣ D.NH4+、Mg2+、SO42﹣、Cl﹣ 【考点】离子共存问题. 【分析】 pH=1的溶液显酸性,含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应的等,则离子大量共存,以此来解答. 【解答】解:A.酸溶液中不能大量存在HCO3﹣,故A不选; B.Fe2+、H+、NO3﹣发生氧化还原反应,不能大量共存,故B不选; C.酸溶液中不能大量存在AlO2﹣,故C不选; D.酸溶液中该组离子之间不反应,可大量共存,故D选; 故选D. 6.与氢气反应的热化学方程式是 ①I2(g)+H2(g)⇌2HI(g)△H=﹣9.48KJ•mol﹣1 ②I2(s)+H2(g)⇌2HI(g)△H=+26.48KJ•mol﹣1 下列说法正确的是( ) A.①的产物比②的产物稳定 B.I2(s)=I2(g)△H=+17.00KJ•mol﹣1 C.②的反应物总能量比①的反应物总能量低 D.1molI2(g)中通入1molH2(g),发生反应时放热9.48KJ 【考点】用盖斯定律进行有关反应热的计算. 【分析】热化学方程式的理解问题,并且注意热化学方程式的意义,①是放热反应;②是吸热反应,然后结合盖斯定律进行比较. 【解答】解:A.一样稳定,都是HI的气态因为是可逆反应,所以不能进行完全,放热小于9.48kJ,故A错误; B.由盖斯定律知②﹣①得,△H=+26.48kJ/mol﹣(﹣9.48)kJ/mol=+35.96kJ/mol,故B错误; C.对于同一物质,固态物质的能量比气态物质能量低;因此反应②的反应物总能量比反应①的反应物总能量低,故C正确; D.因为是可逆反应,1mol I2(g)中通入1 mol H2(g),发生反应放热小于9.48 kJ,故D错误; 故选C. 7.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) A.常压下五种元素的单质中Z单质的沸点最高 B.Y、Z的阴离子电子层结构都与R原子的相同 C.Y元素的非金属性比W元素的非金属性强 D.W的氢化物沸点比X的氢化物的沸点高 【考点】位置结构性质的相互关系应用. 【分析】根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,以此进行分析, A、根据物质的在常压下的存在形式分析,常压下S、P为固体,而Br为液体; B、Y的阴离子核外有18个电子,Z的阴离子核外有36个电子,以此进行分析; C、同周期中,从左到右,元素的非金属性逐渐增强; D、根据NH3含有氢键进行比较. 【解答】解:根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素, A、常压下S、P为固体,而Br为液体,所以五种元素的单质中Z单质的沸点不是最高的,故A错误; B、Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误; C、同周期中,从左到右,元素的非金属性逐渐增强,故C正确; D、X为N元素,其氢化物为NH3,含有氢键,沸点较高,故D错误. 故选C. 8.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( ) A.反应CH4+H2O3H2+CO,每消耗1molCH4转移12mol电子 B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O C.电池工作时,CO32﹣向电极B移动 D.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣ 【考点】真题集萃;原电池和电解池的工作原理. 【分析】甲烷和水经催化重整生成CO和H2,反应中C元素化合价由﹣4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32﹣,以此解答该题. 【解答】解:A.反应CH4+H2O3H2+CO,C元素化合价由﹣4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误; B.电解质没有OH﹣,负极反应为H2+CO+2CO32﹣﹣4e﹣=H2O+3CO2,故B错误; C.电池工作时,CO32﹣向负极移动,即向电极A移动,故C错误; D.B为正极,正极为氧气得电子生成CO32﹣,电极反应为:O2+2CO2+4e﹣=2CO32﹣,故D正确. 故选D. 9.下列分子中所有原子都满足最外层为8电子结构的是( ) ①BeCl2②NCl3③PCl3④COCl2⑤SF6 ⑥XeF2⑦CS2⑧CH4⑨CF2Cl2⑩S2Cl2. A.②④⑦⑧⑨⑩ B.②③④⑦⑨⑩ C.①③④⑦⑩ D.③④⑤⑦⑨⑩ 【考点】原子核外电子排布. 【分析】在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足,以此来解答. 【解答】解:①二氯化铍分子中铍元素的族序数+成键数=2+2=4,所以分子中不能满足所有原子最外层8电子结构,故错误; ②NCl3中,N原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|﹣1|=8,都满足8电子稳定结构,故正确; ③PCl3中,P原子的最外层电子为:5+3=8,Cl原子的最外层电子为:7+|﹣1|=8,都满足8电子稳定结构,故正确; ④COCl2中,C原子的最外层电子为4+4=8,O原子的最外层电子为6+2=8,Cl原子的最外层电子为7+1=8,故错误; ⑤SF6中,只有F原子满足了8电子稳定结构,故错误; ⑥XeF2中,Xe原子的原子核外最外层电子数为8,其在分子中的化合价为+2价,在分子中的原子最外层电子数为10,故错误; ⑦CS2 分子中C元素的族序数+成键数=4+4=8,则二硫含碳满足分子中所有原子都满足最外层8电子结构,故正确; ⑧CH4 中,C原子的最外层电子为:4+|﹣4|=8,H原子的最外层电子为:1+1=2,不都满足8电子稳定结构,故错误; ⑨CF2Cl2分子中C原子与F、Cl原子之间形成C﹣F、C﹣Cl,C原子最外层电子数为4+4=8,Cl原子最外层电子数=7+1=8,F原子最外层电子数7+1=8,均满足8电子结构,故选; ⑩S2Cl2结构式为Cl﹣S﹣S﹣Cl,S原子最外层电子数为6+2=8,Cl原子最外层电子数=7+1=8,均满足8电子结构,故选, 故选:B. 10.对于反应A(g)+3B(g)⇌2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( ) A.v(D)=0.4mol/(L•s) B.v(C)=30mol/(L•min) C.v(B)=0.4mol/(L•min) D.v(A)=0.15mol/(L•s) 【考点】化学反应速率和化学计量数的关系. 【分析】反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答. 【解答】解:反应速率与化学计量数的比值越大,反应速率越快,则 A. =0.2; B. =0.25; C. =0.0033; D. =0.15, 显然B中比值最大,反应速率最快, 故选B. 11.下列实验方法能够实现的是( ) A.用10ml量筒量取7.5ml稀盐酸 B.用托盘天平称取25.20gNaCl晶体 C.用蒸发结晶的方法由硫酸铜溶液制取蓝帆 D.用100ml容量瓶配置0.5mol/l的Na2CO3溶液 【考点】化学实验方案的评价. 【分析】A.10mL量筒的最小读数为0.1mL; B.托盘天平只能读到0.1,无法称量出0.01g氯化钠; C.蒸发结晶无法得到含有结晶水的蓝帆; D.可以用100mL的容量瓶配制0.5mol/L的碳酸钠溶液. 【解答】解:A.规格为10mL的量筒的最小读数为0.1mL,可用10mL量筒量取7.5mL稀盐酸,故A正确; B.托盘天平的最小读数为0.1g.无法用托盘天平称取25.20gNaCl晶体,故B错误; C.需要通过蒸发浓缩、冷却结晶、过滤得到硫酸铜晶体,不能直接蒸发结晶,故C错误; D.可以用规格为100mL的容量瓶配制0.5mol/L的碳酸钠溶液,故D正确; 故选AD. 12.一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s)+CO2⇌2CO(g),不能判断反应已经达到化学平衡状态的是( ) A.v(CO2)=v(CO) B.容器中总压强不变 C.容器中混合气体的密度不变 D.各组分浓度不再随时间而变化 【考点】化学平衡状态的判断. 【分析】化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,结合反应的特点进行分析. 【解答】解:A.当v(CO2)=v(CO),正逆反应速率不等,没有达到平衡状态,故A选; B.反应前后气体的体积不等,容器中总压强不变,可说明达到平衡状态,故B不选; C.反应前后气体的质量不等,当达到平衡状态时,容器中混合气体的密度不变,故C不选; D.达到平衡状态时,各物质的浓度不变,故D不选. 故选A. 13.某有机物X的结构简式为,下列说法错误的是( ) A.X难溶于水 B.X的分子式为C11H14O2 C.组成为﹣C4H9的烃基有3种 D.X能发生加成反应、取代反应 【考点】有机物的结构和性质;有机物分子中的官能团及其结构. 【分析】由结构简式可知,分子中含﹣COOC﹣,为酯类物质,结合酯的性质来解答. 【解答】解:A.含﹣COOC﹣,不溶于水,故A正确; B.由结构可知分子式为C11H14O2,故B正确; C.C4H9﹣有4种同分异构体,故C错误; D.含苯环可发生加成反应,含﹣COOC﹣可发生取代反应,故D正确; 故选C. 14.下列有关有机物的叙述不正确的是( ) A.C4H8O2的酯有4种结构 B.淀粉和纤维素互为同分异构体 C.乙醇和葡萄糖均能发生酯化反应 D.用氢氧化钠溶液可以鉴别地沟油和矿物油 【考点】有机化合物的异构现象;有机化学反应的综合应用. 【分析】A、C4H8O2属于酯类的同分异构体,为饱和一元酯,根据酸和醇的种类来确定; B、同分异构体是指分子式相同,但结构不同的化合物; C、含有羧基或羟基的物质能发生酯化反应; D、地沟油与NaOH发生反应后不分层,矿物油与NaOH混合不反应且分层; 【解答】解:A、C4H8O2属于酯类的同分异构体,为饱和一元酯,若为甲酸与丙醇形成的酯,甲酸只有1种结构,丙醇有2种,形成的酯有2种,若为乙酸与乙醇形成的酯,乙酸只有1种结构,乙醇只有1种结构,形成的乙酸乙酯有1种,若为丙酸与甲醇形成的酯,丙酸只有1种结构,甲醇只有1种结构,形成的丙酸甲酯只有1种,所以C4H8O2属于酯类的同分异构体共有4种,故A正确; B、淀粉和纤维素的分子式为(C6H10O5)n,聚合度n不同,分子式不同,所以不是同分异构体,故B错误; C、含有羧基或羟基的物质能发生酯化反应,乙醇和葡萄糖含有羟基,均能发生酯化反应,故C正确; D、地沟油与NaOH发生反应后不分层,矿物油与NaOH混合不反应且分层,现象不同,可鉴别,故D正确; 故选B. 15.下列关于海水资源综合利用的说法中,不正确的是( ) A.从海水中富集镁元素可用Ca(OH)2沉淀法 B.海水淡化的方法主要有蒸馏法、离子交换法、电渗析法 C.从海水中提取溴单质的过程中用氯气做还原剂 D.从海水中获得粗盐可用蒸发结晶法 【考点】海水资源及其综合利用. 【分析】A、海水中镁离子的浓度较低,需要富集; B、根据海水淡化的主要方法分析; C、溴元素由化合态转化为游离态发生氧化还原反应; D、从海水中提取氯化钠是将海水暴晒得到,利用氯化钠溶解度随温度变化不大. 【解答】解:A、海水中镁离子的浓度较低,在海水中加入石灰乳可得氢氧化镁沉淀,实现了镁的富集,故A正确; B、海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故B正确; C、溴元素由化合态转化为游离态发生氧化还原反应,反应方程式为:Cl2+2Br﹣=2Cl﹣+Br2,所以氯气做氧化剂,故C错误; D、从海水中提取氯化钠是将海水暴晒得到,利用氯化钠溶解度随温度变化不大,从海水中获得粗盐可用蒸发结晶法,故D正确; 故选C. 16.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S.T.P)的气体.所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为( ) A.68.6% B.77.8% C.81.4% D.无法计算 【考点】有关混合物反应的计算. 【分析】Fe.FeO.Fe2O3 的混合物中加入盐酸恰好使混合物完全溶解,生成了铁的氯化物,因加入KSCN 溶液,无血红色出现,说明只生成氯化亚铁,根据氯元素守恒可知道氯化亚铁的量,进而求得铁元素的质量,根据HCl的物质的量可结合氢气的物质的量可计算O的质量,进而可计算 混合物中铁元素的质量分数. 【解答】解:用盐酸溶解后,得到的产物加 KSCN 溶液,无血红色出现,说明得到的产物是氯化亚铁,即混合物中的铁元素全在氯化亚铁中, 盐酸的物质的量为:1mol.L﹣1×0.1L=0.1mol, 根据氯元素守恒,则n(Fe)=n(FeCl2)=×n(HCl)=0.05mol, m(Fe)=0.05mol×56g/mol=2.8g, 根据H元素守恒,有2HClH2O,2HClH2, n(H2)==0.01mol,消耗HCl0.02mol, 则与氧化物反应的HCl的物质的量为0.1mol﹣0.02mol=0.08mol, 所以氧化物中含有n(O)==0.04mol, m(O)=0.04mol×16g/mol=0.64g, 则混合物中铁元素的质量分数为: =81.4%, 故选C. 二、非选择题(本题包括4小题,共52分) 17.A、B、C、D、E都是短周期主族元素,原子半径D>A>E>B,其中D、B处在同一主族,A、C、E处在同一周期,E原子核内质子数等于A、B原子核内质子之和,C原子最外层上的电子数是B原子最外层电子数的4倍,且D为金属,D和E的一种化合物为淡黄色,试回答 (1)C的元素在元素周期表中的位置 第二周期第ⅣA族 .D、E、A简单离子半径由大到小的顺序是 N3﹣>O2﹣>Na+ (用具体的离子符号表示) (2)A、C、E能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是 H2O>NH3>CH4 (用具体的分子式表示) (3)E与B形成的四原子分子的结构式是 H﹣O﹣O﹣H ,已知B与A可形成AB5的物质,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,它的电子式为 . (4)请写出两个由以上5种元素中部分元素形成的物质,发生置换反应方程式 2Na+2H2O=2NaOH+H2↑ 、 C+H2O(g)CO+H2 . 【考点】位置结构性质的相互关系应用. 【分析】A、B、C、D、E都是短周期主族元素,原子半径D>A>E>B,D和E的一种化合物为淡黄色,且D为金属,则D为Na,E为O,其中D、B处在同一主族,B为H;A、C、E处在同一周期,均为第二周期元素,E原子核内质子数等于A、B原子核内质子之和,A为N,C原子最外层上的电子数是B原子最外层电子数的4倍,C为C,然后结合元素周期律及元素化合物知识来解答. 【解答】解:A、B、C、D、E都是短周期主族元素,原子半径D>A>E>B,D和E的一种化合物为淡黄色,且D为金属,则D为Na,E为O,其中D、B处在同一主族,B为H;A、C、E处在同一周期,均为第二周期元素,E原子核内质子数等于A、B原子核内质子之和,A为N,C原子最外层上的电子数是B原子最外层电子数的4倍,C为C, (1)C的元素在元素周期表中的位置为第二周期第ⅣA族;具有相同电子排布的离子中原子序数大的离子半径小,则D、E、A简单离子半径由大到小的顺序是N3﹣>O2﹣>Na+, 故答案为:第二周期第ⅣA族;N3﹣>O2﹣>Na+; (2)非金属性越强,对应氢化物越稳定,则A、C、E能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是H2O>NH3>CH4, 故答案为:H2O>NH3>CH4; (3)E与B形成的四原子分子为H2O2,其结构式是H﹣O﹣O﹣H,已知B与A可形成AB5的物质,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,为离子化合物NH4H,电子式为,故答案为:H﹣O﹣O﹣H;; (4)由以上5种元素中部分元素形成的物质,发生置换反应方程式如2Na+2H2O=2NaOH+H2↑、C+H2O(g)CO+H2, 故答案为:2Na+2H2O=2NaOH+H2↑;C+H2O(g)CO+H2. 18.向2L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)⇌pC(g)+qD(g) 已知:平均反应速率VC=;反应2min 时,A的浓度减少了,B的物质的量减少了mol,有a mol D生成. 回答下列问题: (1)反应2min内,VA= mol/(L•mim) ,VB mol/(L•mim) ; (2)化学方程式中,x= 2 、y= 3 、p= 1 、q= 6 ; (3)反应平衡时,D为 2amol,则B的转化率(转化率=)为 % ; (4)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较: 反应速率 增大 (填“增大”、“减小”或“不变”),理由是 浓度增大,反应速率变快 . 【考点】化学平衡的计算. 【分析】平均反应速率vC=vA;反应2min时,A的浓度减少了, 则vA==mol/(L•mim),vC=mol/(L•mim), B的物质的量减少了mol,vB==mol/(L•mim), 有a mol D生成,vD==mol/(L•mim), 由反应速率之比等于化学计量数之比可知,反应为2A(g)+3B(g)⇌C(g)+6D(g), 结合转化率公式可以求得转化率,根据压强对反应速率的影响可以判断并解释. 【解答】解:平均反应速率vC=vA;反应2min时,A的浓度减少了, 则vA==mol/(L•mim),vC=mol/(L•mim), B的物质的量减少了mol,vB==mol/(L•mim), 有a mol D生成,vD==mol/(L•mim), (1)依据上述计算可知反应2min内,VA=mol/(L•mim);vB=mol/(L•mim),故答案为: mol/(L•mim); mol/(L•mim); (2)由反应速率之比等于化学计量数之比可知,反应为2A(g)+3B(g)⇌C(g)+6D(g), 故答案为:2;3;1;6; (3 反应平衡时,D为 2amol,则有amolB参加反应,所以B的转化率为×100%=%,故答案为: %; (4)将容器的容积变为1L,所有物质浓度增大,反应速率增大,故答案为:增大;浓度增大,反应速率变快. 19.氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题 (1)若用水制取氢气,以下研究方向不正确的是 AC A.构成水的氢和氧都是可以燃烧的物质,因此可以研究在水不分解的情况下,使氢元素成为一种能源 B.设法使太阳光聚焦,产生高温,使水分解产生氢气 C.寻找高效催化剂,使水分解产生氢气,同时释放能量 D.寻找特殊化学物质用于开发廉价能源,以分解水制取氢气 (2)氢氧燃料电池是符合绿色化学概念的新型发电装置.其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.在导线中电子流动方向为 a流向b (用a、b表示).B电极发生的电极反应式为 O2+4e﹣+2H2O=4OH﹣ .若消耗标准状况下5.6LH2,则通过导向中的电子数为 0.5NA (3)若氢气的燃烧过程中,破坏1molH2中的化学键消耗的能量为Q1KJ,破坏1molO2中的化学键为Q2KJ,形成1molH2O中的化学键释放的能量为Q3kJ,下列关系式正确的是 D A.Q1+Q2>Q 3 B.Q1+Q2<Q 3 C.2Q1+Q2>2Q 3 D.2Q1+Q2<2Q 3. 【考点】常见的能量转化形式;反应热和焓变;化学电源新型电池. 【分析】(1)A、水不分解也就是物质不变化,物质不变化也就不会产生新物质,不产生新物质就没有氢气. B.通过水分解产生氢气,这是可行的. C.水分解产生氢气,但需要吸收能量. D.开发廉价能源,以分解水制氢气,这是可行的确. (2)氢氧燃料电池中,通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为H2﹣2e﹣+2OH﹣=2H2O,通入氧气的一极b为原电池的正极,电极反应式为O2+4e﹣+2H2O=4OH﹣,原电池工作时,电子由负极经外电路流向正极,氢氧燃料电池的总反应为:2H2+O2=2H2O; (3)化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能﹣生成物总键能,H﹣H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,注意氢气在氧气中燃烧,反应热△H<0,每摩尔H2O中含有2molH﹣O键,据此计算. 【解答】解:(1)A、水不分解也就是物质不变化,物质不变化也就不会产生新物质,不产生新物质就没有氢气,故A错误; B.通过水分解产生氢气,这是可行的.故B正确; C.水分解产生氢气,但需要吸收能量,故C错误; D.开发廉价能源,以分解水制氢气,这是可行的,故D正确; 故选AC. (2)氢氧燃料电池中,通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为H2﹣2e﹣+2OH﹣=2H2O,通入氧气的一极b为原电池的正极,电极反应式为O2+4e﹣+2H2O=4OH﹣,原电池工作时,电子由负极a经外电路流向正极b;消耗标准状况下5.6L即0.25molH2,则通过导向中的电子为0.5mol,数目为:0.5NA. 故答案为:a流向b;O2+4e﹣+2H2O=4OH﹣;0.5NA; (3)破坏1molH﹣H消耗的能量为Q1kJ,则H﹣H键能为Q1kJ/mol,破坏1molO═O键消耗的能量为Q2kJ,则O═O键键能为Q2kJ/mol, 形成1mol水中的化学键释放的能量为Q3kJ,每摩尔H2O中含有2molH﹣O键,1molH﹣O键释放的能量为Q3kJ,则H﹣O键能为Q3kJ/mol, 对于反应2H2(g)+O2(g)═2H2O(l)反应热△H=反应物的总键能﹣生成物的总键能, 故:反应热△H=2Q1kJ/mol+Q2kJ/mol﹣4×Q3kJ/mol=(2Q1+Q2﹣2Q3)KJ/mol, 由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2﹣2Q3)<0,所以2Q1+Q2<2Q3,故选D. 20.有机物在生产、生活中扮演着重要的角色,研究有机物具有重要的意义. 结合已学知识,回答下列问题. (1)乙烯的结构式是 (2)下列说法中不正确的是 bd (填序号) a.氯乙烯(CH2=CHCl)中六个原子在同一平面上 b.乙烯分子中的碳碳双键是两条相同的碳碳单键 c.长途运输水果时,可用酸性高锰酸钾溶液吸收水果释放的乙烯,以保持水果新鲜 d.除去乙烷中的乙烯,可以选用酸性高锰酸钾溶液 (3)实验室制取的乙烯中混有SO2等气体杂质.下列试剂中,可用于检验乙烯中混有的SO2的是 c (填序号) a.溴水 b.酸性高锰酸钾溶液 c.品红溶液. 【考点】乙烯的化学性质;有机物分子中的官能团及其结构. 【分析】(1)乙烯的分子式为C2H4,碳原子之间形成C=C双键; (2)a.一氯乙烯(CH2=CHCl)为平面结构,所有原子都在同一平面内; b.根据碳碳双键与碳碳单键的键能分析解答; c.高锰酸钾溶液可以氧化乙烯; d.乙烯被酸性高锰酸钾溶液氧化得到二氧化碳,会引入新杂质; (3)溴水、酸性高锰酸钾溶液均能与乙烯、二氧化硫反应,用品红溶液进行检验二氧化硫. 【解答】解:(1)乙烯的分子式为C2H4,碳原子之间形成C=C双键,聚乙烯结构式为:,故答案为:; (2)a.一氯乙烯(CH2=CHCl)为平面结构,所有原子都在同一平面内,故a正确; b.乙烯中碳碳双键的键能是615kJ/mol,乙烷中碳碳单键的键能是348kJ/mol,故乙烯分子中的碳碳双键不是两条相同的碳碳单键,故b错误; c.乙烯可以催熟水果,高锰酸钾溶液可以氧化乙烯,以保持水果新鲜,故c正确; d.乙烯被酸性高锰酸钾溶液氧化得到二氧化碳,会引入新杂质,故d错误, 故答案为:bd; (3)溴水、酸性高锰酸钾溶液均能与乙烯、二氧化硫反应,不能检验混有的二氧化硫,用品红溶液进行检验二氧化硫, 故答案为:c. 21.已知乙烯能发生以下转化 (1)D物质所含官能团的名称是 羧基 ; (2)反应②(B﹣C)的反应类型是 氧化反应 ,其化学方程式是 2CH3CH2OH+O22CH3CHO+2H2O ; (3)B和D生成乙酸乙酯的反应类型是 酯化反应(或取代反应) ,其化学方程式是 CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O . 【考点】有机物的推断. 【分析】乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH,以此解答该题. 【解答】解:乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH, (1)D为CH3COOH,含有的官能团为羧基,故答案为:羧基; (2)反应②的化学反应方程式为:2CH3CH2OH+O22CH3CHO+2H2O,属于氧化反应, 故答案为:氧化反应;2CH3CH2OH+O22CH3CHO+2H2O; (3)B和D生成乙酸乙酯的方程式为CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O,属于酯化反应(或取代反应), 故答案为:酯化反应(或取代反应);CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O. 2017年1月21日查看更多