- 2021-07-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省漳平市第一中学高二上学期第二次月考试题 化学 Word版
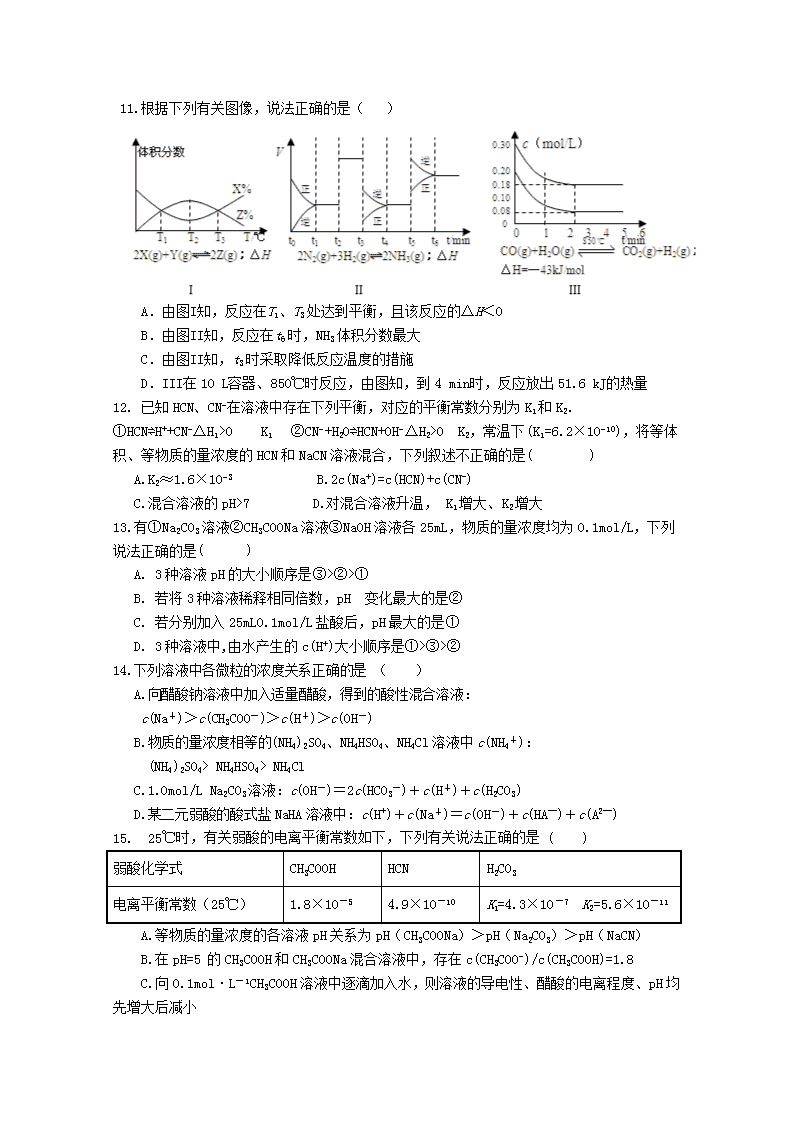
漳平一中 2018-2019 学年第一学期第二次月考高二化学试题 (考试时间:90 分钟 总分:100 分) 可能用到的相对原子质量 H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cu 64 Ag 108 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分 第Ⅰ卷(选择题,共 48 分) 一、单项选择题(每小题只有一个选项符合题意,每小题 3 分,共 48 分) 1. 化学与生产、生活密切相关。下列叙述正确的是( ) A. 明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理相同 B. 将 AlCl3、Fe(NO3)2、NaHCO3 溶液直接蒸干均不能得到原溶质 C. 铵态氮肥和草木灰(含 K2CO3)可以混合施用 D. 泡沫灭火器内的玻璃筒里盛碳酸氢钠溶液,铁筒里盛硫酸铝溶液 2.下列解释事实的反应方程式不正确的是( ) A. 热的纯碱溶液可去除油污:CO32-+2H2O H2CO3+2OH- B. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-2e-=Fe2+ C. 以 Na2S 为沉淀剂,除去溶液中的 Cu2+:Cu2++S2-=CuS↓ D.向电解饱和食盐水的两极溶液中滴加酚酞,阴极变红:2H2O+2e-==H2↑+2OH- 3. 用 NA 表示阿伏加德罗常数的值。下列叙述正确的是( ) A. 1 L 0.1 mol/L HClO 含有 0.1 NA 个 H+ B. 100mL 2mol/L 的 AlCl3 溶液中含 Al3+的数目为 0.2NA C. 25℃时,pH=13 的 1.0L Ba(OH)2 溶液中含有的 OH-数目为 0.1NA D.0.1 mol·L-1 Na2SO4 溶液中有 0.2 NA 个 Na+ 4.下列有关电化学装置的说法正确的是 ( ) A. 用图 1 装置处理银器表面的黑斑(Ag2S)银器表面发生的反应为 Ag2S+2e-=2Ag+S2- B. 用图 2 装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 C. 图 3 装置中若直流电源的 X 极为负极,则该装置可实现粗铜的电解精炼 D. 图 4 装置中若 M 是铜,则该装置能防止铁被腐蚀 5.下列说法不正确的是 ( ) A.反应 C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行 B.铅蓄电池在放电过程中,溶液的 PH 值增加 C.常温下,在 0.1mol/L 氨水中,加入少量 NH4Cl 晶体,溶液的 pH 减小 D.温度一定时,水的离子积常数 Kw 不随外加酸(碱)浓度的改变而改变 6.下列情况下,一定能大量共存的离子组为( ) A. pH=7 的溶液中:Fe3+、Cl-、Na+、SCN- B. 由水电离出的 c(H+)=1×10-13 mol·L-1 的溶液中:Na+、HCO3-、Cl-、K+ C. pH=1 的溶液中:NH4+、Cl-、Cu2+、SO42- D. 无色溶液中:Al3+、HCO3-、I-、K+ 7. 下列有关热化学方程式的评价合理的是( ) 选 项 实验事实 热化学方程式 评价 A 若 H+(aq)+OH -(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,将稀 硫酸和 NaOH 溶液混合 H2SO4(aq) + 2NaOH(aq)=== Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1 正确 B 醋酸和稀 NaOH 溶液混合 CH3COOH(aq)+NaOH(aq)=== CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 不正确,因为醋酸的 状态为“l”,而不是 “aq” C 160 g SO3 气体与足量液体水反应 生成 H2SO4 放出热量 260.6 kJ SO3(g)+H2O(l)===H2SO4(aq) ΔH=-130.3 kJ·mol-1 不正确:因为反应热 ΔH=-260.6kJ·mol- 1 D 1 mol C8H18(l)在 O2(g)中燃烧, 生成 CO2(g)和 H2O(l),放出 534 kJ 的热量 2C8H18(l)+25O 2(g)===16CO2(g) +18H2O(l) ΔH=-1 068 kJ·mol-1 正确 8. 一种锂铜可充电电池,工作原理如下图。在该电池中,非水系电解液和水系电解液被锂离 子固体电解质陶瓷片(Li+交换膜)隔开。下列说法不正确的是( ) A. 陶瓷片允许 Li+通过,不允许水分子通过 B. 放电时,N 极为电池的正极 C. 充电时,阳极反应为:Cu-2e-== Cu2+ D. 充电时,接线柱 A 应与外接电源的正极相连 9. 室温时,0.1mo1/L 某一元酸 HA 在水中有 0.1%发生电离,下列叙述错误 的是( ) A.该溶液的 pH=4 B.升高温度,溶液的 pH 增大 C.此酸的电离平衡常数约为 1×10-7 D.由 HA 电离出的 c(H+)约为水电离出的 c(H+)的 106 倍 10.下列各组数据中,前者一定比后者大的是( ) A.常温下 pH 相同的 KOH 溶液和 K2CO3 溶液中由水电离出的 c(OH-) B.25℃和 100℃时,纯水的 Kw 常数 C.3 L 0.1 mol·L-1CH3COOH 溶液和 1L 0.3 mol·L-1CH3COOH 溶液中的 H+离子数 D.中和 pH 与体积均相同的 NaOH 溶液和氨水,所消耗 H2SO4 的物质的量 11.根据下列有关图像,说法正确的是( ) A.由图I知,反应在T1、T3 处达到平衡,且该反应的△H<0 B.由图II知,反应在t6 时,NH3 体积分数最大 C.由图II知,t3 时采取降低反应温度的措施 D.III在 10 L容器、850℃时反应,由图知,到 4 min时,反应放出 51.6 kJ的热量 12. 已知 HCN、CN−在溶液中存在下列平衡,对应的平衡常数分别为 K1 和 K2. ①HCN⇌H++CN−△H1>0 K1 ②CN−+H2O⇌HCN+OH−△H2>0 K2,常温下(K1=6.2×10−10),将等体 积、等物质的量浓度的 HCN 和 NaCN 溶液混合,下列叙述不正确的是( ) A.K2≈1.6×10−3 B.2c(Na+)=c(HCN)+c(CN-) C.混合溶液的 pH>7 D.对混合溶液升温, K1 增大、K2 增大 13.有①Na2CO3 溶液②CH3COONa 溶液③NaOH 溶液各 25mL,物质的量浓度均为 0.1mol/L,下列 说法正确的是( ) A. 3 种溶液 pH 的大小顺序是③>②>① B. 若将 3 种溶液稀释相同倍数,pH 变化最大的是② C. 若分别加入 25mL0.1mol/L 盐酸后,pH 最大的是① D. 3 种溶液中,由水产生的 c(H+)大小顺序是①>③>② 14.下列溶液中各微粒的浓度关系正确的是 ( ) A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl 溶液中 c(NH4+): (NH4)2SO4> NH4HSO4> NH4Cl C.1.0mol/L Na2CO3 溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3) D.某二元弱酸的酸式盐 NaHA 溶液中:c(H+)+c(Na+)=c(OH-)+c(HA—)+c(A2—) 15. 25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是 ( ) 弱酸化学式 CH3COOH HCN H2CO3 电离平衡常数(25℃) 1.8×10-5 4.9×10-10 K1=4.3×10-7 K2=5.6×10-11 A.等物质的量浓度的各溶液 pH 关系为 pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) B.在 pH=5 的 CH3COOH 和 CH3COONa 混合溶液中,存在 c(CH3COO-)/c(CH3COOH)=1.8 C.向 0.1mol·L-1CH3COOH 溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH 均 先增大后减小 D.a mol·L-1HCN 溶液与 b mol·L-1 NaOH 溶液等体积混合后,所得溶液中c(Na+)>c(CN-), 则 a 一定小于 b 16.常温下,向 10 mL 0.1 mol· L-1 的某一元酸 HR 溶液中逐滴加入 0.1 mol·L-1 氨水,所 得溶液 pH 及导电能力变化如图。下列分析不正确的是( ) A.a~b 点导电能力增强,说明 HR 为弱酸 B.a、b 点所示溶液中水的电离程度不相同 C.b 点恰好完全中和,pH=7,说明 NH4R 没有水解 D.c 点溶液存在 c(NH4+)>c(R-)、c(OH-)>c(H+) 二.非选择题(52 分) 17.(14 分)按要求填空: (1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的________________。 (2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):_______________。 (3)已知 CO (g) + H2O (g) CO2 (g) + H2 (g),在 800℃时,该反应的化学平衡 常数 K=1.0,某时刻在一密闭容器中含 1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述 条件下此反应 v 正________v 逆(填“>”“<”或“=”)。 (4)将 25℃下 pH=12 的 NaOH 溶液 a L 与 pH=1 的 HCl 溶液 b L 混合。若所得混合液为中 性,则 a:b=_____________________。 (5)写出 0.1mol/LNaOH 溶液 1L 与标准状况下 1.12LCO2 完全反应后所得的溶液中各种 离子浓度由大到小的顺序为____________________________。 (6)某实验小组利用 CO(g)、O2(g)、KOH(aq)设计成如图 b 所示的电池装置,负极的电极反应式为 。用该原电 池做电源,常温下,用惰性电极电解 200 mL 饱和食盐水(足量),消 耗标准状况下的 CO 的体积为 224 mL,则溶液的 pH = ______ 。(不考虑溶液体积的变化) 18.(14 分)开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、 甲醇是优质的清洁燃料,可制作燃料电池。 (1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1 ②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1 ③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1 写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。 (2)生产甲醇的原料 CO 和 H2 来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g) ①一定条件下 CH4 的平衡转化率与温度、压强的关系 如图 a。则,Pl P2;A、B、C 三点处对应平 衡常数(KA、KB、KC)的由大到小的顺序为__________。 (填“<”、“>”“=”) ②100℃时,将 1 mol CH4 和 2 mol H2O 通入容积为 100 L 的反应室,如果 5min 达到平衡时 CH4 的转化率为 0.5, CH4 的 平 衡 转 化率 则 V(H2)=________________100℃时该反应的平 衡常数 K = 。反应达到平衡的标志是: 。 A.容器内气体密度恒定 B.单位时间内消耗 0.1 mol CH4 同时生成 0.3 mol H2 C.容器的压强恒定 D.3v 正(CH4)= v 逆(H2) ③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施 有________(填编号)。 A.升高温度 B.缩小容器体积 C.再充入 CH4 气体 D.使用合适的催化剂 19.(12 分) 电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答 下列问题: (1)t℃时,纯水中 c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数 KW= _______mol2••L-2;该温度下,pH=2 的 H2SO4 溶液中由水电离出的[H+]为_________ mol••L-1。 (2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其 中水的电离程度由大到小顺序为__________________(用序号回答)。 (3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的 pH=7,则溶液中 c(CH3COO-)+c(CH3COOH)=______ mol••L-1,则 a____ b(填“﹥”、“﹤”或 “=”)。 (4)常温下,稀释 0.5 mol·L−1 的醋酸溶液,下图中的纵坐标不能 表示_________ A.CH3COOH 的电离程度 B.溶液中 H+的数目 C.溶液中 的值 D.溶液中 CH3COOH 的浓度 20.(12 分)甲、乙两位同学设计实验确定某酸 HA 是弱电解质,实验方案如下: 甲:取纯度相同,质量、大小相等的锌粒于两支试管中, 同时加入浓度均为 0.1 mol·L-1 的 HA 溶液、稀盐酸各 10 mL,按图装好,观察现象。 乙:方案一:用 pH 计测定浓度为 0.1 mol·L-1HA 溶 液的 pH; 方案二:取 pH=3 的 HA 溶液 5 mL 稀释至 500 mL,再 用 pH 计测其 pH。 回答下列问题: (1)甲同学设计的方案中,说明 HA 是弱电解质的实验现象是___________ (填序号)。 A. 加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大 B. 加入 HA 溶液后,试管上方的气球鼓起慢 C. 加入稀盐酸后,试管上方的气球鼓起慢 3 3 (CH COO ) (CH COOH) c c − (2)乙同学设计的方案一中说明 HA 是弱电解质的理由是: ________________________________________________________________________________ _ (3)乙同学设计的方案二中说明 HA 是弱电解质的 PH 的范围为__________________ (4)丙同学为了进一步证明外界条件对弱电解质电离平衡移动的情况,设计如下实验: ①使 HA 的电离程度和 c(H+)都减小,c(A-)增大,可在 0.1mol·L-1 的 HA 溶液中,选择加 入____________试剂; ②使 HA 的电离程度减小,c(H+)和 c(A-)都增大,可在 0.1mol·L-1 的 HA 溶液中,选择加 入_____________试剂。 (5)若从盐类水解原理角度设计一个合理而比较容易进行的方案(药品可任取) ,证明 HA 是弱电解质,你的设计方案是________________________________。 漳平一中 2018-2019 学年第一学期第二次月考 高二化学试题参考答案 一、单项选择题(每小题只有一个选项符合题意,每小题 3 分,共 48 分) 1 2 3 4 5 6 7 8 B A C A A C D D 9 10 11 12 13 14 15 16 B C D A C B B C 17.(共 14 分) (1) 稀盐酸 (2) Al3++3H2O Al(OH)3+3H+ (没写“ ”不得分) (3) < (4) 10:1 (5)C(Na+)>C(CO32-)> C(OH-)> C(HCO3-)> C(H+) (6)CO - 2e–+4OH– = CO32-+ 2H2O 13 18. (共14分) (1)CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH = –442.8 kJ·mol – 1 (2)① < ; KC> KB >KA ②0.003mol/L·min(单位没写扣 1 分) 2.25×10–4 CD(漏选得 1 分,错选不得分) ③ B 19. (共 12 分)(1) 1×10-12 mol2·L-2 1×10-10mol·L-1 (2) ④①②③ (3) 0.5a mol·L-1 > (4)D 20. (共 12 分) (1) B (2) 测得 0.1 mol·L-1 的 HA 溶液的 pH > 1 (3) 3查看更多
相关文章
- 当前文档收益归属上传用户