- 2021-07-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年重庆市第一中学高一上学期10月月考试题 化学
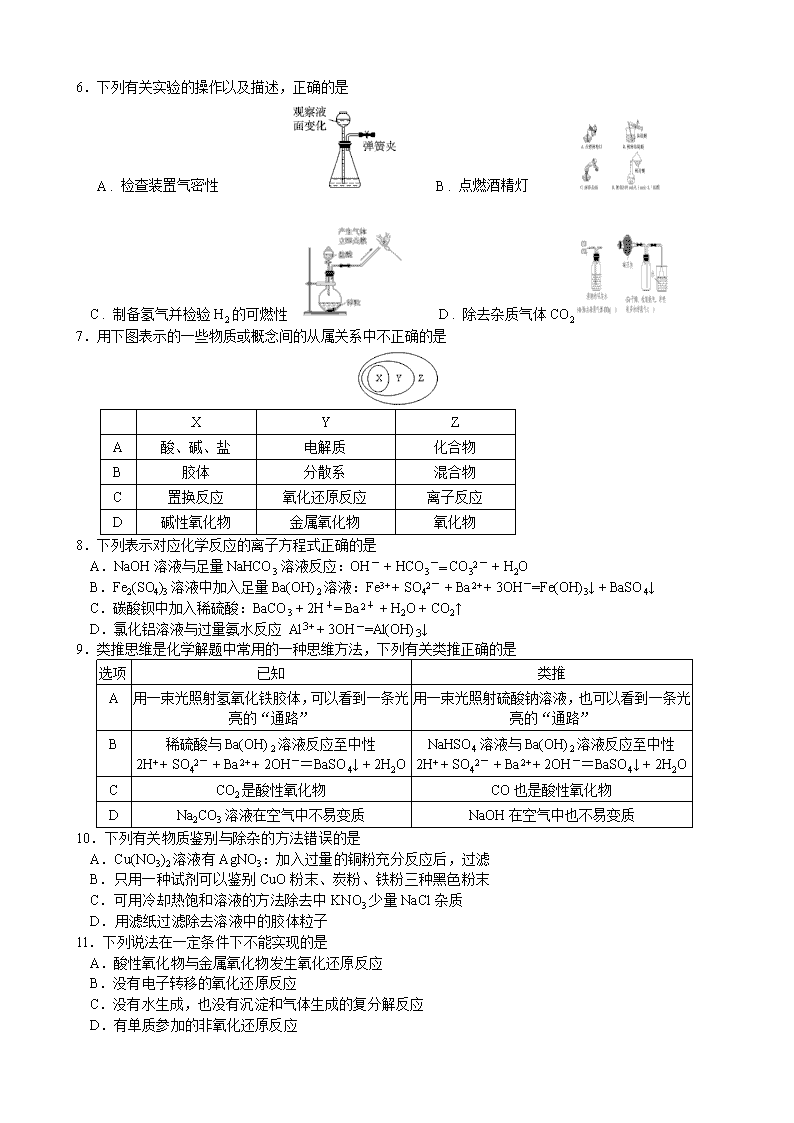
秘密★启用前 重庆一中高2022级高一上期月考考试 化 学 试 题 卷2019.10 化学试题共5页,满分100分,时间90分钟。 注意事项: 1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上。 2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干净后,再选涂其他答案标号。 3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。 4.所有题目必须在答题卡上作答,在试题卷上答题无效。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Ca 40 Ba 137 一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.根据化学反应的实质是原子之间的重新组合,下列变化不属于化学反应的是 A.白磷在260℃时转化为红磷 B.石墨在高温下转化为金刚石 C.NaCl熔化 D.木炭高温下还原氧化铜 2.下列有关物质分类或归类正确的一组是 A.胆矾、水煤气为化合物 B.水银、王水为混合物 C.纯碱、烧碱为电解质 D.小苏打、苛性钠为钠盐 3.下列情况中属于离子反应的是 A.加热高锰酸钾固体制氧气 B.用食醋除去水垢 C.Na2CO3·10H2O失去结晶水 D.氢气还原氧化铜 4.下列叙述正确的是 A.向某无色溶液中加入BaCl2溶液有白色沉淀出现,则该溶液中一定含有SO42- B.液态CH3COOH不导电,所以CH3COOH不是电解质 C.氢氧化铁胶体粒子带正电,所以进行电泳实验时,阴极区域颜色加深 D.盐类物质一定含有金属离子 5.下列反应能用离子方程式2H+ + CO32-=CO2↑ + H2O表示的是 A.HCl溶液与MgCO3反应 B.CH3COOH与K2CO3溶液反应 C.HNO3溶液与NaHCO3溶液反应 D.H2SO4溶液与(NH4)2CO3溶液反应 6.下列有关实验的操作以及描述,正确的是 A . 检查装置气密性 B . 点燃酒精灯 C . 制备氢气并检验H2的可燃性 D . 除去杂质气体CO2 7.用下图表示的一些物质或概念间的从属关系中不正确的是 X Y Z A 酸、碱、盐 电解质 化合物 B 胶体 分散系 混合物 C 置换反应 氧化还原反应 离子反应 D 碱性氧化物 金属氧化物 氧化物 8.下列表示对应化学反应的离子方程式正确的是 A.NaOH溶液与足量NaHCO3溶液反应:OH- + HCO3-= CO32- + H2O B.Fe2(SO4)3溶液中加入足量Ba(OH)2溶液:Fe3+ + SO42- + Ba2+ + 3OH-=Fe(OH)3↓ + BaSO4↓ C.碳酸钡中加入稀硫酸:BaCO3 + 2H+= Ba2+ + H2O + CO2↑ D.氯化铝溶液与过量氨水反应 Al3+ + 3OH-=Al(OH)3↓ 9.类推思维是化学解题中常用的一种思维方法,下列有关类推正确的是 选项 已知 类推 A 用一束光照射氢氧化铁胶体,可以看到一条光亮的“通路” 用一束光照射硫酸钠溶液,也可以看到一条光亮的“通路” B 稀硫酸与Ba(OH)2溶液反应至中性 2H+ + SO42- + Ba2+ + 2OH-=BaSO4↓ + 2H2O NaHSO4溶液与Ba(OH)2溶液反应至中性 2H+ + SO42- + Ba2+ + 2OH-=BaSO4↓ + 2H2O C CO2是酸性氧化物 CO也是酸性氧化物 D Na2CO3溶液在空气中不易变质 NaOH在空气中也不易变质 10.下列有关物质鉴别与除杂的方法错误的是 A.Cu(NO3)2溶液有AgNO3:加入过量的铜粉充分反应后,过滤 B.只用一种试剂可以鉴别CuO粉末、炭粉、铁粉三种黑色粉末 C.可用冷却热饱和溶液的方法除去中KNO3少量NaCl杂质 D.用滤纸过滤除去溶液中的胶体粒子 11.下列说法在一定条件下不能实现的是 A.酸性氧化物与金属氧化物发生氧化还原反应 B.没有电子转移的氧化还原反应 C.没有水生成,也没有沉淀和气体生成的复分解反应 D.有单质参加的非氧化还原反应 12.下列反应属于氧化还原反应,且水作氧化剂的是 A.CaO + H2O=Ca(OH)2 B.Cl2 + H2O=HCl + HClO C.2F2 + 2H2O=4HF + O2 D.2Na + 2H2O=2NaOH + H2↑ 13.下列反应中,电子转移发生在不同物质的同种元素之间的是 A.2H2S + SO2=3S↓ + 2H2O B.2KMnO4K2MnO4+MnO2+O2↑ C.2KClO32KCl + 3O2↑ D.CuO + H2SO4=CuSO4 + H2O 高温 II 碳、氯气 Fe 高温 I 碳 钛铁矿 TiO2 III高温 TiCl4 MgCl2 Ti 足量Mg 14.2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2) 提取金属钛的主要工艺流程如图,下列说法错误的是 A.步骤I中碳作还原剂 B.步骤II中未发生氧化还原反应 C.步骤III需在氩气环境中进行,防止金属被空气氧化 D.可用稀硫酸除去金属钛中的少量镁 15.小明做实验时不小心沾了一些高锰酸钾,皮肤上出现了难看的黑斑,老师告诉他可以用草酸的稀溶液进行清洗,其反应的离子方程式为:MnO4- + H2C2O4 + H+=CO2↑ + Mn2++_______(未配平),下列说法正确的是 A.该反应的氧化剂为H2C2O4 B.该反应右边横线内的产物为OH- C.该反应配平后H+的化学计量数为6 D.在该反应中有1个H2C2O4参加反应,转移电子总数为6个 16.A2O82-离子在一定条件下可以把Mn2+离子氧化,若反应后A2O82-离子变为AO42-离子,又知反应中氧化剂和还原剂的系数之比为2︰1,Mn2+离子被氧化后Mn元素的化合价为 A.+4 B.+5 C.+6 D.+7 二、非选择题:本题共5题,共52分。 17 . (11分)现有下列六种物质: ①稀盐酸 ②小苏打 ③NH3 ④NaOH溶液 ⑤熔融KHSO4 ⑥红褐色的氢氧化铁胶体 (1)上述六种物质中,属于非电解质的有 (填序号,下同)。 (2)①~⑤物质,在上述状态下可导电的物质是 。 (3)请写出实验室制备⑥物质的化学方程式________________________。 (4)胃液中含有①,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的②,能治疗胃酸过多,请写出其反应的离子方程式 。 (5)往⑥中,逐滴加入①直至过量,整个过程中观察到的现象是__________________________________。 (6)将冷却后的⑤加到④的溶液中,④的溶液导电能力变化为 (填“增强”“减弱”或“基本不变”)。 18.(12分)净水剂能够改善水质,给人们的生活、健康带来很大的益处。 (1)明矾[KAl(SO4)2·12H2O]是常见净水剂。KAl(SO4)2在水中的电离方程式为 。明矾净水是因为在水中生成胶状Al(OH)3,胶状Al(OH)3具有 的作用。 …… 过滤 Fe等废渣 蒸发 溶解 过量 盐酸 铝土矿 适量铝粉 浓缩 浊液 浊液 产品 AlCl3溶液 (2)碱式氯化铝[Al2(OH)nCl6﹣n]是高效净水剂,实验室模拟利用铝土矿(主要含有Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝的过程如图: ①溶解铝土矿过程中,Al2O3发生反应的离子方程式为 。溶解过程中需不断搅拌,目的是 。 ②已知氧化性:Fe3+ > H+ > Fe2+ > Al3+,加入适量铝粉,目的一是将Fe3+还原为Fe,反应的离子方程式为 ,为了确保目的一的实现,用文字描述加入适量铝粉的目的二是______________。 ③蒸发浓缩过程中生成Al2(OH)nCl6﹣n固体,请补充且配平其反应的离子方程式: 2Al3+ + □____ + (6﹣n)Cl﹣=Al2(OH)nCl6﹣n + nH+ 。 ④蒸发浓缩所需的玻璃仪器有酒精灯和 。 19.(9分)现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,部分溶于水后电离可以产生下表中的离子: 阳离子 Na+ H+ Ba2+ 阴离子 OH- CO32- SO42- 为鉴别它们,分别完成以下实验,其结果如下: ① A溶液与B溶液反应生成无色气体x, x可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应; ② B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。 请根据上述实验结果,填空: (1)写出下列物质的化学式:x ,B , C 。 (2)写出C溶液与x气体反应生成沉淀E的离子方程式: (3) D与E的混合物a g ,加入足量盐酸,反应完毕生成b g气体x,则D在混合物中的质量分数为 。 (4)B溶液与A溶液反应至不再产生气泡,写出该反应的离子反应方程式 。 20 .(10分) (1)已知实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2 + 2NO↑ + 4H2O。 ①反应中氧化剂是________; 被氧化的元素是________;氧化产物是________。 ②若有4 g NO生成,有_____g HNO3被还原。 (2)请用双线桥法标出下列反应电子转移的方向和数目 10Al + 6NaNO3 + 4NaOH === 10NaAlO2 + 3N2↑ + 2H2O (3)Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原系统中,发生BiO3-→Bi3+的反应过程,据此回答下列问题 ①该氧化还原反应中,被还原的元素是 。 ②请将氧化剂、还原剂的化学式及配平后的系数填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目。 □_______ + □_______ → 21.(10分)过氧化钙(CaO2,其中O为-1价),微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。 已知:过氧化钙遇水缓慢发生如下反应:2CaO2+2H2O = 2Ca(OH)2+ O2↑ 回答下列问题: (一)过氧化钙的制备 ② 氨水和双氧水 稀盐酸、煮沸 ① 过滤 ③ CaCO3 白色晶体 (1)步骤①的具体操作为逐滴加入适量稀盐酸,将溶液煮沸。判断加入的盐酸“适量”的方法是 。 (2)步骤②中生成CaO2沉淀的化学方程式为 ,该反应______(填“是”或“不是”)氧化还原反应。 (3)右图是步骤③某学生的过滤操作示意图,其操作规范的是______(填标号)。 a.漏斗末端颈尖紧靠烧杯壁 b.玻璃棒用作引流 c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗 e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度 (二)测定久置过氧化钙样品中碳酸钙含量 实验方案如下: ①如上图所示,连接好装置,检查装置气密性合格; ②称量20 g样品置于烧杯中,加入适量水混合,待其充分反应后,将烧杯中全部溶液和固体倒入图中烧瓶内,向分液漏斗中加入足量稀盐酸待用; ③将量气管液面调节到“0”刻度,并使量气管内液面与油层相平,打开止水夹和分液漏斗活塞; ④反应结束后,冷却至室温,再次上下移动量气管,至量气管内的液面与油层液面相平,读出气体体积; ⑤查得CO2的密度,计算样品中碳酸钙的质量分数。 请回答以下问题: (4)图中油层的作用为 ,油层上方留有空气,会使测量结果 (填“偏大”、“偏小”或“不受影响”)。 (5)反应结束后,测得量气管读数为1120 mL,根据该条件下CO2的密度得知生成CO2的质量为2.2 g。样品中碳酸钙的质量分数为________。 重庆一中高2022级高一上期月考考试 化 学 答 案2019.10 1-5 CCBCD 6-10 ACABD 11-15 BDABC 16 C 17 . (11分) (1) ③(1分) (2)①④⑤(3分)(建议:见对就给1分,错误不扣分) (3)FeCl3+3H2OFe(OH)3(胶体)+3HCl(2分)(建议:加热符号、胶体二字、配平合并为1分,物质写错0分) (4)H++HCO3-= H2O + CO2↑(2分) (5)开始有红褐色沉淀生成(1分),然后红褐色沉淀逐渐溶解(1分) (6)增强(1分) 18 . (12分) (1) KAl(SO4)2=K++A13++2SO42﹣ (2分) 凝聚水中的悬浮物,并能吸附色素(1分) (2) ①Al2O3+6H+=2Al3++3H2O (2分) 加快反应速率(1分) ②3Al+2Fe3+=3Al3++2Fe(2分) 除去过量的H+,以确保Al能将Fe3+还原为Fe2+,进而能继续将其还原为Fe单质(2分) (建议:答到除去过量H+,给1分,有进一步详细理由叙述,另给1分) ③ n H2O(1分) ④玻璃棒(1分) 19 . (9分) (1)CO2 (1分) NaHSO4(1分) Ba(OH)2 (1分) (2)Ba2+ + 2OH- + CO2 = BaCO3 ↓ + H2O(2分) (3)1- ×100% (2分) (4)(2分) 20 . (10分) (1)①HNO3(1分) Cu(1分) Cu(NO3)2 (1分) ② 8.4(2分) (2)(双线桥略)(2分) 10e- (3)①Bi(1分) ② 2Mn2+ + 5BiO3﹣ (2分)(建议:配平1分,单线桥1分) 21.(10分) (1)滴加盐酸至无气泡放出为止或测定pH(1分) (2) CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl +2H2O (或CaCl2+2NH3+H2O2=CaO2↓+2NH4Cl) (2分) (建议:配平和↓符号合并为1分,物质写错,0分) 不是(1分) (3)abc (2分) (4)防止CO2溶于水损失,从而使得测定结果偏小 (1分)(建议:答到防止CO2溶于水即给1分,没有答到“结果偏小”不扣分) 不受影响(1分) (5) 25%(2分)查看更多