- 2021-07-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019学年高一化学下学期期末考试试题 新人教版(1)
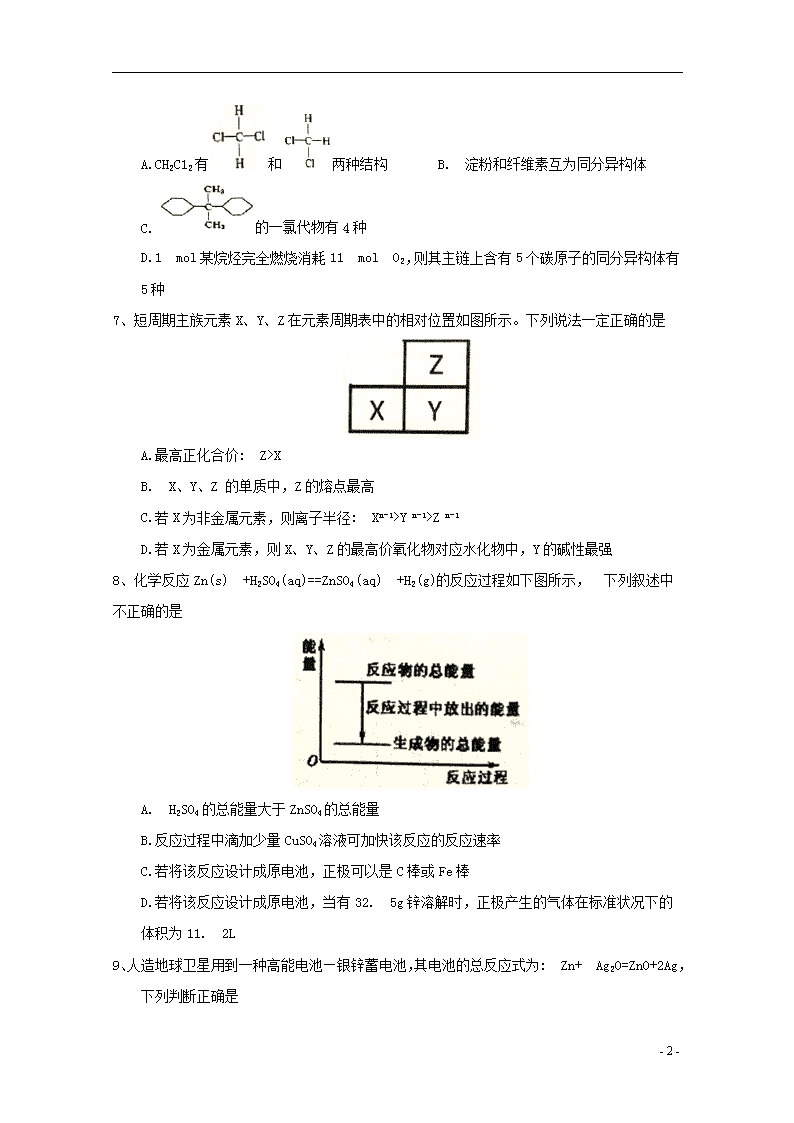
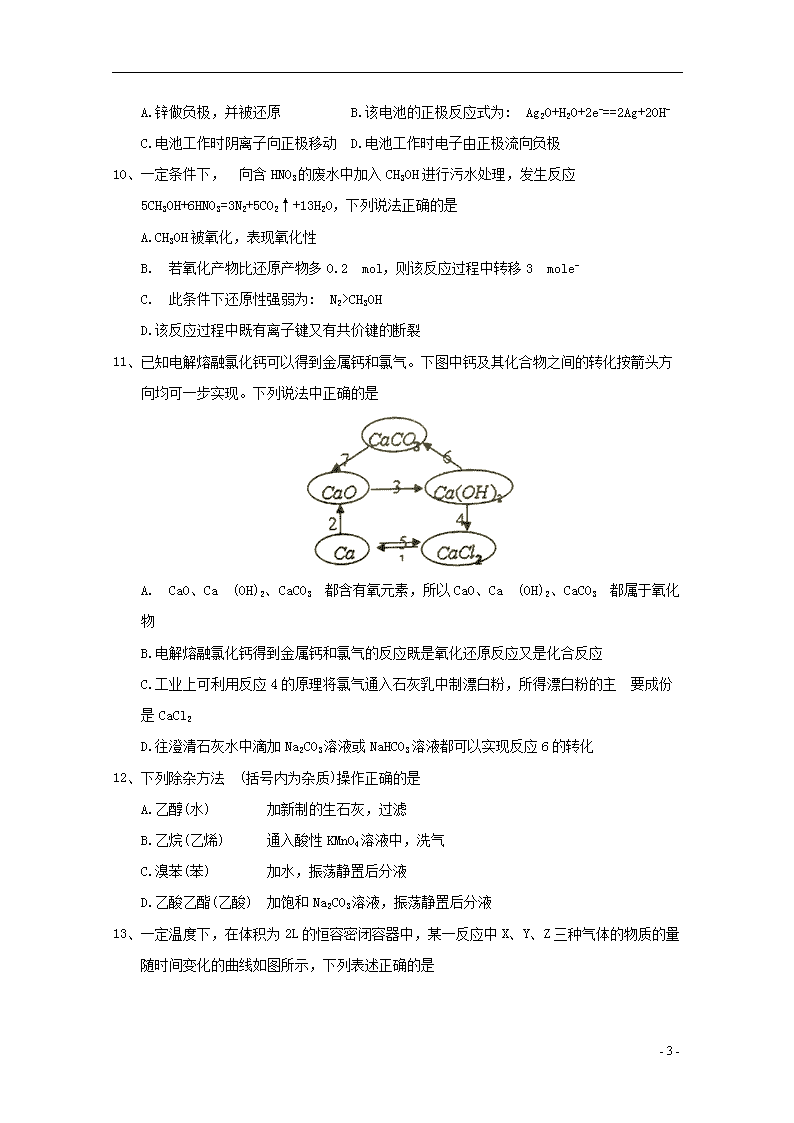
2019学年高一化学下学期期末考试试题 本卷可能用到的相对原子质量: H-1 C-12 O-16 Na-23 A1-27 S-32 Fe-56 Zn-65 第I卷 一、选择题(每小题只有一个选项符合题意,每小题3分,共48分) 1、十九大报告指出:建设生态文明是中华民族永续发展的千年大计,必须树立和践行绿水青山就是金山银山的理念……实行最严格的生态环境保护制度,形成绿色发展方式和生活方式。下列有关节约资源和保护环境的说法不正确的是 A.用脱硫处理的煤代替原煤作燃料可以有效减少空气中SO2气体的含量 B.煤经气化和液化两个物理过程,可变为清洁能源,减少对环境的污染。 C.使用地热能、生物质能等非化石能源可减少PM2.5 D.创新生产工艺,实现电动机车替代燃油机车符合绿色发展方式 2、下列有关化学用语使用正确的是 A.作为相对原子质量测定标准的碳核素:146C B.乙酸的结构简式:C2H4O2 C.CH4分子的球棍模型: D.-CH3 (甲基)的电子式为: 3、近几年朝鲜不断进行核试验,重水(D2O)是重要的核工业原料。下列说法正确的是 A .氘(D)原子核外有2个电子 B. H2与D2互为同位素 C. H2O与D2O互为同素异形体 D. H218O与D216O的相对分子质量相同 4、设NA为阿伏加德罗常数的值, 下列说法正确的是 A.常温下,将5. 6g铁片投入足量浓硝酸中生成6. 72LNO2气体 B.1mol苯乙烯()分子中含有碳碳双键的个数为4 NA C.标准状况下,11.2L的二氯甲烷所含的分子数为0. 5NA D.常温常压下,28g由CH4和C3H6组成的混合物中,H原子的数目为4NA 5、下列有关元素的性质及其递变规律叙述正确的是 A. IA族与VIIA族元素的原子间可形成共价化合物或离子化合物 B.同主族元素的简单阴离子还原性越强,其元素的非金属性也越强 C.非金属元素的气态氢化物的稳定性越强其沸点也越高 D.同周期金属元素的化合价越高,其原子失电子能力也越强 6、下列叙述正确的是 - 9 - A.CH2C12有和两种结构 B. 淀粉和纤维素互为同分异构体 C.的一氯代物有4种 D.1 mol某烷烃完全燃烧消耗11 mol O2,则其主链上含有5个碳原子的同分异构体有5种 7、短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是 A.最高正化合价: Z>X B. X、Y、Z 的单质中,Z的熔点最高 C.若X为非金属元素,则离子半径: Xn-1>Y n-1>Z n-1 D.若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强 8、化学反应Zn(s) +H2SO4(aq)==ZnSO4(aq) +H2(g)的反应过程如下图所示, 下列叙述中不正确的是 A. H2SO4的总能量大于ZnSO4的总能量 B.反应过程中滴加少量CuSO4溶液可加快该反应的反应速率 C.若将该反应设计成原电池,正极可以是C棒或Fe棒 D.若将该反应设计成原电池,当有32. 5g锌溶解时,正极产生的气体在标准状况下的体积为11. 2L 9、人造地球卫星用到一种高能电池—银锌蓄电池,其电池的总反应式为: Zn+ Ag2O=ZnO+2Ag,下列判断正确是 - 9 - A.锌做负极,并被还原 B.该电池的正极反应式为: Ag2O+H2O+2e-==2Ag+2OH- C.电池工作时阴离子向正极移动 D.电池工作时电子由正极流向负极 10、一定条件下, 向含HNO3的废水中加入CH3OH进行污水处理,发生反应5CH3OH+6HNO3=3N2+5CO2↑+13H2O,下列说法正确的是 A.CH3OH被氧化,表现氧化性 B. 若氧化产物比还原产物多0.2 mol,则该反应过程中转移3 mole- C. 此条件下还原性强弱为: N2>CH3OH D.该反应过程中既有离子键又有共价键的断裂 11、已知电解熔融氯化钙可以得到金属钙和氯气。下图中钙及其化合物之间的转化按箭头方向均可一步实现。下列说法中正确的是 A. CaO、Ca (OH)2、CaCO3 都含有氧元素,所以CaO、Ca (OH)2、CaCO3 都属于氧化物 B.电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应 C.工业上可利用反应4的原理将氯气通入石灰乳中制漂白粉,所得漂白粉的主 要成份是CaCl2 D.往澄清石灰水中滴加Na2CO3溶液或NaHCO3溶液都可以实现反应6的转化 12、下列除杂方法 (括号内为杂质)操作正确的是 A.乙醇(水) 加新制的生石灰,过滤 B.乙烷(乙烯) 通入酸性KMnO4溶液中,洗气 C.溴苯(苯) 加水,振荡静置后分液 D.乙酸乙酯(乙酸) 加饱和Na2CO3溶液,振荡静置后分液 13、一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述正确的是 - 9 - A.该反应的化学方程式为2X=3Y+ Z B. t min时,正、逆反应都不再继续进行,反应达到平衡状态 C. 若t=4,则0~t时间段内X的平均反应速率为0.1 mol/ (L·min) D.保持温度、体积不变,t时刻时向容器中充入1 mol He使压强增大,则该反应的正、逆反应速率都增大 14、下图为有关苯的转化关系图,下列说法中不正确的是 A.反应①、③均为取代反应 B.反应②的现象是火焰明亮并伴有浓烟 C.甲苯()与苯互为同系物 D.反应④的产物中所有原子共平面 15、取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是 A. C2H2 C2H6 B.CH4 C3H8 C.C2H4 C4H8 D.C3H6 C3H8 16、近两年流行喝果醋,草果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(a 羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为: 下列说法不正确的是 A.苹果酸在一定条件 下能发生酯化反应 - 9 - B.苹果酸在一定条件下能发生催化氧化反应 C.1mol苹果酸与足量金属钠反应最多可以产生1.5molH2 D. 1mol 苹果酸与NaHCO3溶液反应最多消耗3mol NaHCO3 第II卷(非选择题) 二、填空题(共52分) 17、(14分) A、B、C、D、E是元素周期表中原子序数依次增大的五种短周期元素,A、E同主族,A的原子核内只有一个质子,B原子最外层电子数是内层电子总数的2倍,C元素的最高价氧化物的水化物与C的氢化物反应可以生成一种盐;A、E二种元素都能与D元素分别形成原子个数比为1: 1或1: 2的常见化合物。 回答下列问题: (1)写出B元素在周期表中的位置_______________,A2D2 的电子式为_________________,D、E两元素形成1:1的化合物中所含化学键的类型为________________________。 (2) A分别与B、C、D形成的10电子分子的稳定性由弱到强的顺序为:_______<______<___。(用化学式表示) (3) A和B可形成5核分子丁,了的空间构型为:_____,已知丁在光照条件能和C12发生反应,标准状况下22. 4L丁与C12完全反应后,测得4种有机产物的物质的量相等,则消耗Cl2___ mol (4)写出C的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式_____________。 18、(10分)铝热反应是铝的一个重要性质。 (1)按图1装置进行实验,可观察到反应剧烈,火星四射,漏斗下方有红热熔融物“铁块”流出。该反应的化学方程式为___________,其能量变化为图2中的____(填“A”或“B”)所示。 - 9 - (2)某校化学兴趣小组同学,为了测定铝热反应后得到“铁块”混合物中铝的含量。取“铁块”样品研碎,称得其质量为xg,然后将它加入到图3装置中,再滴入足暈NaOH溶液充分反应,测量生成气体体积为amL (标准状况下)。 ①仪器A的名称为________________。 ②写出样品中Al与NaOH溶液反应的化学方程式_________________。 ③该小组同学通过对实验进行进一步 的分析和讨论后,对实验装置进行了改进,用恒压漏斗(如图4)代替仪器A,其优点有_________________(写1点即可)。 ④该样品中铝的含量为__________________。 19、(14分)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上常以CO和H2的混合气体为原料在一定条件下制备甲醇。 (1)工业上可以通过下列途径获得H2,其中节能效果最好的是___________。 A.高温分解水制取H2: 2H2O2H2↑+ O2↑ B.电解水制取H2: 2 H2O2H2↑+ O2↑ C. 甲烷与水反应制取H2: CH4+ H2O 3H2+ CO D. 在光催化剂作用下,利用太阳能分解水制取H2: 2H2O 2H2↑+ O2↑ (2)在2L的密闭容器中充入1mo1CO和2molH2,一定 条件下发生反应; CO(g) +2H2(g) CH3OH(g),测得CO和CH3OH(g)的物质的量随时间的变化如下图所示。 - 9 - ①从反应开始到平衡,氢气的平均反应速率v(H2)=_____,平衡时氢气的体积分数为____。 ②能够判断该反应达到平衡的是______。 A. CO、H2和CH3OH三种物质的浓度相等 B.密闭容器中混合气体的密度不再改变 C.密闭容器中混合气体的平均相对分子质量不再改变 D.相同时间内消耗1mo1CO,同时消耗1molCH3OH (3)为使合成甲醇原料的原子利用率达到100%, 实际生产中制备水煤气时还需使用CH4,则生产投料时,n(C) : n(H2O) : n(CH4)=__________。 (4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生的二氧化碳被充分吸收生成CO32-。则该电池负极的电极反应式为______,电池放电过程中溶液的pH将_____(填“下降”、“上升”或“不变”)。 20、(14分) A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工发展水平。D是具有果香气味的烃的衍生物,A、B、C、D在一定条件下存在如下转化关系(石蜡油是含17个碳原子以上的液态烷烃混合物,部分反应条件,产物被省略) 。 (1)工业上,从石油中获得汽油、煤油、石蜡油等成份的方法是_________________。 (2)写出A的结构简式__________;C中所含官能团的名称__________________。 (3)①A→B的反应类型是:_______________________________。 ②写出B+C→D的化学反应方程式:_____________________________________。 - 9 - (4)有机反应中,条件不同往往生成的产物也不同。请写出B在Cu、加热的条件下发生催化氧化反应的化学方程式___________________________________________。 (5)丁烷和戊烷等烷烃是石蜡油获得A的过程中的中间产物: ①请写出丁烷的所有同分异构体的结构简式______________________________。 ②戊烷的一种同分异构体,它的一氯取代物有4种,则这种同分异构体的结构简式为_____。 1-5:BCDDA 6-10:DCABB 11-16:DDCDCD 17、(共14分,每空2分) (1)第二周期 第IVA族 离子键 非极性共价键 (2)CH4查看更多
相关文章
- 当前文档收益归属上传用户