- 2021-07-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广东省佛山市三水区实验中学高一上学期第一学段考试化学试题
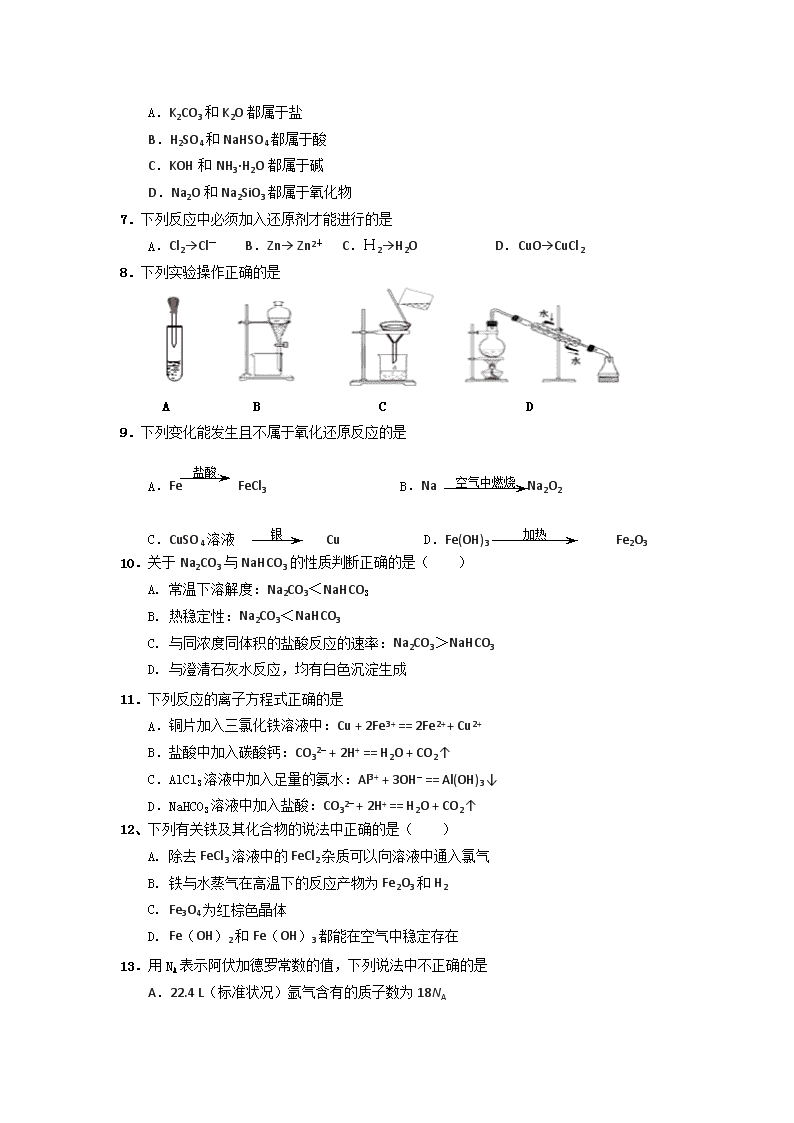
2018-2019学年广东省佛山市三水区实验中学高一上学期第一学段考试化学试题 可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 Al 27 Cl 35.5 Ca 40 Fe 56 一、选择题(本题包括20小题,只有一个选项符合题意。每小题2分,共40分) 1.2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法 应提倡的是 A.夏天设定空调温度尽可能的低 B.推广使用一次性塑料袋和纸巾 C.少开私家车多乘公共交通工具 D.对商品进行豪华包装促进销售 2.有关焰色反应的说法正确的是( ) A. 焰色反应是金属单质表现的性质 B. 焰色反应是因为发生了化学变化而产生的 C. 焰色反应看到黄色火焰并不能确定该物质一定不含钾元素 D. 洗涤焰色反应中用到的铂丝可用稀硫酸代替稀盐酸 3.下列电离方程式正确的是( ) A、H2SO4 = 2H + + S6+ + 4O2- B、HNO3 = H+ + NO3 - C、Ba(OH)2 = Ba2+ + OH - D、Na2CO3 = Na2+ + CO32- 4. 下列实验操作或事故处理正确的是 A.实验结束后,用嘴吹灭酒精灯 B.把水加入到浓硫酸中来配置稀硫酸 C.金属Na着火,立即用水扑灭 D.实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 5.只用试管和胶头滴管而不用其他任何试剂无法区分一组试剂是: A.硫酸铝溶液和氢氧化钠溶液 B.偏铝酸钠溶液和盐酸 C.氯化镁溶液和氨水 D.盐酸和碳酸钠溶液 6.分类是学习和研究化学的一种重要方法,下列分类合理的是 A.K2CO3和K2O都属于盐 B.H2SO4和NaHSO4都属于酸 C.KOH和NH3·H2O都属于碱 D.Na2O和Na2SiO3都属于氧化物 7.下列反应中必须加入还原剂才能进行的是 A.Cl2→Cl- B.Zn→ Zn2+ C.H2→H2O D.CuO→CuCl2 8.下列实验操作正确的是 A. B. C. D. A B C D 9.下列变化能发生且不属于氧化还原反应的是 盐酸 空气中燃烧 A.Fe FeCl3 B.Na Na2O2 加热 银 C.CuSO4溶液 Cu D.Fe(OH)3 Fe2O3 10.关于Na2CO3与NaHCO3的性质判断正确的是( ) A. 常温下溶解度:Na2CO3<NaHCO3 B. 热稳定性:Na2CO3<NaHCO3 C. 与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3 D. 与澄清石灰水反应,均有白色沉淀生成 11.下列反应的离子方程式正确的是 A.铜片加入三氯化铁溶液中:Cu + 2Fe3+ == 2Fe2+ + Cu2+ B.盐酸中加入碳酸钙:CO32- + 2H+ == H2O + CO2↑ C.AlCl3溶液中加入足量的氨水:Al3+ + 3OH- == Al(OH)3↓ D.NaHCO3溶液中加入盐酸:CO32- + 2H+ == H2O + CO2↑ 12、下列有关铁及其化合物的说法中正确的是( ) A. 除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气 B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2 C. Fe3O4为红棕色晶体 D. Fe(OH)2和Fe(OH)3都能在空气中稳定存在 13.用NA表示阿伏加德罗常数的值,下列说法中不正确的是 A.22.4 L(标准状况)氩气含有的质子数为18NA B.同等质量的氧气和臭氧中,电子数相同 C.常温常压下18g水所含的原子数目为3NA D.24 g 镁与27 g铝分别和足量的盐酸反应,失去电子数目都为2NA 14.某无色透明溶液,在酸性环境下能大量共存的离子组是 A.Na+、SO42-、HCO3-、C1- B.Mg2+、Cl-、Na+、NO3- C.K+、MnO4-、NO3-、Fe2+ D.Cu2+、Cl-、NH4+、SO42- 15.在2KMnO4 +16HCl === 2KCl +2MnCl2 + 5Cl2↑+8 反应中 A.KMnO4 的还原性比Cl2强 B. 处对应的物质为H2O,它是氧化产物 C.氧化剂与还原剂物质的量之比为1∶8 D.若1mol KMnO4参加反应,转移的电子的物质的量是5mol 16.用下图表示的一些物质或概念间的从属关系中不正确的是 X Y Z A. 酸 化合物 纯净物 B. 电解质 盐 化合物 C. 胶体 分散系 物质 D. 碱性氧化物 氧化物 化合物 Z X Y 17.下列有关物质的性质与其应用不相对应的是( ) A. MgO、Al2O3的熔点很高,可制作耐高温材料 B. NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂 C. Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品 D. 利用钠蒸气放电发光的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光 18.下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是 ①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3 A.③④ B.①②③④ C.①③④ D.全部 19.某溶液中有Mg2+、Fe2+、Fe3+和Al3+四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,过滤,在滤渣中再加入过量的盐酸,所得溶液中大量增加的阳离子是 A.Mg2+ B.Fe2+ C.Fe3+ D.Al3+ 20.有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为( ) A. 1:1 B. 1:2 C. 1:3 D. 2:1 二、填空题(除特别指明外,每空2分) 21、(16分) (1)除去Na2CO3粉末中混入NaHCO3杂质用 方法,化学方程式 为 。 (2)除去Fe2O3中混有Al2O3 杂质的试剂是 ,离子方程式 为 。 (3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原, 原因是(用化学方程式表示) 。 (4)下列物质:①Na ② CO2 ③NH3 ④盐酸⑤H2SO4 ⑥Ba(OH)2 ⑦蔗糖⑧NaCl溶液 ⑨AgCl 以上属于电解质的是 (5)在Fe3O4 +4CO3Fe+4CO2的的中, 是氧化剂, 元素被氧化,氧化产物和还原产物的物质的量的比为_______ (6)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式: ____________________ ; 22、(8分) 根据上图和实验现象,回答下列问题:(用化学式表示) (1)A是 ,B是 ,C是 ,X粉末是 。 (2)写出反应①的化学方程式 (3)写出反应②的离子方程式 23.(12分)工业上常用大理石等原料制取安全无毒的杀菌剂过氧化钙(CaO2)。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤: (1) 溶解大理石时,用硝酸而不用硫酸的原因是 。 (2)操作Ⅱ中加入的A是少量的氨水,其目的是 。 涉及的离子方程式为:_____________________________________________________ (3)写出检验滤液B中是否含Fe3+的方法是 (4)写出加入碳酸铵所发生反应的离子方程式: 。 (5)CaO2与水反应会放出氧气,化学方程式为 。 24.(10分)用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④检漏、转移、洗涤,⑤定容、摇匀。回答下列问题: (1)所需浓硫酸的体积是 (保留到小数点后一位)。 (2)在上述实验步骤中,需要用到玻璃棒的有 (填序号)。 (3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用 胶头滴管向容量瓶滴加至 为止。塞紧瓶塞,倒转摇匀。 (4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”) A. 所用的浓硫酸长时间放置在密封不好的容器中 B. 容量瓶用蒸馏水洗涤后残留有少量的水 C. 定容时俯视溶液的凹液面 (5)2g Ag和Al的混合物,加入足量的稀硫酸充分反应,生成气体的体积为0.672L(标况),则混合物中Ag的质量分数为____________________ 25.(14分)下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白: (1)B中盛有一定量的 ,A中应预先加入的试剂是 , A中反应的化学方程式为 。 (2)实验开始时应先将活塞E (填“打开”或“关闭”),目的是 。在C中收到气体主要为________________。 (3)简述生成Fe(OH)2操作过程 _____________________________________________________________________ (4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化,写出有关反应化 学方程式:__________________________________________ 若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为 L(标准状况)。 2018-2019学年三水实验中学高一第一学段考试 化学答案 一、选择题(20小题,每小题2分,共40分) 题号 1 2 3 4 5 6 7 8 9 10 答案 C C B D C C A B D D 题号 11 12 13 14 15 16 17 18 19 20 答案 A A D B D B B B C B D 二、(5小题,共60分,除特别指明外,每空2分) 21. (1)加热 2NaHCO3===Na2CO3+H2O+CO2 (2)NaOH溶液(强碱均 Al2O3+2OH-==2AlO2-+H2O (3)2Al+2NaOH+2H2O==2NaAlO2+3H2↑ (4)⑤ ⑥⑨ (5)Fe3O4 ,C ,4:3 (6)HCO3-+OH-==CO32-+H2O 22.(1)A:Na2O2 B:O2 C:Na2CO3 X:Cu (2)2Na2O2+2CO2 = 2Na2CO3+O2 (3)Cu2+ +2OH- = Cu(OH)2↓ 23.(1)生成的硫酸钙微溶于水,阻止反应继续进行 (2)除去溶液中Fe3+ Fe3++3NH3H2O=Fe(OH)3 +3NH4+ (3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+(或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+) (4)Ca2++CO32-=CaCO3↓ (5)2CaO2+2H2O==2Ca(OH)2+O2 24.(1)16.7ml (2)③④(3)凹液面与刻度线相切 (4)偏小 无影响 偏大 (5)73% 25.(1)NaOH溶液 铁屑 Fe+H2SO4===FeSO4+H2 (2)打开 让生成的氢气排走装置和溶液中的空气 (3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应 (4)4Fe(OH)2+O2+2H2O = 4Fe(OH)3 0.224查看更多