2017-2018学年江苏省邗江中学高二下学期期中考试化学试题 Word版
江苏省邗江中学2017-2018学年度第二学期
高二化学期中试卷(选修)
命题人:马志远
说明:本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分120分,考试时间100分钟。
第I卷(选择题共40分)
单项选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示醋酸的pH为2~3
2.在2L密闭容器中充入2 molI2(g)和2 molH2(g),发生反应I2(g)+H2(g)2HI(g),经测定前2s用H2表示的反应速率为0.1mol·L-1·s-1,则5s末HI的浓度为
A.1mol·L-1 B.大于1mol·L-1 C.小于1mol·L-1 D.不能确定
3.对于可逆反应A(g)+3B(g)2C(g)+2D(s),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5mol·L-1·min-1 B.v(B)=0.6mol·L-1·s-1
C.v(C)=0.4mol·L-1·min-1 D.v(D)=0.3mol·L-1·s-1
4.若向一个2L的密闭容器中充入0.6molSO2、0.2molO2和0.2molSO3,发生反应2SO2(g)+O2(g)2SO3(g) ΔH<0;当反应达到平衡时,各物质的浓度可能是
A.c(SO2)=0.2mol·L-1、c(O2)=0.1mol·L-1 B.c(SO3)=0.2mol·L-1
C.c(O2)=0.15mol·L-1、c(SO2)=0.4mol·L-1 D.c(SO3)=0.3mol·L-1
5.稀氨水中存在着下列平衡:NH3·H2ONH+OH-,若要使c(H+)/c(NH4+)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③水 ④NaOH固体 ⑤加热
A.②③ B.②④ C.①④ D.③⑤
6.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是
选项
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/mol·L-1
V/mL
c/mol·L-1
V/mL
A
25
5
0.2
10
0.1
5
B
35
5
0.2
10
0.1
10
C
25
5
0.1
5
0.2
5
D
35
5
0.1
5
0.2
10
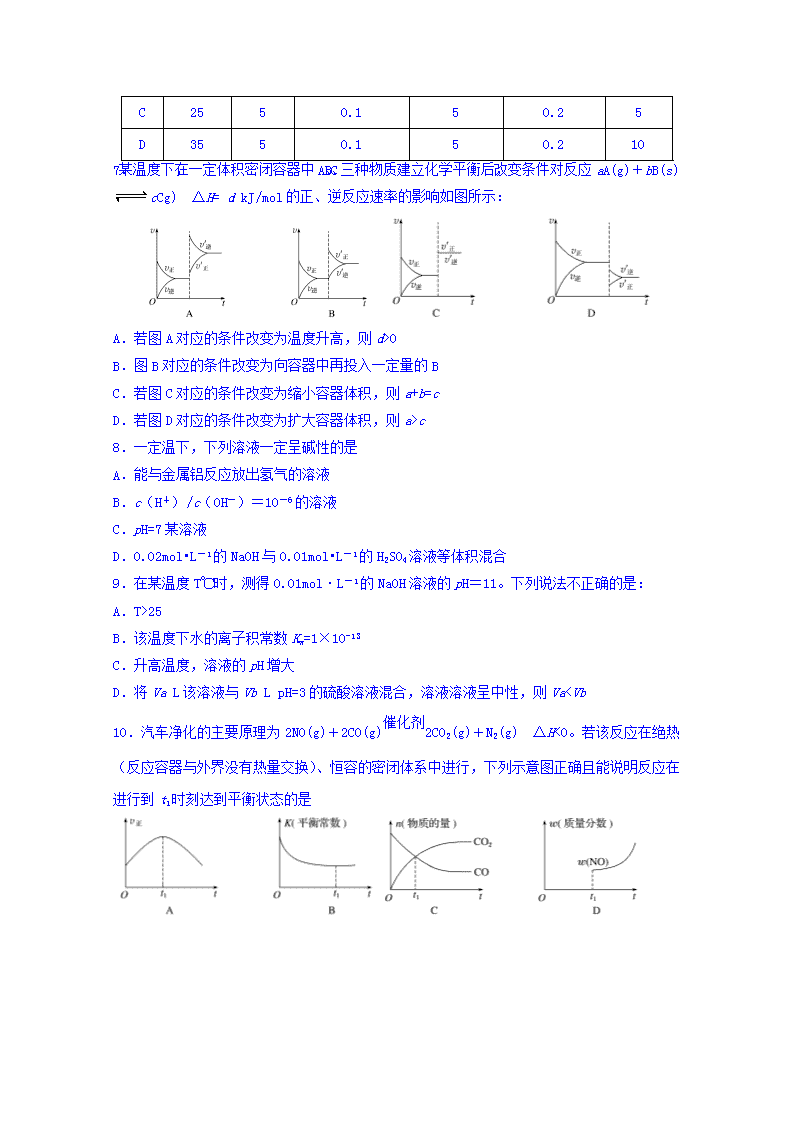
7.某温度下,在一定体积密闭容器中A、B、C三种物质建立化学平衡后,改变条件对反应aA(g)+bB(s) cCg) ΔH= d kJ/mol的正、逆反应速率的影响如图所示:
A.若图A对应的条件改变为温度升高,则d>0
B.图B对应的条件改变为向容器中再投入一定量的B
C.若图C对应的条件改变为缩小容器体积,则a+b=c
D.若图D对应的条件改变为扩大容器体积,则a>c
8.一定温下,下列溶液一定呈碱性的是
A.能与金属铝反应放出氢气的溶液
B.c(H+)/c(OH-)=10-6的溶液
C.pH=7某溶液
D.0.02mol•L-1的NaOH与0.01mol•L-1的H2SO4溶液等体积混合
9.在某温度T℃时,测得0.01mol·L-1的NaOH溶液的pH=11。下列说法不正确的是:
A.T>25
B.该温度下水的离子积常数Kw=1×10-13
C.升高温度,溶液的pH增大
D.将Va L该溶液与Vb L pH=3的硫酸溶液混合,溶液溶液呈中性,则Va
Ka(CH3COOH)
B.若将两溶液分别稀释至相等pH,所加水的体积V(HX)>V(CH3COOH)
C.若分别向两溶液中放入足量的锌粉,完全反应后,生成氢气的体积V(HX)>V(CH3COOH)
D.若X为第VIIA元素,则可以发生反应:Ag++X-=AgX
12.下列说法正确的是:
A.在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.恒温下进行的反应2NO2(g)N2O4(g)达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
C.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
D.常温下pH=2的盐酸中由H2O电离出的c(H+)=1.0×10-2mol·L-1
13.下列根据实验操作和现象所得出的结论正确的是
选 项
实验操作
实验现象
结 论
A
取两支试管分别加入等体积等浓度的稀硫酸和盐酸,分别在相同条件下与等量的铁粉反应
装有硫酸溶液的试管中生产氢气的速率快
SO42-对金属铁与酸的反应有促进作用
B
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体
HA放出的氢气反应速率快
酸性:HB > HA
C
向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中
产生白色浑浊
酸性:盐酸>碳酸>硅酸
D
取1mL0.1mol/LKI溶液,向其中加入5mL0.1mol/LFeCl3溶液及2mLCCl4溶液,振荡静置;取上层清液,加入少量KSCN溶液
有血红色物质生成
说明2Fe3++2I-=2Fe2++I2为可逆反应
14.下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
A.①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
15.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:PCl5(g)PCl3(g)+Cl2(g) △H=a kJ/mol(a>0)0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法不正确的是
A.0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B. 10min时改变的条件可以是容器体积扩大至4.0L
C.起始时向该容器中充入1.5mol PCl3和1.5molCl2,保持温度为T,反应达平衡时放出的热量大于1.2a kJ
D.温度为T,起始时向该容器中充入0.7mol PCl5、0.3mol PCl3和0.3molCl2,反应达到平衡前,v(正)”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正▲v逆(填“>”、“=”或“<”)。
(4) 500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO2(g)的浓度(mol·L-1)分别为0.2、0.1则:
(a)a=▲,b=▲,平衡时H2的转换率为▲
(b)若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比▲(填“增大”、“减小”或“不变”)
19.(16分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有▲
(2)硫酸铜溶液可以加快氢气生成速率的原因是▲
(3)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO44种溶液,可与上述实验中CuSO4溶液起相似作用的是▲。
(4)要加快上述实验中气体产生的速率,还可采取的措施有▲(答两种)。
(5)为了进一步探究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
实验
混合溶液
A
B
C
D
E
F
4mol·L-1H2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
①请完成此实验设计,其中:V1=▲,V6=▲,V9=▲。
②该同学最后得出的结论为当加入少量CuSO4溶液,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:▲
20.(16分)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH▲0(填“>”或“<”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(NO2)为▲mol·L-1·s-1;反应的平衡常数表达式为▲。
(2)100 ℃时达平衡后,改变反应温度为T,c (N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T▲100 ℃(填“>”或“<”),判断理由是▲
②列式计算温度T时反应的平衡常数K2▲(写出计算过程)
▲
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向▲(填“正反应”或“逆反应”)方向移动
21(14分)某实验小组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:一定条件下,向一个密闭容器中加入0.30 mol X、0.10 mol Y和一定量的Z三种气体,甲图表示发生反应后各物质浓度(c)随时间(t)的变化〔其中t0~t1阶段c(Z)未画出〕。乙图表示化学反应速率(v)随时间(t)的变化,四个阶段都只改变一种条件(催化剂、温度、浓度、压强,每次改变条件均不同),已知t3~t4阶段为使用催化剂。
回答下列问题:
(1)在t2~t3阶段Y的物质的量减小,则此阶段开始时v正▲(填“>”、“=”或“<”)v逆。
(2)t4~t5阶段改变的条件为▲,此阶段的平衡常数K=▲;该反应的化学方程式为▲。
(3)t5~t6阶段容器内Z的物质的量共增加0.10 mol,在反应中热量变化总量为a kJ,该反应的ΔH=▲kJ/mol(用含“a”的表达式表示);在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是▲。
(4)若起始实验条件不变,重新向该容器中加入0.60 mol X、0.20 mol Y和0.080 mol Z,反应至平衡状态后X的转化率=▲。
江苏省邗江中学2017-2018学年度第二学期
高二化学期中试卷(选修)
参考答案
选择题(1-10题每题2分;11-15题每题4分,少选2分,错选、多选0分)
1
2
3
4
5
6
7
8
9
10
D
C
B
B
A
D
A
B
C
B
11
12
13
14
15
A
C
B
AC
AB
非选择题
16(8分 每空2分)
(1)中 (2)H++SO42-+Ba2++OH-=BaSO4+H2O 碱 14+lg(a/2)
17(12分 每空2分)
(1)SO2+2OH-=SO32-+H2O (2)CD
(3)控制反应温度 对原料气进行净化(4)A x2/[2(1-x)3] (5)降低温度
18(14分 每空2分)
(1)K1×K2 (2)< (3)> (4)0.44 0.22 0.09 增大
19(16分 每空2分)
(1)Zn+CuSO4=ZnSO4+Cu Zn+H2SO4=ZnSO4+H2
(2)形成原电池 (3)FeSO4
(4)适当提高温度 适当提高硫酸浓度(其他合理答案也给分)
(5)30 10 17.5 生成过多的铜覆盖于锌表面,降低接触面积
20(16分 每空2分)
(1)> 0.02 K=c2(NO2)/c(N2O4)
(2)>
反应吸热,N2O4浓度减少,平衡正移所以温度升高(后10s反应的平均速率比前60s大) 1.28
解:Δc(N2O4) =0.002 mol/(L•s)×10s=0.020mol/L
N2O4(g) 2NO2(g)
平衡1 0.040 0.120
Δ 0.020 0.040
平衡2 0.020 0.160
K2=c2(NO2)/c(N2O4)=0.1602/0.020=1.28
(3)逆反应
21(14分 每空2分)
(1)< (2)减小压强 2.8 3X2Y+Z
(3)-10a V
(4)0.6(60%)