四川省棠湖中学2020届高三上学期期中考试化学试题
7.下列说法中正确的是
A.60﹪-70﹪的甲醛水溶液称为福尔马林具有防腐杀菌的效果
B.液溴可以加少量水保存在棕色的试剂瓶中
C.苯酚溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D.油脂不能使溴水褪色
8.下列化学用语正确的是
A.重水的分子式:D2O B.次氯酸的结构式:H—Cl—O
C.乙烯的实验式:C2H4 D.二氧化硅的分子式:SiO2
9.阿伏加德罗常数的值为NA。下列说法正确的是
A.标准状况下,11.2L12C18O中含有的中子数为8NA
B.常温常压下,12g金刚石中含有C-C键数为4NA
C.1mol Li2O、Na2O2的混合物中含有的离子总数大于3NA
D.25℃时,pH=2的H2SO4溶液中含有H+的数目为0.02NA
10.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作
现象
结论
A
滴加稀NaOH溶液,将红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
B
向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X 中一定含有SO42-
C
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
D
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
A.A B.B C.C D.D
11.X、Y、Z、W是原子序数依次增大的短周期元素。X的氢化物常用于刻蚀玻璃,Y在同周期中金属性最强,Z的单质是人类将太阳能转化为电能的常用材料,W与X同主族。下列说法正确的是
A.简单氢化物沸点:X>W B.简单离子半径:r(X)
c(B+) D.N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
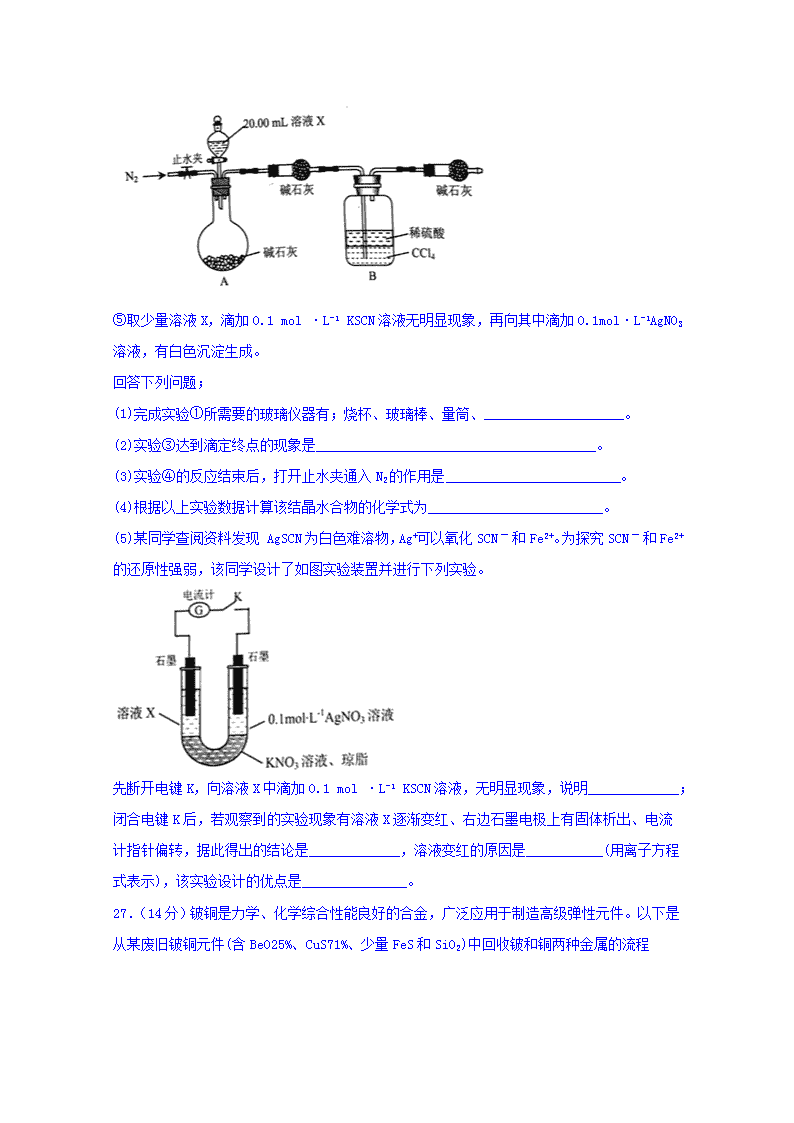
26.(14分)某结晶水合物含有CO32-、SO42-、SO32-、Fe2+、Fe3+、NH4+、Ba2+中的三种离子,实验小组为确定其化学式做了如下实验:
①准确称取6.125g样品,配制成250.00mL溶液X。
②取20.00mL溶液X,加入足量盐酸,无明显现象;再加足量BaCl2溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体0.5825g。
③取20.00mL溶液X,加入适量稀硫酸酸化后,用0.01000mol·L-1KMnO4溶液滴定至终点,重复滴定三次,测得消耗KMnO4溶液体积的平均值为25.00mL。
④设计如图所示的装置,取20.00mL溶液Ⅹ进行实验,实验前后B装置增重0.04250g。
⑤取少量溶液X,滴加0.1 mol ·L-1 KSCN溶液无明显现象,再向其中滴加0.1mol·L-1AgNO3溶液,有白色沉淀生成。
回答下列问题;
(1)完成实验①所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________________。
(2)实验③达到滴定终点的现象是________________________________________。
(3)实验④的反应结束后,打开止水夹通入N2的作用是_________________________。
(4)根据以上实验数据计算该结晶水合物的化学式为_________________________。
(5)某同学查阅资料发现 AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了如图实验装置并进行下列实验。
先断开电键K,向溶液X中滴加0.1 mol ·L-1 KSCN溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________(用离子方程式表示),该实验设计的优点是_______________。
27.(14分)铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
28.(15分)二氧化硫是大气的主要污染物之一。催化还原SO2不仅可以消除SO2的污染,还可以得到工业原料S。燃煤烟气中硫的回收反应为:2CO(g)+SO2(g) 2CO2(g)+S(l) △H。
(1)已知:2CO(g)+O2(g)===2CO2(g) △H1=-566.0kJ·mol-1
S(l)+O2(g)===SO2(g) △H2=-296.8 kJ·mol-1
则硫的回收反应的△H=___________ kJ·mol-1。
(2)其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图所示。
260℃时,___________(填“La2O3”、“NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是___________。
(3)一定条件下,若在恒压密闭容器中发生硫的回收反应,SO2的平衡转化率与温度、压强的关系如图所示,则P1、P2、P3、P4由大到小的顺序为___________;某温度下,若在恒容密闭容器中,初始时c(CO)=2 a mol·L-1,c(SO2)= a mol·L-1,SO2的平衡转化率为80%,则该温度下反应的化学平衡常数为___________。
(4)某实验小组为探究烟气流速、温度对该反应的影响,用La2O3作催化剂,分别在两种不同烟气流量、不同温度下进行实验。实验结果显示:在260℃时,SO2的转化率随烟气流量增大而减小,其原因是___________;在380℃时,SO2的转化率随烟气流量增大而增大,其原因是___________。
(5)工业上常用Na2SO3溶液吸收烟气中的SO2,将烟气通入1.0 mol·L-1的N2SO3溶液,当溶液pH约为6时,吸收SO2的能力显著下降此时溶液中c(HSO3-)c︰(SO32-)=___________。(已知H2SO3的Ka1=1.5×10-2、Ka2=1.0×10-7)
35.(15分)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是_______。其组成的三种元素中电负性较强的是 _______。
(2)下列基态原子或离子的价层电子排布图正确的______。
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是____,中心原子杂化类型为____,属于_______(填“极性”或“
非极性”)分子。
②X的沸点比水低的主要原因是___________。
(4)CuFeS2与氧气反应生成SO2,其结构式为,则SO2中共价键类型有_________。
(5)四方晶系CuFeS2晶胞结构如图所示。
①Cu+的配位数为__________,
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________g•cm3(列出计算式)。
36.(15分)已知高分子化合物I是轻工业生产的重要原料,其中一种生产合成路线如下:
已知:
回答下列问题:
(1)A为芳香烃,A的化学名称是______。
(2)G→H、H→I的反应类型分别是______、______。
(3)若G结构为
①请写出D的结构简式______。
②2由B生成C的化学方程式为__。
(4)C有多种同分异构体,其中属于酚类的同分异构体有_____种,写出其中具有四组核磁共振氢谱峰的一种结构简式_____。
(5)参考上述合成路线信息,写出以CH3-CH=CH2和CH3MgBr为原料(其它无机物任选)合成的合成路线图。_____
化学参考答案
7.B 8.A 9.A 10. C 11.A 12.A 13.C
26. 250mL容量瓶、胶头滴管 当最后一滴KMnO4标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化 使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收 (NH4)2Fe(SO4)2·6H2O 溶液中无Fe3+ Fe2+的还原性强于SCN- Fe3++3SCN-=Fe(SCN)3 氧化性、还原性离子不直接接触。避免发生沉淀反应而导致离子浓度降低
27. Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd 蒸发结晶时,向溶液中持续通入氯化氢气体 MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O 产生污染环境的气体(合理即可) Fe3+ 4 90%
28.-269.2 TiO2 La2O3在相对较低温度对催化效率更高 P1>P2>P3>P4 80/a mol/L 260℃时,催化剂活性不好,反应速率慢;烟气流速越大,气体和催化剂接触时间越短,SO2转化率越低 380℃时,催化剂活性好,反应速率快;烟气流速越大,压强越大,反应正向进行越彻底,SO2转化率越高 10
35.离子键 硫(S) CD V形 sp3 极性 水分子间存在氢键(答案合理即可) σ键和π键 4
36. 苯乙烯 消去反应 加聚反应 : 9 或