【化学】湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2019-2020学年高二11月联考试题(解析版)
湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2019-2020学年高二11月联考试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 C l35.5 Ba 137
第Ⅰ卷(共48分)
一、选择题:本卷共16小题,每小题3分,每小题的四个选项中只有一项符合题目要求。
1.据电视专题片《辉煌中国》透露:目前我国水电、风电和新能源汽车保有量均遥居世界前列,这标志着我国能源结构更趋完善。下列有关能源的叙述不正确的是( )
A. 化石燃料是不可再生能源 B. 生物质能是可再生能源
C. 天然气是新型能源 D. 氢能是清洁能源
【答案】C
【解析】
【详解】A、化石燃料是由远古时期的动植物转化而来,短期内不能再生,故为不可再生能源,故A不符合题意;
B、生物质能是自然界中有生命的植物提供的能量,这些植物以生物质作为媒介储存太阳能,属再生能源,故B不符合题意;
C、天然气是指天然蕴藏于地层中的烃类和非烃类气体的混合物,属于传统能源,故C符合题意;
D、氢能燃烧后生成水,对环境没有污染,属于清洁能源,故D不符合题意;
故选C。
2.下列用品的有效成分及用途对应错误的是( )
选项
A
B
C
D
用品
食盐
小苏打
复方氢氧化铝片
漂白粉
有效成分
NaCl
Na2CO3
Al(OH)3
Ca(ClO)2
用途
做调味品
做发酵粉
做抗酸药
做消毒剂
【答案】B
【解析】A、食盐是最常用的家用调味品,其有效成分是NaCl,A正确。B、小苏打有效成分是NaHCO3,可以做发酵粉,B错误。C复方氢氧化铝片有效成分是Al(OH)3
,常用于治疗胃酸过多,C正确。漂白粉的有效成分是Ca(ClO)2,可以用做消毒剂和漂白剂,D正确。本题选择错误选项,所以正确答案为B。
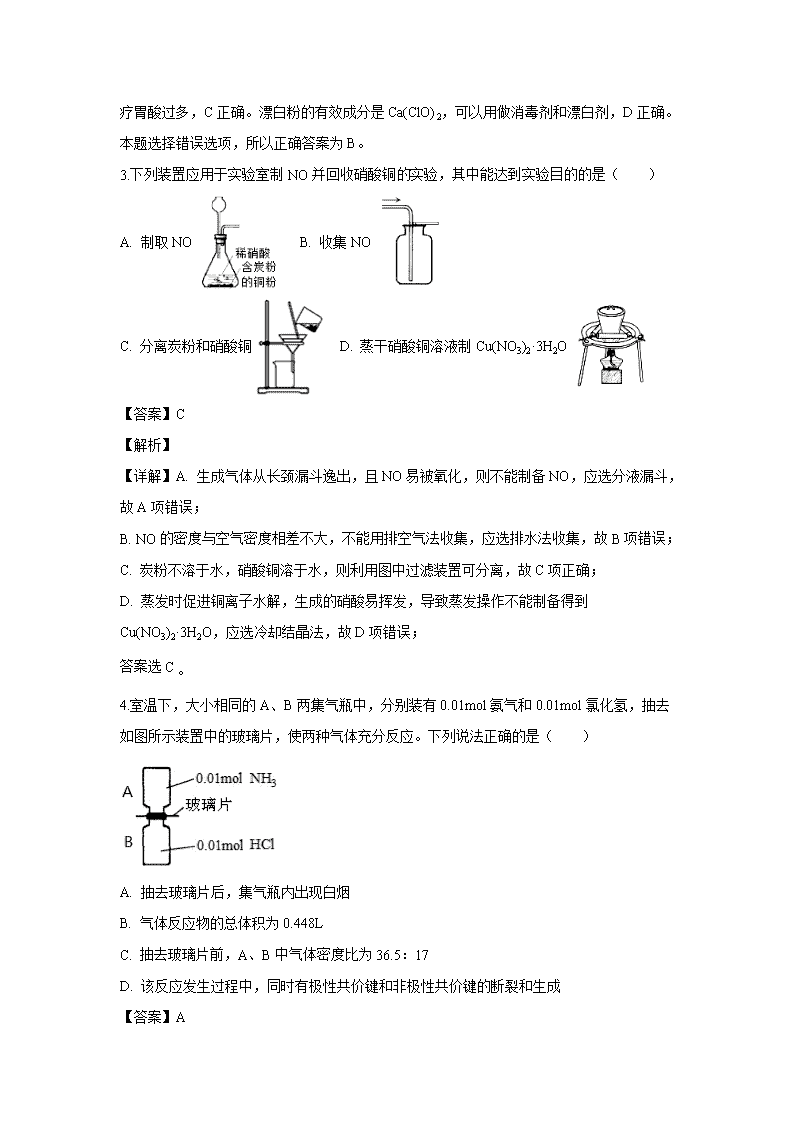
3.下列装置应用于实验室制NO并回收硝酸铜实验,其中能达到实验目的的是( )
A. 制取NO B. 收集NO
C. 分离炭粉和硝酸铜 D. 蒸干硝酸铜溶液制Cu(NO3)2·3H2O
【答案】C
【解析】
【详解】A. 生成气体从长颈漏斗逸出,且NO易被氧化,则不能制备NO,应选分液漏斗,故A项错误;
B. NO的密度与空气密度相差不大,不能用排空气法收集,应选排水法收集,故B项错误;
C. 炭粉不溶于水,硝酸铜溶于水,则利用图中过滤装置可分离,故C项正确;
D. 蒸发时促进铜离子水解,生成的硝酸易挥发,导致蒸发操作不能制备得到Cu(NO3)2·3H2O,应选冷却结晶法,故D项错误;
答案选C
4.室温下,大小相同的A、B两集气瓶中,分别装有0.01mol氨气和0.01mol氯化氢,抽去如图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是( )
A. 抽去玻璃片后,集气瓶内出现白烟
B. 气体反应物的总体积为0.448L
C. 抽去玻璃片前,A、B中气体密度比为36.5:17
D. 该反应发生过程中,同时有极性共价键和非极性共价键的断裂和生成
【答案】A
【解析】
【详解】A、当玻璃片抽走后,NH3与HCl混合发生反应:NH3+HCl=NH4Cl,生成物NH4Cl呈晶体状,可观察到集气瓶内出现白烟,A项正确;
B、题干并未告知是否为标准状况,无法使用Vm=22.4L/mol计算气体体积,故B错误;
C、两容器体积相同,容器内气体物质的量相同,其密度,故A、B中气体密度比为17:36.5,故C错误;
D、该反应过程中没有非极性共价键断裂,故D错误;
故选A。
5.向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸至过量,关于该过程下列说法正确的是( )
A. Ba(OH)2、稀硫酸均为强电解质
B. C处刻恰好完全中和,反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O
C. B处溶液的导电能力约为0,说明溶液中此时几乎没有自由移动的离子
D. 向NaHSO4溶液中加入过量Ba(OH)2溶液,也能得到与如图完全相同的导电能力变化图像
【答案】C
【解析】
【详解】A、Ba(OH)2是强碱,属于强电解质,而稀硫酸是混合物,不属于电解质,故A错误;
B、在滴加过程中,只有一个离子反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,溶液中可自由移动离子逐渐减小,反应恰好完全反应时,溶液导电能力几乎为0,即B处恰好完全中和,故B错误;
C、溶液导电能力与溶液中可自由移动的电荷浓度有关,B点溶液导电能力约为0,由此可知溶液中几乎没有自由移动的离子,故C正确;
D、向NaHSO4溶液中加入过量Ba(OH)2溶液,反应方程式为:Ba(OH)2+ NaHSO4═BaSO4↓+NaOH+H2O,溶液导电能力先下降后上升,但溶液的导电能力不会为0,因为沉淀刚好完全时,溶液中有Na+和OH-,故D错误;
故选C。
6.下列关于反应热的叙述中不正确的是( )
A. 化学反应从能量变化角度,可以分为吸热反应和放热反应
B. 需要加热才能发生的反应不一定是吸热反应
C. 其它操作不变时,分别在光照和点燃条件下测定H2(g)+Cl2(g)=2HCl(g)的反应热,△H相同
D. 等质量的硫蒸气和硫磺固体分别完全燃烧,后者放出的热量多
【答案】D
【解析】
【详解】A、化学反应涉及到化学键的断裂和形成,反应前后的化学键不完全相同,故在同一条件下物质的能量不相同,故从能量变化角度,可以分为吸热反应和放热反应,A项不符合题意;
B、化学反应为放热反应还是吸热反应与是否需要加热无关,如燃烧反应需要加热才能发生,但其属于放热反应,故B不符合题意;
C、某一指定反应的焓变与化学反应条件无关,故C不符合题意;
D、硫蒸汽所含能量比硫固体多,定量燃烧时,硫蒸汽放热多,故D符合题意;
综上所述,答案为D。
7.下列说法中正确的是( )
A. 原电池放电过程中,负极的质量一定减轻,正极的质量一定增加
B. Fe、Cu组成原电池,Fe一定是负极
C. 充电电池可以使放电时的氧化还原反应逆向进行,能无限制的反复放电、充电
D. 某海水电池总反应表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,则负极反应式为:Ag-e-+Cl-=AgCl
【答案】D
【解析】
【详解】A、燃料电池形成的原电池放电过程中,两个电极上都是通入的气体发生电极反应,正负极质量不变,故A错误;
B、Fe、Cu组成原电池,根据易失去电子的作负极,在Fe、Cu浓硝酸组成原电池中铁先作负极失去电子并生成致密氧化膜,导致铁难以再失去电子,此时相较于铁电极,铜更易失去电子,铜为负极,若外电路中连接灵敏电流计,可观察到指针偏转方向发生改变,故B错误;
C、充电电池在充放电过程中因材料老化或者转化不完全等因素,导致充电电池有一定的使用年限,不能无限制地反复放电、充电,故C错误;
D、Ag元素的化合价由0价升高为+1,则负极反应式:Ag−e−+Cl−=AgCl,故D正确;
故选D。
8.如图所示,烧杯中盛有水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住使之平衡。小心向烧杯中滴加少量CuSO4溶液,反应一段时间。下列有关说法不正确的是( )
A. 两圈摇摆不定
B. 铁圈不断腐蚀
C. 银圈上慢慢看到有红色物质覆盖
D. 利用该原理,可以设计原电池装置,将化学能转化为电能
【答案】A
【解析】
【分析】向烧杯中滴加少量CuSO4溶液后,该装置构成了原电池,较活泼的金属铁作负极,相对不活泼的金属银作正极,以此分析本题。
【详解】A、向烧杯中滴加少量CuSO4溶液后,装置构成了原电池,负极上铁失去电子生成亚铁离子进入溶液中,导致铁圈质量减少,正极上铜离子得到电子生成铜单质,导致银圈质量增加,因此反应一段时间后,铁圈质量小于银圈质量,银圈向下倾斜,故A符合题意;
B、铁圈作负极,失去电子生成亚铁离子,铁圈质量不断减小,故B不符合题意;
C、银圈作正极,铜离子得到电子生成红色铜单质附着在银圈上,故C不符合题意;
D、该装置具备原电池基本构成条件,可设计成原电池,将化学能转化为电能,故D不符合题意;
故选A。
9.向一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下发生反应:H2(g)+I2(g)2HI(g)△H<0,一段时间后达到平衡。下列说法不正确的是( )
A. 保持容器体积不变,继续向其中加入1mol H2,平衡正向移动
B. 保持容器体积不变,继续向其中加入1mol N2(N2不参加反应),化学反应速率不变
C. 保持容器压强不变,继续向其中加入2mol HI,H2的体积分数不变
D. 提高起始反应温度,正反应速率减慢,逆反应速率加快,平衡逆向移动
【答案】D
【解析】
【分析】在恒定温度下,反应速率的影响因素取决于浓度和压强,浓度越大,反应速率越大,如通入惰性气体,参加反应的物质的浓度不变,则反应速率不变,如压强不变,通入惰性气体,但体积增大,反应物的浓度减小,则反应速率减小,以此解答该题。
【详解】A、保持容器体积不变,继续向其中加入1mol H2,导致容器内H2浓度增加,正反应速率加快,加入那一瞬间逆反应速率不变,故平衡正向移动,故A不符合题意;
B、保持容器体积不变,继续向其中加入1mol N2(N2不参加反应),参加反应的物质浓度不变,其正逆反应速率不变,故B不符合题意;
C、保持容器压强不变,继续向其中加入2mol HI,可通过建模分析: 1容器为原平衡,将2mol HI加入到2容器内,起始保持压强与1容器内一致,2容器内反应平衡与1完全等效,此时抽出中间隔板,两容器内平衡不变,H2的体积分数不变,故C不符合题意;
D、升高温度,正逆反应速率均加快;该反应正向为放热反应,升高温度,根据勒夏特列原理可知,平衡将会向着吸热方向移动,即平衡逆向移动,故D符合题意;
故选D。
10.某恒容密闭容器中充入1molPCl5气体,发生反应:PCl5(g)PCl3(g)+Cl2(g) △H<0。仅改变某一条件,该平衡由状态I移动到状态II,变化曲线如图所示。可能改变的条件是( )
A. 继续通入1mol PCl5气体 B. 继续通入1mol PCl3气体
C. 升高 D. 加入催化剂
【答案】B
【解析】
【详解】根据图像前后变化的连接点(如图)进行分析:(1)改变条件那一瞬间正反应速率不变,逆反应速率上升,由此可知改变的是反应中生成物浓度;(2)再根据改变条件后v正
Cl-,故B不符合题意;
C、实验3中②中溶液中的浓硫酸和溴都能将碘化钠氧化生成碘,不能判断还原性:I->Br-,故C符合题意;
D、实验2中体现了浓H2SO4的强氧化性,实验1中体现了浓H2SO4的难挥发性,故D不符合题意;
故选C。
16.某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+
。为减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属Cu。根据流程图,下列说法不正确的是( )
A. ①②操作均为过滤,但D、E溶液成分不完全相同
B. C可以为稀硫酸,也可以是稀盐酸
C. 操作③采用冷却结晶,说明硫酸亚铁晶体的溶解度随温度变化有一定变化
D. A为足量铁粉,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu
【答案】B
【解析】
【分析】工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,试剂A为Fe,操作①为过滤,则E中主要含硫酸亚铁,B中含Cu、Fe,加入试剂C为H2SO4,操作②为过滤,得到Cu,D中主要含FeSO4,操作③为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,以此解答该题。
【详解】A、由上述分析①②操作均为过滤,E中主要为FeSO4,含有少量的Na+,D溶液中主要含FeSO4,还含有少量的H2SO4,成分不完全相同,故A不符合题意;
B、因最终制备物质为FeSO4.7H2O,若加入的C物质为稀盐酸,则会导致制备物质纯度较低,故加入的物质C只能为稀硫酸,故B符合题意;
C、冷却结晶的原理是是根据物质在不同温度下溶解度不同(一般是高温下溶解度大,低温时溶解度小),而分离或提纯固体物质的一种方法,由此可知硫酸亚铁晶体的溶解度随温度变化有一定变化,故C不符合题意;
D、由上述分析可知,试剂A为铁粉,工业废水中含有Cu2+,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu,故D不符合题意;
故选B。
第Ⅱ卷(共52分)
二、非选择题
17.请综合运用所学知识,填写下列空白:
(1)①中和热测定实验中,除了烧杯、温度计、泡沫塑料、泡沫塑料板外,还需要使用的仪器有_____。
②下列关于中和热的说法正确的是______
A.用稀硫酸和Ba(OH)2溶液代替盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸溶液的温度后,用蒸馏水洗净再测NaOH溶液温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
(2)①某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含任意数目的中间步骤)连接如图所示,则△H1+△H2=______。
②已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______。
(3)①用如图所示装置,在一定条件下讨论锌与稀硫酸的反应速率时,采用一些方法测定了下列物理量,其中可以用于表示(或计算)其化学反应速率的是______
A.收集10mL H2所用的时间 B.一定时间内收集H2的体积
C.一定时间内溶液中H+的浓度变化 D.一定时间内锌粒质量的变化
E.一定时间内反应热量的变化
②为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2的总量,下列措施可行的是_____
A加入少量CuSO4溶液 B.对反应液适当加热
C.将稀硫酸换成浓硫酸 D.将锌粒换成锌粉
(4)反应a M(g)+a N(g)b W(g)+c
Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
开始时
平衡时
容器1
2mol M
1mol N
总压P1
0.5mol W
容器2
1mol M
2mol N
总压P2
x mol W
则x=____,P1_____P2(填“>”、“<”或“=”)。
【答案】(1). 量筒、环形玻璃搅拌棒 (2). C (3). 0 (4). -488.3kJ/mol (5). ABCDE (6). BD (7). 0.5 (8). =
【解析】
【详解】(1)①由中和热测定实验所需仪器可知,还需要量筒以及环形玻璃搅拌棒;
②A、稀硫酸和 Ba(OH)2溶液反应生成物中含有难溶性的BaSO4沉淀,所放出的热量相较盐酸与 NaOH溶液反应多,测出的中和热数据不一样,故A错误;
B、酸碱中和的速率非常快,若缓慢加入,会导致热量有所散失,酸碱中和放出的热量不能全部作用于加热溶液,导致所测的数据不准确,故B错误;
C、若不用蒸馏水洗净温度计,当温度计放入NaOH 溶液时,温度计上的盐酸会与NaOH 反应,导致所测氢氧化钠溶液温度不准确,故C准确;
D、为了保证酸完全中和,一般需要碱稍过量,故D错误;
(2)①始态S经过一系列反应再回到始态S,物质本身本身未发生改变,根据盖斯定律可知,其热效应△H1+△H2=0;
②令C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol I
H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ/mol II
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H3=-870.3kJ/mol III
根据盖斯定律可知,2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=△H1×2+△H2×2-△H3=-488.3 kJ/mol;
(3)①单位时间内相关物理量的变化快慢可表示化学反应速率快慢,ABCDE所对应的物理量均是变量,由此可知,ABCDE所描述物理量均可用于表示(或计算)其化学反应速率,故答案为:ABCDE;
②A、加入少量 CuSO4溶液,因氧化性Cu2+>H+,溶液中Zn与Cu2+反应会消耗少量的Zn,导致H2的量减少,不符合题意;
B、加热可加快化学反应速率,溶液中相关微粒数量不会改变,故生成H2的量不变,符合题意;
C、浓硫酸与Zn反应不会生成H2,不符合题意;
D、将锌粒换成锌粉,固体接触面积增大,化学反应速率加快,生成H2的量不变,符合题意;故答案为BD;
(4)反应中M、N的系数相同,由表格数据分析可知,容器1与容器2完全等效,故x=0.5;P1=P2。
18.中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,在元素周期表中的位置是________。
(2)N元素非金属性比As强,下列说法正确的是_______
①热稳定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半径:N<As
(3)请依据如图信息写出As2O5分解为As2O3的热化学方程式_______。
(4)查阅文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如图:
已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的离子方程式为_______。
③过程Ⅲ得到纯净As2O3固体系列操作包括_____、_____、_____。
④过程Ⅲ中,其它条件相同时仅改变溶液pH,发现酸性越强,As2O3
的产率越高,可能的原因是_______。
【答案】(1). 第四周期VA族 (2). ②③ (3). As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJ/mol (4). 不是 (5). 2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O (6). 过滤 (7). 洗涤 (8). 干燥 (9). 酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度,反应速率加快或者增加氢离子浓度,平衡正向移动促进反应的进行,有利于提高As2O3的产率
【解析】
【分析】(1)As的原子结构示意图为:,有4个电子层,最外层有5个电子,与N同族,故位于第四周期V A族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,As电子层数比N多2,非金属性N>As;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,由图可知:△H+|△H1|=|△H2|,据此计算;
(4)碱浸过程中没有元素化合价的变化,过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,烘干,发生反应的离子方程式为2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O,酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率。
【详解】(1)As的原子结构示意图有4个电子层,最外层有5个电子,位于第四周期,V A族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,非金属性N>As,①NH3的热稳定性比AsH3好,②HNO3的酸性比H3AsO4强,③As电子层数比N多2,N的原子半径比As的原子半径小,故答案为:②③;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,由图可知:△H+|△H1|=|△H2|,△H=|△H2|−|△H1|==914.6kJ/mol−619.2kJ/mol= +295.4kJ/mol,故该反应的热化学方程式为:As2O5(s)==As2O3(s)+O2(g) △H= +295.4kJ/mol;
(4)①碱浸过程中没有元素化合价的变化,故该反应不是氧化还原反应;
②过程Ⅲ发生反应的离子方程式为2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
③过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,干燥;
④酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度,反应速率加快或者增加氢离子浓度,平衡正向移动促进反应的进行,有利于提高As2O3的产率。
19.某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:
(1)根据实验数据可知,该反应在0~4min的平均反应速率v(Cl-)=______mol/(L·min)。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。
i.探究化学反应速率增大的影响因素:
已知:ClO3-+3HSO3-=Cl-+3SO42-+3H+
方案
假设
具体实验操作
Ⅰ
该反应放热,使溶液温度升高,反应速率加快
向烧杯中依次加入10mL 0.1mol/L KClO3溶液和10mL 0.3mol/L NaHSO3溶液,______。
Ⅱ
反应产物Cl-对反应有催化作用
取10mL 0.1mol/L KClO3溶液于烧杯中,先加入_____固体(填化学式),再加入10mL 0.3mol/L NaHSO3溶液。
Ⅲ
反应中溶液酸性增强,加快了化 学反应速率
分别向2个烧杯中加入10mL 0.1mol/L KClO3溶液, 烧杯①:加入1mL水烧杯②:加入1mL 0.2mol/L盐酸再分别向烧杯中加入10mL 0.3mol/L NaHSO3溶液。
【问题与思考】
①方案Ⅲ烧杯①中加入1mL水的作用是______。
②在证明方案Ⅰ假设不成立的情况下,从控制变量角度思考,方案III实验操作设计不严谨,改进措施为______。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设_______。
ii.反应后期,化学反应速率降低的主要原因是______。
【答案】(1). 2.5×10-3 (2). 插入温度计 (3). KCl或者NaCl (4). 空白实验,消除由于体积变化带来的实验影响 (5). 将1mL水改为1mL0.2mol/L的KCl溶液(或NaCl溶液) (6). 反应产物SO42-对反应有催化作用(或生成了SO42-加快了化学反应速率) (7). 随着反应进行,反应物浓度降低,反应速率减慢
【解析】
【分析】(1)根据v=△c/△t计算;
(2)利用温度计测量溶液温度的变化;根据方案I、Ⅱ所对应的假设的变化分析;根据反应后溶液中的离子成分分析解答;根据氯离子可能会影响反应速率分析;根据浓度对反应速率的影响分析;
【详解】(1)根据实验数据可知,该反应在0~4min内生成氯离子的浓度是0.010mol/L,所以平均反应速率v(Cl-)=0.010mol/L÷4min=2.5×10-3mol/(L·min);
(2)①由于是假设该反应放热,使溶液温度升高,反应速率加快,因此需要测量反应过程中溶液温度的变化,则方案I中的实验操作为插入温度计;
②方案I、Ⅱ相比较Ⅱ探究反应产物Cl-对反应有催化作用,所以方案Ⅱ中的应加入Cl-,可加入KCl或者NaCl;
③由于反应中还有硫酸根离子生成,则除I、Ⅱ、Ⅲ中的假设外,还可以提出的假设是生成的硫酸根离子加快了化学反应速率;
④为防止氯离子对实验的干扰,则需要改进的措施是将1mL水改为1mL 0.2mol/L NaCl溶液;
⑤反应后期由于反应物浓度减小,因此化学反应速率变慢。
20.科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)2NH3
(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K
303
313
323
NH3的生成量/(10-6mol)
4.8
5.9
6.0
(1)此合成反应的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g)2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______。
【答案】(1). AC (2). 1.1 (3). C (4). 向逆反应方向移动 (5). > (6). > (7). (8). 2NH3-6e-+6OH-==N2+6H2O
【解析】
【详解】Ⅰ、(1)A、该反应中所有物质均为气体,故气体的质量不变,该反应为气体非等体积反应,由可知,随着反应的进行,容器内气体的平均摩尔质量是变量,当容器内气体的平均摩尔质量不变时,可说明该反应达到了化学平衡,故A正确;
B、2v(NH3)正=v(N2)逆的比例不满足物质所对应系数比,当等式成立时,不能说明该反应达到了化学平衡,故B错误;
C、该反应在恒容容器中进行,气体物质的量之比等于其压强之比,因该反应为气体非等体积反应,随着反应的进行,气体物质的量会发生改变,当容器内气体的压强保持不变时,可说明该反应达到了化学平衡,故C正确;
D、因缺少相关数据,当容器内N2、H2、NH3 的物质的量之比为
1:2:3时,反应不一定达到了化学平衡,故D错误;
(2)①由反应 N2(g)+3H2(g)2NH3(g)
起始浓度(mol/L) 0.4 0.8 0
转化浓度(mol/L) x 3x 2x
平衡浓度(mol/L) 0.4-x 0.8-3x 2x
平衡时NH3的体积分数为=0.2,解得x=0.1,
平衡常数K==1.1;
A、氢气的转化率与氮气、氢气的投入量等有关,K值大,氢气转化率不一定高,故A错误;
B、氨气的产率与与氮气、氢气的投入量等有关,K值大,氨气的产量不一定大,故B错误;
C、K值越大,表示反应进行程度大,即正反应进行得越完全,故C正确;
D、K值越大,表示反应进行程度大,但该温度下不一定反应发生,反应速率不一定大,故D错误;
故选C;
②向该容器中充入0.40molN2和0.40molNH3瞬间,c(N2)=0.5mol/L,c(NH3)=0.4mol/L,c(H2)=0.5mol/L,,浓度熵QC==2.56>K,故平衡将向逆反应方向移动;
Ⅱ、(1)由表格可知,升高温度,平衡正向移动,根据勒夏特列原理,升高温度,平衡将向吸热方向移动,故该反应正向为吸热反应,a>0;因气体混乱程度大于气体,该反应正向为熵增反应,故ΔS>0;
(2)①N2(g)+3H2(g)2NH3(g) K1
②2H2(g)+O2(g)=2H2O(l) K2
①-×②可得N2(g)+3H2O(1)=2NH3(g)+O2(g),故K=;
III、原电池的负极发生氧化反应,元素化合价升高,由此可知负极上NH3失去电子生成N2,该反应电解质为碱性,根据电荷守恒进行配平可知该燃料电池的负极反应式是:2NH3-6e-+6OH-=N2+6H2O。