- 2021-07-06 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国版2021高考化学一轮复习题型突破4元素“位-构-性”的综合推断课件
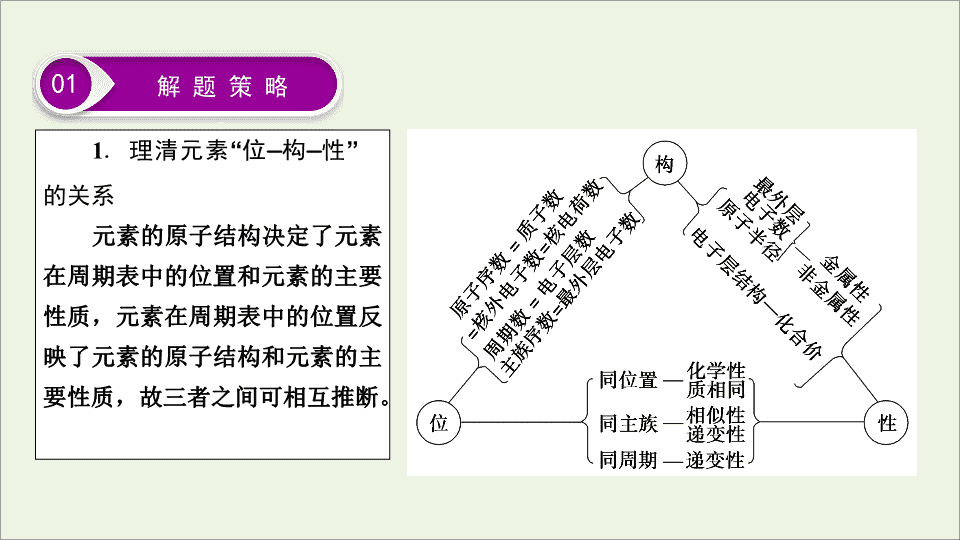
物质结构 元素周期律 第五章 题型突破 4 元素“位 — 构 — 性”的综合推断 元素周期律和元素周期表是高考考查的热点和重点,在近三年的全国卷、江苏卷和天津卷中都是命题的重点,主要以选择题的形式考查元素在周期表中的位置、原子结构、元素性质的关系及相互推断,同时也渗透着元素化合物知识的考查,该类题目命题形式和命题角度灵活多变,能够很好地考查学生综合分析问题和解决问题的能力,复习备考中要引起高度的重视。 1 . 理清元素 “ 位 — 构 — 性 ” 的关系 元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。 01 解 题 策 略 2 . 掌握三个解题要领 (1) 结构与位置互推是解题的核心 ①掌握四个关系式: a. 电子层数=周期数; b. 质子数=原子序数; c. 最外层电子数=主族序数; d. 主族元素的最高正价=主族序数 (O 、 F 除外 ) ,负价=主族序数- 8 。 ②熟练掌握周期表的结构及周期表中的一些特殊规律: a . “ 凹 ” 型结构的 “ 三短三长一不全,七主七副八零完 ” ; b. 各周期元素种类; c. 稀有气体的原子序数及在周期表中的位置; d. 同主族上下相邻元素原子序数的关系。 (2) 性质与位置互推是解题的关键 熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括: ① 元素的金属性、非金属性; ② 气态氢化物的稳定性; ③ 最高价氧化物对应水化物的酸碱性; ④ 金属与水或酸反应置换 H 2 的难易程度。 (3) 结构和性质的互推是解题的要素 ① 电子层数和最外层电子数决定元素原子的金属性和非金属性; ② 同主族元素最外层电子数相同,化学性质相似; ③ 正确推断原子半径和离子半径的大小及结构特点; ④ 判断元素金属性和非金属性的强弱。 3 . 熟悉常见元素推断的 “ 突破口 ” (1) 常考短周期元素及其主要化合物的特性 ①形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素: C 。 ②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素: N 。 ③地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素: O 。 ④等物质的量的单质最轻的元素: H ;等物质的量的最轻的金属单质; Li 。 ⑤最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素: Al 。 ⑥元素的单质在常温下能与水反应放出气体的短周期元素: Li 、 Na 、 F 。 ⑦ 具有漂白性的物质:氯水、二氧化硫、过氧化钠、双氧水 (H 2 O 2 ) ⑧ 最高正价与最低负价代数和为零的短周期元素: H 、 C 、 Si 。 ⑨最高正价是最低负价绝对值 3 倍的短周期元素: S 。 ⑩原子半径最小的是 H ,短周期元素原子半径最大的是 Na 。 ⑪没有正化合价的主族元素: O 、 F 。 (2) 周期表中特殊位置的元素 (1 ~ 20 号元素 ) 。 ①族序数等于周期数的元素: H 、 Be 、 Al 。 ②族序数等于周期数 2 倍的元素: C 、 S 。 ③族序数等于周期数 3 倍的元素: O 。 ④周期数是族序数 2 倍的元素: Li 、 Ca 。 ⑤周期数是族序数 3 倍的元素: Na 。 02 真 题 示 例 1 . (2018 · 全国卷 Ⅰ , 12) 主族元素 W 、 X 、 Y 、 Z 的原子序数依次增加,且均不大于 20 。 W 、 X 、 Z 最外层电子数之和为 10 ; W 与 Y 同族; W 与 Z 形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是 ( ) A .常温常压下 X 的单质为气态 B . Z 的氢化物为离子化合物 C . Y 和 Z 形成的化合物的水溶液呈碱性 D . W 与 Y 具有相同的最高化合价 B 解析 可腐蚀玻璃的物质是 HF 。以此为切入点,根据题意进行元素推断,可知 W 是氟、 X 是钠、 Y 是氯、 Z 是钙。 B 对:钙是活泼金属元素,氢是非金属元素, CaH 2 是由 Ca 2 + 和 H - 构成的离子化合物。 A 错:常温常压下,钠的单质是固体。 C 错: CaCl 2 是强酸强碱盐,水溶液呈中性。 D 错:氯有最高化合价+ 7 ,氟没有正价。 2 . (2018 · 全国卷 Ⅱ , 10) W 、 X 、 Y 和 Z 为原子序数依次增大的四种短周期元素。 W 与 X 可生成一种红棕色有刺激性气味的气体; Y 的周期数是族序数的 3 倍; Z 原子最外层的电子数与 W 的电子总数相同。下列叙述正确的是 ( ) A . X 与其他三种元素均可形成两种或两种以上的二元化合物 B . Y 与其他三种元素分别形成的化合物中只含有离子键 C .四种元素的简单离子具有相同的电子层结构 D . W 的氧化物对应的水化物均为强酸 A 解析 W 、 X 、 Y 、 Z 四种元素原子序数依次增大且为短周期元素,由 W 与 X 可生成一种红棕色有刺激性气味的气体可知, W 为 N , X 为 O ;由 Y 的周期数是族序数的 3 倍可知, Y 为 Na ;由 Z 原子最外层的电子数与 W 的电子总数相同可知, Z 最外层有 7 个电子, Z 为 Cl 。 A 对: O 与 N 可形成 NO 、 NO 2 、 N 2 O 3 等, O 与 Na 可形成 Na 2 O 、 Na 2 O 2 , O 与 Cl 可形成 Cl 2 O 、 ClO 2 、 Cl 2 O 7 等。 B 错: Na 2 O 2 中含有共价键。 C 错: Cl - 比 N 3 - 、 O 2 - 、 Na + 多一个电子层。 D 错: W 的氧化物中, N 2 O 3 对应的水化物 HNO 2 是弱酸。 3 . (2018 · 全国卷 Ⅲ , 13) W 、 X 、 Y 、 Z 均为短周期元素且原子序数依次增大,元素 X 和 Z 同族。盐 YZW 与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含 YZW 的溶液。下列说法正确的是 ( ) A .原子半径大小为 W < X < Y < Z B . X 的氢化物水溶液酸性强于 Z 的 C . Y 2 W 2 与 ZW 2 均含有非极性共价键 D .标准状况下 W 的单质状态与 X 的相同 D 解析 根据原子序数 W < X < Y < Z ,盐 YZW 与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含 YZW 的溶液,可知 W 是氧、 Y 是钠、 Z 是氯。 X 和 Z 同族,则 X 是氟。 D 对:标准状况下, O 2 、 O 3 与 F 2 均为气体。 A 错:原子半径大小应为 X < W < Z < Y ,即 F < O < Cl < Na 。 B 错: HF 是弱酸, HCl 是强酸。 C 错: Na 2 O 2 含非极性共价键, ClO 2 不含非极性共价键。 03 即 时 训 练 1. [ 根据性质推断 ] 短周期元素 W 、 X 、 Y 、 Z 的原子序数依次增加。 m 、 p 、 r 是由这些元素组成的二元化合物, n 是元素 Z 的单质,通常为黄绿色气体, q 的水溶液具有漂白性, 0.01 mol · L - 1 r 溶液的 pH 为 2 , s 通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( ) A .原子半径的大小 W查看更多