- 2021-07-06 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国卷I2020届高考化学模拟试卷精编五
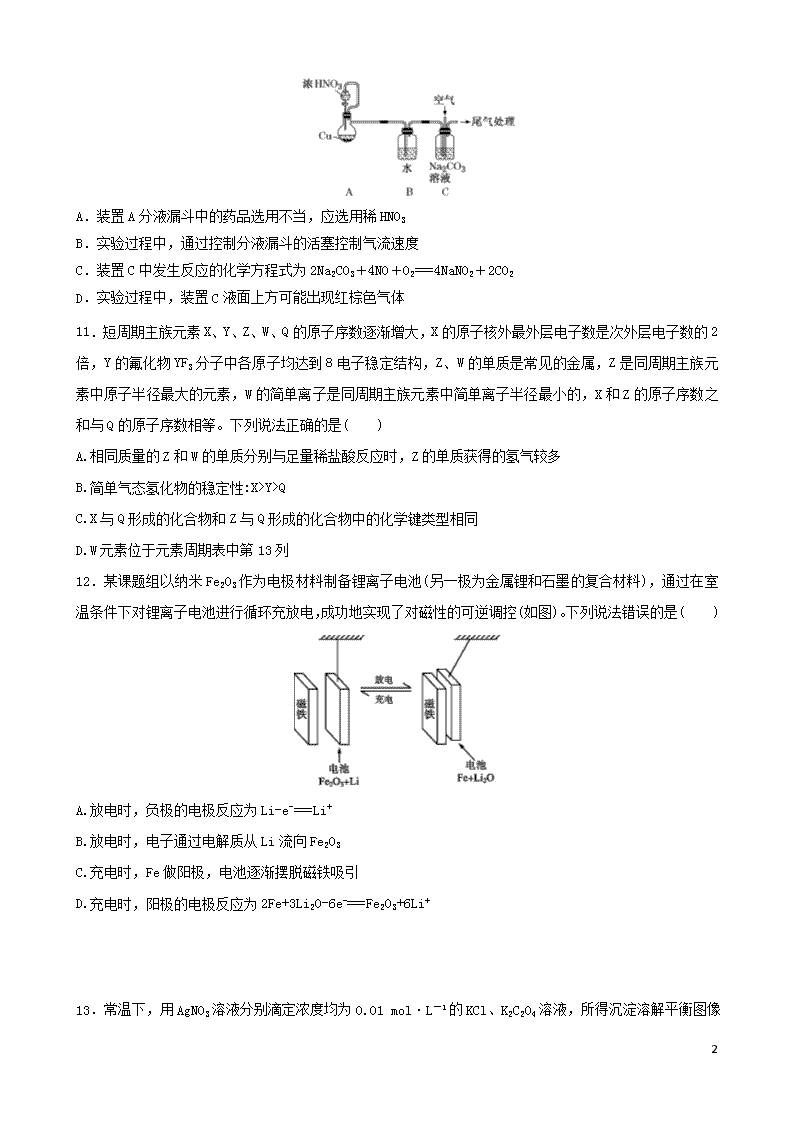
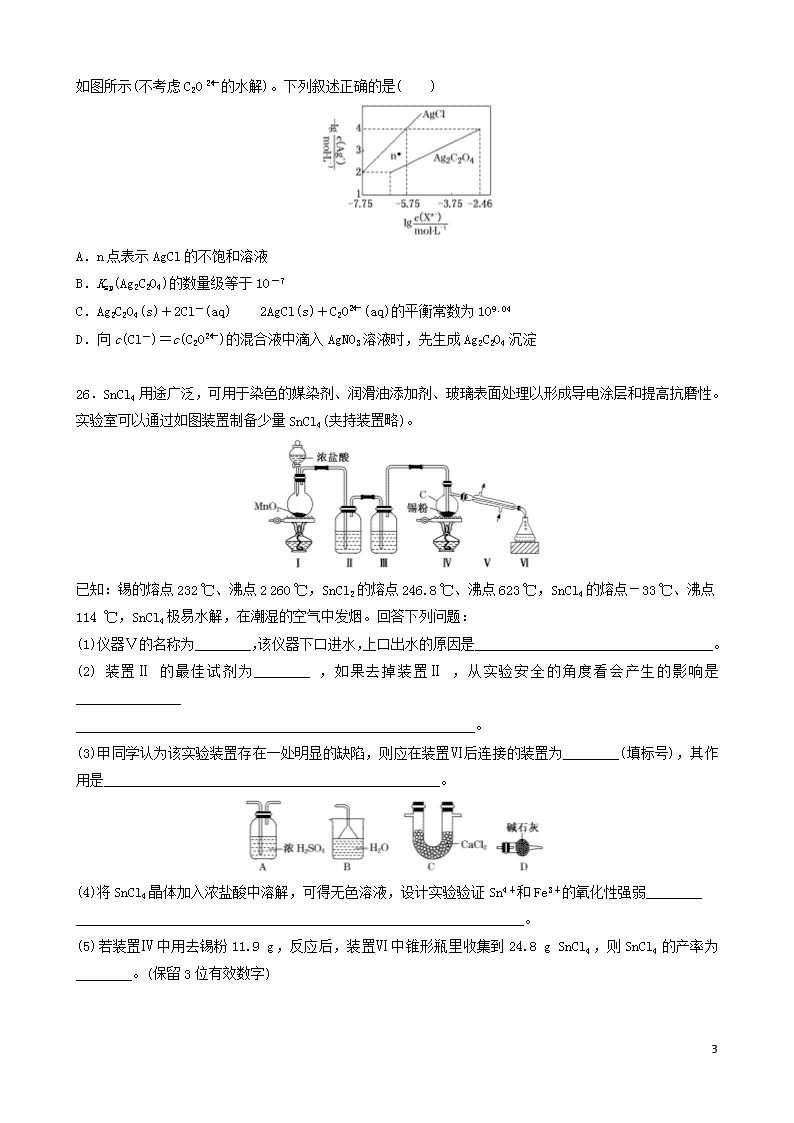
(全国卷I)2020届高考化学模拟试卷精编五 注意事项: 1.答题前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后。再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 4.本试卷可能用到元素的相对原子质量: 一、选择题:本题共7个小题,每小题6分,共计42分,在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生活、社会可持续发展密切相关,下列叙述错误的是( ) A.CO2的大量排放会导致酸雨的形成 B.黄河三角洲的形成体现了胶体聚沉的性质 C.推广使用燃料电池汽车,可减少颗粒物、CO等有害物质的排放 D.轮船上挂锌锭防止铁腐蚀,属于牺牲阳极的阴极保护法 8.NA表示阿伏加德罗常数的值。下列说法正确的是( ) A.2 g H2分别与足量的Cl2和N2充分反应后转移的电子数均为2NA B.常温常压下,pH=3的 1 L 1 mol·L-1 H2S溶液中H+数目为10-3NA C.已知N2(g)+3H2(g)2NH3(g) ΔH=-a kJ·mol-1 ,将NA个N2与3NA个H2混合充分反应,放出a kJ的热量 D.含19.6 g H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA 9.化合物W()、M()、N()的分子式均为C7H8。下列说法正确的是( ) A.W、M、N均能与溴水发生加成反应 B.W、M、N的一氯代物数目相等 C.W、M、N分子中的碳原子均共面 D.W、M、N均能使酸性KMnO4溶液褪色 10.利用NO、O2和Na2CO3溶液反应制备NaNO2的装置如图所示,下列关于该装置的描述不正确的是( ) 11 A.装置A分液漏斗中的药品选用不当,应选用稀HNO3 B.实验过程中,通过控制分液漏斗的活塞控制气流速度 C.装置C中发生反应的化学方程式为2Na2CO3+4NO+O2===4NaNO2+2CO2 D.实验过程中,装置C液面上方可能出现红棕色气体 11.短周期主族元素X、Y、Z、W、Q的原子序数逐渐增大,X的原子核外最外层电子数是次外层电子数的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W的单质是常见的金属,Z是同周期主族元素中原子半径最大的元素,W的简单离子是同周期主族元素中简单离子半径最小的,X和Z的原子序数之和与Q的原子序数相等。下列说法正确的是( ) A.相同质量的Z和W的单质分别与足量稀盐酸反应时,Z的单质获得的氢气较多 B.简单气态氢化物的稳定性:X>Y>Q C.X与Q形成的化合物和Z与Q形成的化合物中的化学键类型相同 D.W元素位于元素周期表中第13列 12.某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是( ) A.放电时,负极的电极反应为Li-e-===Li+ B.放电时,电子通过电解质从Li流向Fe2O3 C.充电时,Fe做阳极,电池逐渐摆脱磁铁吸引 D.充电时,阳极的电极反应为2Fe+3Li2O-6e-===Fe2O3+6Li+ 13.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4 11 溶液,所得沉淀溶解平衡图像如图所示(不考虑C2O的水解)。下列叙述正确的是( ) A.n点表示AgCl的不饱和溶液 B.Ksp(Ag2C2O4)的数量级等于10-7 C.Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数为109.04 D.向c(Cl-)=c(C2O)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 26.SnCl4用途广泛,可用于染色的媒染剂、润滑油添加剂、玻璃表面处理以形成导电涂层和提高抗磨性。实验室可以通过如图装置制备少量SnCl4(夹持装置略)。 已知:锡的熔点232 ℃、沸点2 260 ℃,SnCl2的熔点246.8 ℃、沸点623 ℃,SnCl4的熔点-33 ℃、沸点114 ℃,SnCl4极易水解,在潮湿的空气中发烟。回答下列问题: (1)仪器Ⅴ的名称为________,该仪器下口进水,上口出水的原因是__________________________________。 (2)装置Ⅱ的最佳试剂为________,如果去掉装置Ⅱ,从实验安全的角度看会产生的影响是_______________ _________________________________________________________。 (3)甲同学认为该实验装置存在一处明显的缺陷,则应在装置Ⅵ后连接的装置为________(填标号),其作用是________________________________________________。 (4)将SnCl4晶体加入浓盐酸中溶解,可得无色溶液,设计实验验证Sn4+和Fe3+的氧化性强弱________ ________________________________________________________________。 (5)若装置Ⅳ中用去锡粉11.9 g,反应后,装置Ⅵ中锥形瓶里收集到24.8 g SnCl4,则SnCl4的产率为________。(保留3位有效数字) 11 27.紫色固体高铁酸钾(K2FeO4)是一种新型非氯高效消毒剂,主要用于饮水处理,在化工生产中应用广泛。回答下列问题: (1)次氯酸钾直接氧化法制备高铁酸钾。在剧烈搅拌下,向次氯酸钾强碱性溶液中加入硝酸铁晶体,该反应的氧化剂与还原剂的物质的量之比为________。 (2)间接氧化法制备高铁酸钾的工艺如下: ①Ⅰ中加热的方法是________,温度控制在40~50 ℃的原因是_________________________________。 ②Ⅱ中加入的次氯酸钠的电子式为________________。 ③Ⅲ是向高铁酸钠溶液中加入KOH,析出高铁酸钾晶体,Ⅲ中化学反应类型为_____________________。 ④减压过滤装置如图1所示,减压过滤的目的主要是_____________________________________________。 (3)制备K2FeO4也可以用电解法,装置如图2所示,Ni电极附近溶液的pH________(填“增大”“减小”或“不变”),阳极的电极反应式为________________________。 (4)高铁酸钾是新型水处理剂。含NH3废水会导致水体富营养化,用K2FeO4处理含NH3废水,既可以把NH3氧化为N2,又能生成净水剂使废水澄清,该反应的离子方程式为____________________。天然水中存在Mn2+,可以利用高铁酸钾或高锰酸钾将Mn2+氧化为难溶的MnO2除去,除锰效果高铁酸钾比高锰酸钾好,原因可能是______________________________________________________________________。 28.臭氧是地球大气中一种微量气体,人类正在保护和利用臭氧。 (1)氮氧化物会破坏臭氧层,已知: ①NO(g)+O3(g)===NO2(g)+O2(g)ΔH1=-200.9 kJ·mol-1 ②2NO(g)+O2(g)===2NO2(g)ΔH2=-116.2 kJ·mol-1 则反应:2O3(g)===3O2(g) ΔH=________。 (2)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究,在第二组实验中加入亚铁盐探究Fe2+对氧化I-反应的影响,反应体系如图1,测定两组实验中I浓度实验的数据如图2所示: 11 ①反应后的溶液中存在化学平衡:I2(aq)+I-(aq)I(aq),当c(I)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680) ②结合实验数据可知,Fe2+使I-的转化率________(填“增大”“无影响”或“减小”)。 ③第二组实验18 s后,I浓度下降。导致I浓度下降的原因是________________________。 (3)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。 ①一种脱硝反应中,各物质的物质的量随时间的变化如图3所示,X为________(填化学式)。 ②一种臭氧发生装置原理如图4所示,阳极(惰性电极)的电极反应式为______________________________。 35. [化学一选修 3:物质结构与性质](15分) 二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰[(CH3COO)3Mn]可用于制造离子电池的负极材料。合成方程式如下: 2H2C2O4+SiCl4+2LiBF4===2LiBF2(C2O4)+SiF4+4HCl 4Mn(NO3)2·6H2O+26(CH3CO)2O=== 4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH (1)基态Mn原子的核外电子排布式为________。 (2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是________,1 mol草酸分子中含有σ键的数目为______________________。 (3)与SiF4互为等电子体的两种阴离子的化学式为_________________。 (4)CH3COOH易溶于水,除了它是极性分子外,还因为___________________。 (5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是____________________________________________________。 (6)硼氢化钠的晶胞结构如图所示,该晶胞中Na+的配位数为______,若硼氢化钠晶体的密度为d g·cm-3,NA表示阿伏加德罗常数的值,则a=________(用含d、NA的代数式表示);若硼氢化钠晶胞上、下底心处的Na+被Li+取代,则得到晶体的化学式为________________________。 11 36.[化学—选修5:有机化学基础](15分) 光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去): (1)A的名称为________;羧酸X的结构简式为__________________________________。 (2)C可与乙醇发生酯化反应,其化学方程式为___________________,反应中乙醇分子所断裂的化学键是________(填字母)。 a.C—C键 b.C—H键 c.O—H键 d.C—O键 (3)E→F的化学方程式为________________________;F→G的反应类型为________。 (4)写出满足下列条件的B的2种同分异构体:________________、______________。 ①分子中含有苯环; ②能发生银镜反应; ③核磁共振氢谱峰面积之比为2∶2∶2∶1∶1。 (5)根据已有知识并结合相关信息,写出以CH3CHO为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:CH3CH2BrCH3CH2OHCH3COOCH2CH3 11 模拟五(答案与解析) 7.【答案】A 【解析】正常雨水中溶解二氧化碳,酸雨与N、S的氧化物有关,SO2的大量排放会导致酸雨的形成,故A错误;黄河三角洲的形成,为土壤胶体发生聚沉,体现胶体聚沉的性质,故B正确;燃料电池可减少颗粒物、CO等有害物质的排放,故C正确;轮船上挂锌锭防止铁腐蚀,构成原电池时Zn为负极,Zn失去电子,属于牺牲阳极的阴极保护法,故D正确。 8.【答案】B 【解析】A项,H2和N2的反应属于可逆反应,2 g H2无法完全反应,转移的电子数少于2NA,错误;B项,pH=3的H2S溶液中c(H+)=10-3 mol·L-1,1 L溶液中H+数目为10-3NA,正确;C项将NA个N2与3NA个H2混合充分反应,由于该反应为可逆反应,不能进行彻底,故反应放出的热量小于a kJ,错误;D项,随反应的进行,硫酸浓度逐渐变稀,稀硫酸与铜不反应,生成SO2的分子数少于0.1NA,错误。 9.【答案】D 【解析】A项,W()为苯的同系物,不含碳碳双键,不能与溴水发生加成反应,错误;B项,W有4种类型的氢原子,如图:,一氯代物的数目为4,M有3种类型的氢原子,如图:,一氯代物的数目为3,N有4种类型的氢原子,如图:,一氯代物的数目为4,错误;C项,M中有2个碳原子连有3个C和1个H,如图:,这种碳原子最多与所连3个碳原子中的2个碳原子共平面,故M中所有碳原子不可能共平面,错误;D项,W的苯环上连有甲基,M、N中均含有碳碳双键,W、M、N都能被酸性高锰酸钾溶液氧化,而使溶液褪色,正确。 10.【答案】A 【解析】A项,装置A分液漏斗中使用浓HNO3反应速率加快,且产生的NO2可以在装置B中转化为NO,所以药品选用正确,错误;B项,实验过程中,通过控制分液漏斗的活塞控制气流速度,正确;C项,装置C用于制备NaNO2,发生反应的化学方程式为2Na2CO3+4NO+O2===4NaNO2+2CO2,正确;D项,实验过程中,若装置C中NO和O2逸出液面,可能出现红棕色气体,正确。 11.【答案】D 【解析】X原子核外最外层电子数是次外层的2倍,则X原子有2个电子层,最外层电子数为4,则X为C元素;Z、W是常见金属,原子序数大于碳元素,处于第三周期,Z是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的,则Z为Na元素、W为Al元素;Y的氟化物YF3分子中各原子均达到8电子稳定结构,则Y为N元素;Q处于第三周期,X和Z原子序数之和与Q的原子序数相等,则Q的原子序数为6+11=17,则Q为Cl元素。相同质量的Na和Al分别与足量稀盐酸反应时, 11 二者生成氢气物质的量之比为×3=9∶23,即Al与盐酸反应生成的氢气多,A项错误;非金属性Cl>N>C,则氢化物稳定性HCl>NH3>CH4,B项错误;X与Q形成的化合物为CCl4,含有共价键;Z与Q形成的化合物为NaCl,含有离子键,二者所含化学键不同,C项错误;W为Al元素,位于周期表第3周期ⅢA族,为周期表中第13列,D项正确。 12.【答案】B 【解析】由图可知:该电池在充、放电时的反应为6Li+Fe2O33Li2O+2Fe;放电时负极发生氧化反应,正极发生还原反应;充电时阳极、阴极电极反应式与放电时的正极、负极电极反应式正好相反。该电池在放电时Li为负极,失去电子,发生氧化反应,电极反应式是Li-e-===Li+,A项正确;放电时,电子通过外电路从负极Li流向正极Fe2O3,不能经过电解质,B项错误;充电时,Fe做阳极,失去电子,发生氧化反应,被氧化变为Fe2O3,Fe2O3不能被磁铁吸引,故电池逐渐摆脱磁铁吸引,C项正确;充电时,阳极失去电子,发生氧化反应,该电极反应式为2Fe-6e-+3Li2O===Fe2O3+6Li+,D项正确。 13.【答案】C 【解析】A项,由题图可知,当c(Cl-)相同时,c(Ag+)越大,-lg越小,故AgCl曲线上方的点表示不饱和溶液,曲线下方的点表示过饱和溶液,即n点表示AgCl的过饱和溶液,错误;B项,根据图像可知,当c(Ag+)=10-4mol·L-1时,c(Cl-)=10-5.75 mol·L-1,c(C2O)=10-2.46 mol·L-1,所以Ksp(AgCl)=c(Ag+)·c(Cl-)=10-9.75,Ksp(Ag2C2O4)=c2(Ag+)·c(C2O)=10-10.46=100.54×10-11,即Ksp(Ag2C2O4)的数量级为10-11,错误;C项,Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数为c(C2O)/c2(Cl-)===109.04,正确;D项,AgCl溶液中,c(Ag+)=Ksp(AgCl)/c(Cl-)= mol·L-1,Ag2C2O4溶液中,c(Ag+)== mol·L-1,假设c(Cl-)=c(C2O)=1 mol·L-1,则Ag2C2O4溶液中c(Ag+)较大,因此向c(Cl-)=c(C2O)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀,错误。 26.【答案】(1)直形冷凝管 保证水充满冷凝管,起到充分冷凝的作用 (2)饱和食盐水 锡与氯化氢反应产生的氢气与氯气混合加热会发生爆炸 (3)D 吸收多余的氯气、防止空气中的水蒸气进入装置Ⅵ中 (4)取少量所得无色溶液,滴加氯化亚铁溶液,充分振荡后再滴加KSCN溶液,若溶液变红,则说明Sn4+的氧化性比Fe3+强,反之则说明Sn4+的氧化性比Fe3+弱 (5)95.0% 【解析】由题装置图可知装置Ⅰ为制备氯气的装置,涉及的离子反应为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,装置Ⅱ中盛放的试剂为饱和食盐水,装置Ⅲ中盛放的试剂为浓硫酸,氯气经除杂、干燥后与锡粉在装置Ⅳ中反应生成SnCl4,SnCl4 11 经冷却后在装置Ⅵ中收集。(1)仪器Ⅴ的名称为直形冷凝管,该仪器下口进水,上口出水的原因是保证水充满冷凝管,起到充分冷凝的作用。(2)由于浓盐酸有挥发性,所以在制取的氯气中含有杂质HCl,在Cl2与锡粉反应前要除去HCl,因此装置Ⅱ中的最佳试剂为饱和食盐水。如果去掉装置Ⅱ,则锡与氯化氢反应产生的氢气与氯气混合加热会发生爆炸。(3)SnCl4易发生水解,为防止空气中的水蒸气进入装置Ⅵ中,且为避免未反应的氯气污染空气,所以应在装置Ⅵ后连接盛有碱石灰的干燥管。(5)若装置Ⅳ中用去锡粉11.9 g,则n(Sn)=0.1 mol,理论上产生SnCl4的质量是0.1 mol×261 g·mol-1=26.1 g,但装置Ⅵ中锥形瓶里收集到SnCl4的质量为24.8 g,故SnCl4的产率为×100%≈95.0%。 27.【答案】(1)3∶2 (2)①水浴加热 温度低反应速率慢,温度过高硝酸易挥发、分解 ② ③复分解反应 ④加快过滤速度,得到较干燥的沉淀 (3)增大 Fe-6e-+8OH-===FeO+4H2O (4)2FeO+2NH3+2H2O===2Fe(OH)3(胶体)+N2↑+4OH- 高铁酸钾的还原产物是氢氧化铁胶体,氢氧化铁胶体吸附二氧化锰促进沉淀更快形成,形成沉淀更彻底,除锰效果更好 【解析】(1)氧化剂是KClO,其还原产物为Cl-,1 mol ClO-得到2 mol e-,还原剂是Fe3+,氧化产物为FeO,1 mol Fe3+失去3 mol e-,根据得失电子守恒,氧化剂与还原剂的物质的量之比为3∶2。(2)①控制温度等于或低于100 ℃时通常选择水浴加热;温度控制在40~50 ℃,温度低反应速率慢,硝酸有挥发性和不稳定性,温度过高硝酸容易挥发、分解。②次氯酸钠是离子化合物,书写电子式时注意写中括号及所带的正、负电荷数,其电子式为。③表明发生的反应为Na2FeO4+2KOH===K2FeO4↓+2NaOH,该反应类型为复分解反应。④图中自来水流经抽气泵时把吸滤瓶和安全瓶内的空气部分抽出,使得吸滤瓶内气体压强小于外界大气压,从而加快过滤速度,得到较干燥的沉淀。(3)依题意知该电解槽可以制备高铁酸钾,故铁电极与外接直流电源正极相连作电解槽的阳极,在强碱性溶液中铁失去电子被氧化为高铁酸根离子:Fe-6e-+8OH-===FeO+4H2O。Ni电极则与直流电源负极相连作电解槽阴极,该极发生“放氢生碱”的还原反应:2H2O+2e-===H2↑+2OH-,故Ni电极附近溶液碱性增强,pH增大。(4)由于氨是碱性气体,故含NH3废水为碱性废水,结合“又能生成净水剂使废水澄清”,可知在碱性环境中FeO的还原产物为Fe(OH)3,故离子方程式为2FeO+2NH3+2H2O===2Fe(OH)3(胶体)+N2↑+4OH-。依题意对比分析发现,高锰酸根离子的还原产物是二氧化锰,高铁酸根离子的还原产物是氢氧化铁胶体,氢氧化铁胶体可以吸附二氧化锰,促进沉淀更快形成,沉淀更彻底,除锰效果更好。 28.【答案】(1)-285.6 kJ·mol-1 (2)①0.01 mol·L-1 ②增大 ③c(Fe3+)增大,c(I-)减小,I2(aq)+I-(aq)I(aq)平衡向逆反应方向移动 (3)①N2O5 ②3H2O-6e-===O3↑+6H+ 【解析】(1)根据盖斯定律,由①×2-②得2O3(g)===3O2(g) ΔH=-285.6 kJ·mol-1。(2)①该反应的平衡常数K=,则c(I2)== mol·L-1=0.01 mol·L-1。②结合题图2可知,Fe2+使I-的转化率增大。③18 s后,溶液中c(Fe3+)增大,发生反应:2Fe3++2I-===I2+2Fe2+,导致c(I-)减小,I2(aq)+I-(aq)I(aq)平衡向逆反应方向移动,从而使I浓度下降。(3)①由题图3可知,NO2反应了4 mol,O3反应了2 mol,生成X和O2各2 mol,根据各物质的变化量之比等化学计量数之比以及原子守恒,可确定X为N2O5。②由题图4可知,阳极上水失去电子生成臭氧和氢离子,电极反应式为3H2O-6e-== 11 =O3↑+6H+。 35. 【答案】(1)[Ar]3d54s2(或1s22s22p63s23p63d54s2) (2)sp2 7NA (3)SO、PO (4)乙酸与水分子之间可形成氢键 (5)F的电负性大于N,N—F成键电子对偏向F,导致NF3中的N原子核对孤对电子吸引力增强,难以形成配位键,故NF3不易与Cu2+形成配离子 (6)8 Na3Li(BH4)4 【解析】(1) Mn为25号元素,核外电子数为25,基态Mn原子的核外电子排布式为[Ar]3d54s2或1s22s22p63s23p63d54s2。 (2)由草酸(HOOCCOOH)分子的结构可知,一个中心碳原子有3个σ键和一个π键,没有孤对电子,属于sp2杂化,每个草酸分子中共含有7个σ键,1 mol草酸分子中含有σ键的数目为7NA。 (3)原子数和电子数都相等的微粒互为等电子体。所以与SiF4互为等电子体的两种阴离子的化学式分别为SO、PO。 (4)CH3COOH易溶于水,除了它是极性分子外,还因为CH3COOH与水分子之间可形成氢键。 (5) NF3不易与Cu2+形成配离子的原因是F的电负性大于N,N—F成键电子对偏向F,导致NF3中的N原子核对孤对电子吸引力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。 (6)以上底面处的Na+为研究对象,与之距离最近的BH共有8个。该晶胞中Na+个数为4, BH个数是4,晶体的化学式为NaBH4,该晶胞的质量为 g,该晶胞的体积为2a3 nm3=2a3×10-21 cm3,则2a3×10-21 cm3×ρ g·cm-3= g,a=;若NaBH4晶胞底心处的Na+被Li+取代,则晶胞中BH数目为4,钠离子个数为3,锂离子个数为1,晶体的化学式为Na3Li(BH4)4。 36. 11 11查看更多