- 2021-07-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习无机化工流程题的突破方法作业(全国通用)
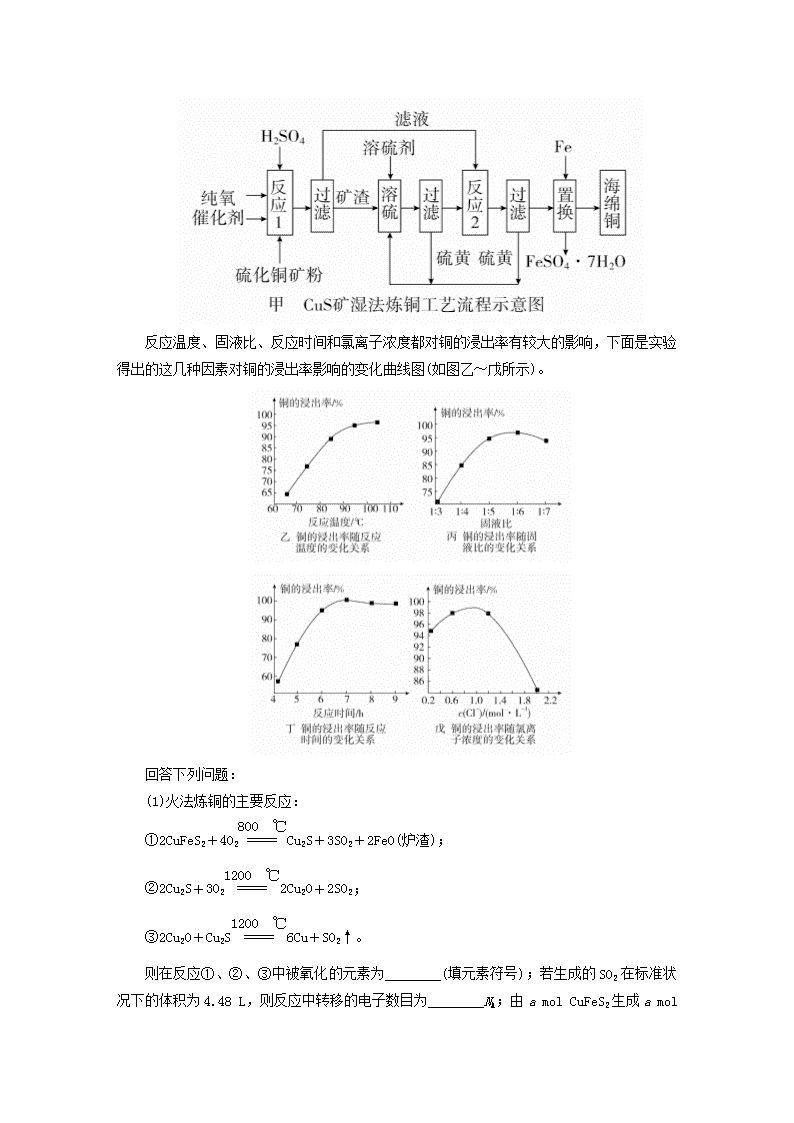
无机化工流程题的突破方法 1.采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4·7H2O),某学习小组设计了如下流程: 下列说法错误的是( ) A.酸浸时选用足量硫酸,试剂X为铁粉 B.滤渣a主要含SiO2,滤渣b主要含Al(OH)3 C.从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解 D.试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾 答案 D 解析 硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)中加入足量硫酸,Fe2O3、Al2O3与酸反应生成硫酸铁、硫酸铝,二氧化硅不反应,过滤,滤渣a为二氧化硅;在滤液A中加入铁粉将Fe3+还原为Fe2+,调节pH使Al3+完全生成氢氧化铝沉淀,过滤,滤渣b为氢氧化铝,滤液B为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体。由流程分析可知,溶解烧渣选用足量硫酸,试剂X为铁粉,A正确;根据以上分析可知滤渣a主要含SiO2,滤渣b主要含Al(OH)3,B正确;Fe2+易被空气中的氧气氧化,而且绿矾受热易失去结晶水,所以从滤液B得到FeSO4·7H2 O产品的过程中,必须控制条件防止其氧化和分解,C正确;试剂X若为过量NaOH溶液,得到的沉淀是氢氧化铁,用硫酸溶解得到的是硫酸铁而不是硫酸亚铁,D错误。 2.如图是工业利用菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程。 回答有关问题: (1)菱镁矿送入酸浸池前需要粉碎,目的是________。 (2)氧化池中通入氯气的目的是氧化________(填化学式),工业上不选用硝酸作氧化剂的原因是________和________。 (3)沉淀混合物为________和________(填化学式)。 (4)利用熔融氯化镁制取金属镁,选用的方法是________(填序号)。 A.电解法 B.氧气还原法 C.碳还原法 D.分解法 答案 (1)提高酸浸速率 (2)Fe2+(或FeCl2) 会产生污染性气体NOx 会引入杂质离子NO (3)Al(OH)3 Fe(OH)3 (4)A 解析 (1)粉碎菱镁矿,增大固相反应物的接触面积,提高酸浸速率。 (2)通入Cl2是为了将Fe2+(或FeCl2)氧化为Fe3+(或FeCl3),工业上不用HNO3是因为会产生污染性气体NOx,也会引入杂质离子NO。 (3)氧化池中存在Al3+、Fe3+、H+,所以加入MgO后与H+反应使溶液碱性增强,Al3+和Fe3+转化为Al(OH)3和Fe(OH)3,故沉淀池中的沉淀为Al(OH)3和Fe(OH)3。 (4)金属镁比较活泼,一般采用电解熔融MgCl2的方法进行冶炼。 3.近年来,硫化铜矿的湿法冶炼技术已经取得了很大的进展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图甲所示: 反应温度、固液比、反应时间和氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图乙~戊所示)。 回答下列问题: (1)火法炼铜的主要反应: ①2CuFeS2+4O2Cu2S+3SO2+2FeO(炉渣); ②2Cu2S+3O22Cu2O+2SO2; ③2Cu2O+Cu2S6Cu+SO2↑。 则在反应①、②、③中被氧化的元素为________(填元素符号);若生成的SO2在标准状况下的体积为4.48 L,则反应中转移的电子数目为________NA;由a mol CuFeS2生成a mol Cu,共消耗________ mol O2。 (2)写出反应1的化学方程式: __________________________________________________________。 经查,硫黄、FeSO4·7H2O均可入药,用途广泛。湿法炼铜与火法炼铜相比,优点是 __________________ _______。 (3)从溶液中得到FeSO4·7H2O晶体的操作是 _________________________________________________________。 (4)根据实验以及工业生产的实际要求,从下表中得出的最佳工艺条件为________(填序号)。 选项 反应温 度/℃ 固液比 c(Cl-)/ (mol·L-1) 反应 时间/h A 95 1∶5 0.8 7 B 100 1∶5.5 0.7 7 C 110 1∶6 0.9 8 答案 (1)S 1.2 2.5a (2)2CuS+O2+2H2SO42CuSO4+2H2O+2S 污染小,同时得到副产物硫酸亚铁晶体及硫黄,资源得到充分利用 (3)蒸发浓缩、冷却结晶、过滤 (4)A 解析 (1)整个过程中化合价升高的元素即被氧化的元素只有硫;每个硫原子失6个电子,故生成4.48 L(即0.2 mol) SO2电子转移数为1.2NA;CuFeS2反应后的最终产物为SO2、FeO、Cu,根据原子守恒即得消耗O2的物质的量。 (2)根据流程图得出CuS的氧化产物为S,H2SO4提供酸性环境,从而得出反应1的化学方程式;湿法炼铜没有SO2生成,故污染小,同时可得到有药用价值的副产物硫酸亚铁晶体及硫黄。 (3)从溶液中获得结晶水合物的常规操作为蒸发浓缩、冷却结晶。 (4)根据图乙~戊可知,A项为最佳工艺条件,95 ℃时铜的浸出率已经很高,且高温需要更多的燃料供能,不经济。 4.以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为: 物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3 质量分 数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1 以下是一种废钒催化剂回收工艺路线: 回答下列问题: (1)“酸浸”时V2O5转化为VO,反应的离子方程式为 _________________________________________________________, 同时V2O4转化成VO2+。“废渣1”的主要成分是________。 (2)“氧化”中欲使3 mol的VO2+变为VO,则需要氧化剂KClO3至少为________mol。 (3)“中和”作用之一是使钒以V4O形式存在于溶液中。“废渣2”中含有________。 (4)“离子交换”和“洗脱”可简单表示为:4ROH+V4OR4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈________性(填“酸”“碱”或“中”)。 (5)“流出液”中阳离子最多的是________。 (6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式________________________________。 答案 (1)V2O5+2H+===2VO+H2O SiO2 (2)0.5 (3)Fe(OH)3和Al(OH)3 (4)碱 (5)K+ (6)2NH4VO3V2O5+2NH3↑+H2O↑ 解析 (1)V2O5及VO中的V均为+5价,“酸浸”时,发生非氧化还原反应,根据原子守恒及电荷守恒不难写出离子方程式;“酸浸”时,V2O5转化成VO,V2O4转化成VO2+,K2SO4可溶于水,Fe2O3及Al2O3分别转化成Fe3+和Al3+,所以“废渣1”的主要成分是SiO2。 (2)欲使3 mol VO2+变为VO需转移3 mol e-,1 mol KClO3作氧化剂生成Cl-转移6 mol e-,所以需KClO3至少0.5 mol。 (3)“中和”时加入KOH溶液,钒以V4O形式存在于溶液中,K2SO4可溶,Fe3+和Al3+分别转化成Fe(OH)3和Al(OH)3沉淀进入“废渣2”。 (4)该反应的逆反应为洗脱过程,增大c(OH-),有利于平衡向左移动,所以淋洗液应呈碱性。 (5)由流程图可以看出,H+在酸浸时损耗,钒转化为V4O(阴离子),Fe3+及Al3+转化为沉淀,所以“流出液”中阳离子最多的是K+。 (6)“煅烧”时肯定得到V2O5,其他物质自然写出。 5.用铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下: (1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有________。 (2)焙烧除铁的反应为4(NH4)2SO4+Fe2O32NH4Fe(SO4)2+3H2O+6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的转化率与温度的关系如图,最适宜的焙烧温度为________。 (3)操作①包括加水溶解、________。 (4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写出高温下Al4C3与Al2O3反应生成铝单质的化学方程式:_____________________________________________________。 (5)不计损失,投入1 t铝土矿,当加入54 kg纯铝后,铝硅合金中m∶n=________。 答案 (1)Al3+、Fe3+、H+ (2)300 ℃ (3)过滤 (4)Al4C3+Al2O36Al+3CO↑ (5)2∶1 解析 铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加(NH4)2SO4焙烧,Fe2O3转化为NH4Fe(SO4)2, 同时生成氨气,加水溶解、过滤,滤渣为SiO2和Al2O3,用焦炭在高温条件下还原SiO2、Al2O3得到铝硅熔体,再加纯铝搅拌,得到铝硅合金。 (1)铝土矿中的氧化铝和氧化铁能溶于强酸生成Al3+、Fe3+,另外还有剩余的H+,所以溶液中的阳离子有Al3+、Fe3+、H+。 (2)焙烧除铁时尽可能使氧化铁的转化率升高,并使氧化铝的转化率降低,由图可知在300 ℃时,氧化铁转化为硫酸盐的转化率很高,而氧化铝转化为硫酸盐的转化率最低,所以最适宜的焙烧温度为300 ℃。 (3)由流程分析可知,操作①包括加水溶解、过滤。 (4)在高温条件下,Al4C3与Al2O3反应生成Al和CO,其反应的化学方程式为Al4C3+Al2O36Al+3CO↑。 (5)已知铝土矿中含30% SiO2、40.8% Al2O3,不考虑损失,投入1 t铝土矿,加入54 kg纯铝,则得到的铝硅合金中Al元素的总质量为1000 kg×40.8%×+54 kg=270 kg,Si元素的总质量为1000 kg×30%×=140 kg,则铝硅合金中m∶n=∶=2∶1。查看更多