- 2021-07-06 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习苏教版金属元素及其化合物作业
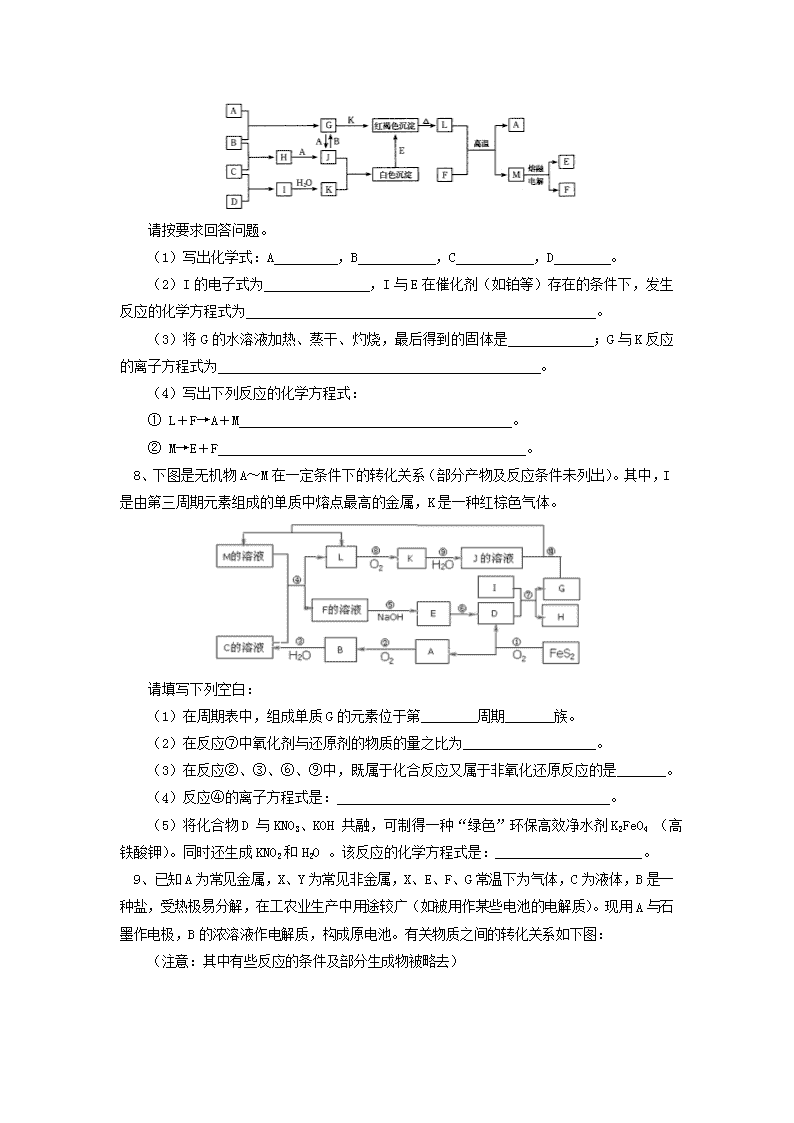
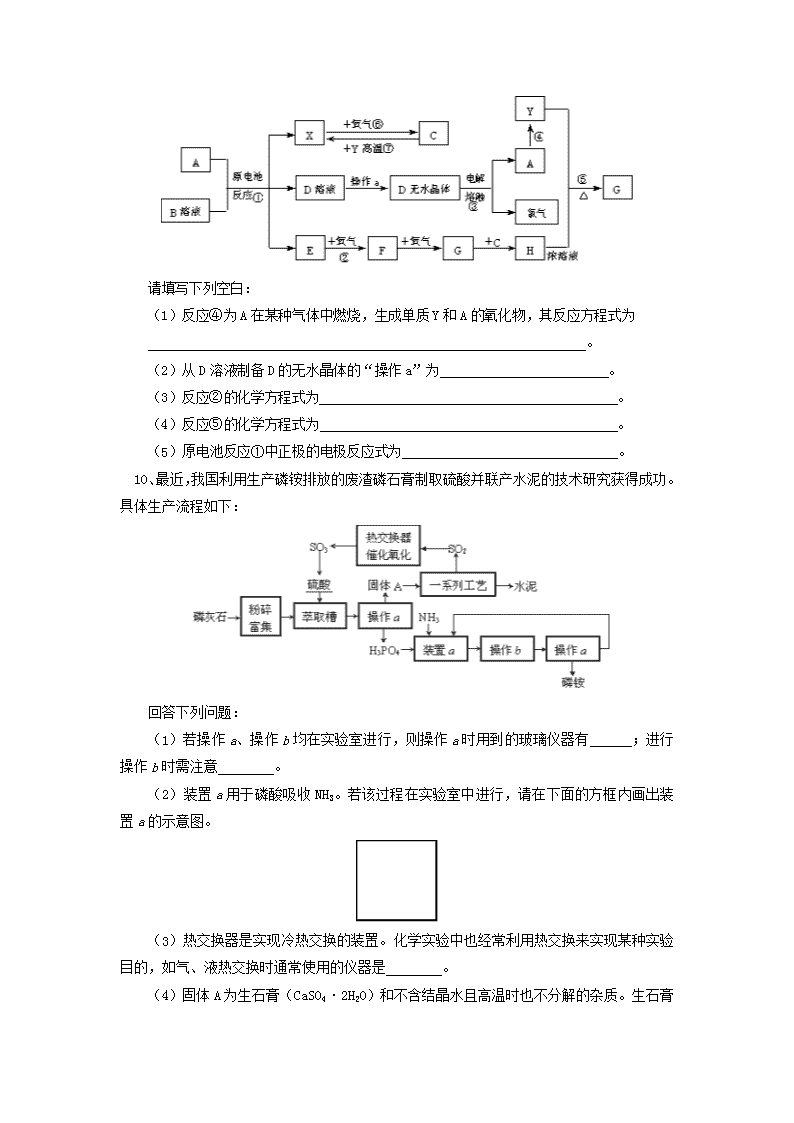
金属元素及其化合物 (答题时间:45分钟) 1、某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其c(H+)=10-2mol·L-1,在该溶液中可以大量存在的阴离子是: A、SO42- B、NO3- C、SCN- D、CO32- 2、向FeCl3和BaCl2的酸性混合溶液中,通入SO2气体,有白色沉淀生成。此沉淀是 : A、BaSO4 B、FeS C、BaSO3 D、S 3、在理论上我们可以用电解熔融KCl的方法来制备金属钾,而实际上,在工业生产中并不采用此法,而用熔融状态下的KCl和Na反应并及时抽走钾蒸气的方法制备钾,可能的原因是:①钾的沸点比Na低; ②钾蒸气易逸出而污染环境;③钾被氧化后的产物与K作用具有爆炸性;④抽走钾的蒸气有利于钠与熔融KCl的反应,其中正确的是: A、全部 B、①③ C、①④ D、②④ 4、有关碳酸氢钠和碳酸钠的性质,以下叙述错误的是: A、等质量的碳酸氢钠和碳酸钠与足量盐酸反应,在相同条件下碳酸钠产生的二氧化碳体积大 B、等物质的量的两种盐与同浓度的盐酸完全反应,碳酸钠所消耗盐酸的体积是碳酸氢钠的两倍 C、将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀 D、同物质的量浓度的两种溶液,碳酸钠溶液的pH大于碳酸氢钠溶液 5、向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴溴水后,溶液变成红色,由此得出的结论错误的是: A、Fe2+的氧化性比溴的氧化性强 B、该晶体中一定含有SCN- C、Fe2+与SCN-不能形成红色化合物 D、Fe2+被溴氧化成Fe3+ 6、将amolAl203和bmolMgO混合后全部溶于VL过量的稀H2SO4中,然后再逐滴加入0.5 mol/L的NaOH 溶液,当加至x LNaOH溶液时,生成的沉淀量最大。则原稀H2S04的物质的量浓度是: A、mol/L B、 mol/L C、 mol/L D、无法计算 7、下列框图中,A~M所代表的物质为中学化学常见的物质,其中A~F为单质;通常情况下,A、F为固体,B为黄绿色气体,C、D、E为无色气体,F可溶于强碱。在一定条件下相互转化关系如图所示(图中部分反应条件的产物已略去。) 请按要求回答问题。 (1)写出化学式:A ,B ,C ,D 。 (2)I的电子式为 ,I与E在催化剂(如铂等)存在的条件下,发生反应的化学方程式为 。 (3)将G的水溶液加热、蒸干、灼烧,最后得到的固体是 ;G与K反应的离子方程式为 。 (4)写出下列反应的化学方程式: ① L+F→A+M 。 ② M→E+F 。 8、下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。 请填写下列空白: (1)在周期表中,组成单质G的元素位于第________周期_______族。 (2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。 (3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_______。 (4)反应④的离子方程式是:_______________________________________。 (5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾)。同时还生成KNO2和H2O 。该反应的化学方程式是:_____________________。 9、已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图: (注意:其中有些反应的条件及部分生成物被略去) 请填写下列空白: (1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。 (2)从D溶液制备D的无水晶体的“操作a”为 。 (3)反应②的化学方程式为 。 (4)反应⑤的化学方程式为 。 (5)原电池反应①中正极的电极反应式为 。 10、最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如下: 回答下列问题: (1)若操作a、操作b均在实验室进行,则操作a时用到的玻璃仪器有 ;进行操作b时需注意 。 (2)装置a用于磷酸吸收NH3。若该过程在实验室中进行,请在下面的方框内画出装置a的示意图。 (3)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是 。 (4)固体A为生石膏(CaSO4·2H2 O)和不含结晶水且高温时也不分解的杂质。生石膏在120℃时失水生成熟石膏(2CaSO4·H2O),熟石膏在200℃时失水生成硫酸钙。 为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A 180g置于坩埚中加热,加热过程中固体质量随温度变化记录如图: ① 实验中每次对固体称量时须在冷却后进行。为保证实验结果的精确性,固体冷却时必须防止 。 ② 将加热到1400℃时生成的气体通入品红溶液中,品红褪色。写出1400℃时的化学反应方程式 。 ③ 固体A中生石膏的质量百分含量= 。 【试题答案】 1、A 2、A 3、C 4、AC 5、A 6、C 7、(1)Fe Cl2 H2 N2 (2) 4NH3 + 5O2 4NO + 6H2O (3)Fe2O3(或氧化铁) Fe3+ + 3 NH3·H2O == Fe(OH)3↓+ 3 NH4+ (4)①Fe2O3 +2Al 2 Fe + Al2O3 ②2Al2O3 4Al + 3O2↑ 8、(1)四(或4);Ⅷ。 (2)1:2。 (3)③。 (4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O。 (5)Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O。 9、(1)2Mg+CO22MgO+C; (2)将D溶液在HCl气流中蒸干; (3)②4NH3+5O24NO+6H2O;(4)⑤C+4HNO3(浓)CO2↑+4NO2↑+2H2O (5)2NH4++2e- = 2NH3↑+H2↑ 10、(1)漏斗、玻璃棒、烧杯 低温蒸发结晶 (2)(如图或其他能防止氨气倒吸的装置) (3)冷凝管 (4)① 吸水 ② 2CaSO42CaO+2SO2↑+O2↑ ③ 75.6%查看更多