- 2021-07-06 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省成都外国语学校2020届高三上学期期中考试理综(解析版)
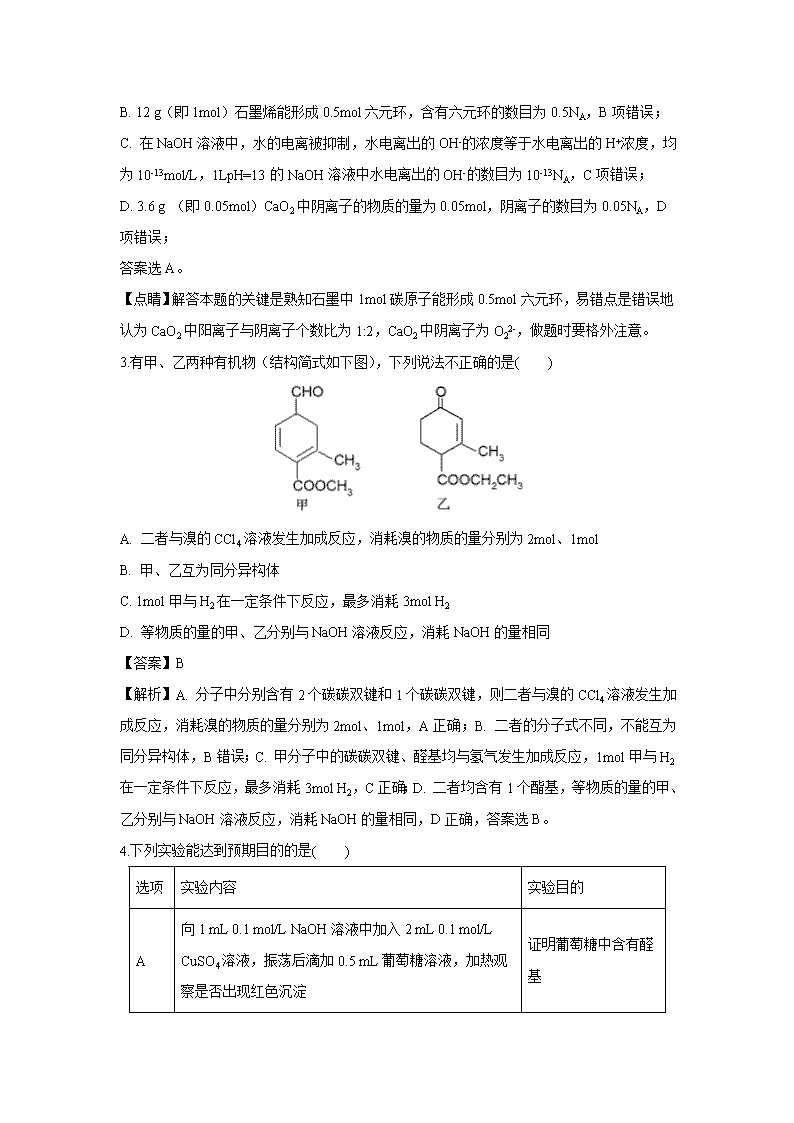
四川省成都外国语学校2020届高三上学期期中考试理综 可能用到的相对原子质量:H ---1 C ---12 N ---14 O--- 16 F--- 19 Cl--- 35.5 Ca ---40 Fe ---56 Br ---80 I ---127 第Ⅰ卷 1.习近平总书记指出“绿水青山就是金山银山”。下列观点合理的是( ) A. 将工业废液排入海洋以减少河道污染 B. 为了减少火电厂产生的大气污染,应将燃煤粉碎并鼓入尽可能多的空气 C. 习总书记2018年4月2日参加北京植树节体现了绿色化学的思想 D. 与2017年相比2018年某地区降水pH平均值增加了0.27,说明酸雨情况有所改善 【答案】D 【详解】A.工业废液排入海洋中会污染海洋,会危害渔业资源,人如果食用了被污染的鱼,对人体也会产生危害,A项不合理; B. 将燃煤粉碎并鼓入尽可能多的空气,并不能减少SO2的排放,不能减少空气污染,B项不合理; C. 植树不能从源头上杜绝污染物的排放,不是绿色化学的核心体现,C项不合理; D. pH值增加,雨水酸性减弱,说明酸雨情况有所改善,D项合理; 答案选D。 2.设NA为阿伏加德罗常数的数值,下列说法正确的是( ) A. 42 g丙烯和环丙烷的混合气体中所含极性键的数目为6NA B. 12 g石墨烯(单层石墨)中含有六元环的数目为1.5NA C. 室温下,1 L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA D. 3.6 g CaO2晶体中阴离子的数目为0.1NA 【答案】A 【分析】A. 丙烯和环丙烷的分子式均为C3H6,摩尔质量相同,极性键数量相同; B. 1mol碳原子能形成0.5mol六元环; C. 在NaOH溶液中,水的电离被抑制,溶液中的OH-几乎全部来自氢氧化钠; D. CaO2中阳离子与阴离子个数比为1:1。 【详解】A. 丙烯和环丙烷互为同分异构体,42 g丙烯和环丙烷的混合气体的物质的量为42g÷42g/mol=1mol,含有的极性键的物质的量为6mol,数量为6NA,A项正确; B. 12 g(即1mol)石墨烯能形成0.5mol六元环,含有六元环的数目为0.5NA,B项错误; C. 在NaOH溶液中,水的电离被抑制,水电离出的OH-的浓度等于水电离出的H+浓度,均为10-13mol/L,1LpH=13的NaOH溶液中水电离出的OH-的数目为10-13NA,C项错误; D. 3.6 g (即0.05mol)CaO2中阴离子的物质的量为0.05mol,阴离子的数目为0.05NA,D项错误; 答案选A。 【点睛】解答本题的关键是熟知石墨中1mol碳原子能形成0.5mol六元环,易错点是错误地认为CaO2中阳离子与阴离子个数比为1:2,CaO2中阴离子为O22-,做题时要格外注意。 3.有甲、乙两种有机物(结构简式如下图),下列说法不正确的是( ) A. 二者与溴的CCl4溶液发生加成反应,消耗溴的物质的量分别为2mol、1mol B. 甲、乙互为同分异构体 C. 1mol甲与H2在一定条件下反应,最多消耗3mol H2 D. 等物质的量的甲、乙分别与NaOH溶液反应,消耗NaOH的量相同 【答案】B 【解析】A. 分子中分别含有2个碳碳双键和1个碳碳双键,则二者与溴的CCl4溶液发生加成反应,消耗溴的物质的量分别为2mol、1mol,A正确;B. 二者的分子式不同,不能互为同分异构体,B错误;C. 甲分子中的碳碳双键、醛基均与氢气发生加成反应,1mol甲与H2在一定条件下反应,最多消耗3mol H2,C正确;D. 二者均含有1个酯基,等物质的量的甲、乙分别与NaOH溶液反应,消耗NaOH的量相同,D正确,答案选B。 4.下列实验能达到预期目的的是( ) 选项 实验内容 实验目的 A 向1 mL 0.1 mol/L NaOH溶液中加入2 mL 0.1 mol/L CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热观察是否出现红色沉淀 证明葡萄糖中含有醛基 B 向1 mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 证明在相同温度下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3] C 测定同温度下相同浓度的碳酸钠和硫酸钠溶液的pH,前者大于后者 证明碳元素非金属性弱于硫 D 向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试纸置于试管口试纸不变蓝 证明溶液中无NH4+ 【答案】C 【详解】A. 由数据可知配制氢氧化铜悬浊液时氢氧化钠溶液不足,加热后不会出现红色沉淀,A项错误; B.开始时加入的氢氧化钠过量,生成氢氧化镁的白色沉淀后,过量的NaOH能继续和FeCl3溶液反应生成红褐色沉淀,不能说明发生了沉淀的转化,B项错误; C.测定同温度下相同浓度的碳酸钠和硫酸钠溶液的pH,前者pH大于后者,说明碳酸的酸性弱于硫酸,碳酸、硫酸是C、S的最高价含氧酸,能说明碳元素的非金属性比硫元素的非金属性弱,C项正确; D.溶液中即使存在NH4+,使用这种方法也不能检验出来,原因是溶液中NH4+与OH-生成NH3·H2O,没有加热不能产生NH3,D项错误; 答案选C。 【点睛】本题的易错点是葡萄糖检验的方法,在检验的过程中要注意:①新制Cu(OH)2悬浊液要随用随配,不可久置;②配制新制Cu(OH)2悬浊液时,所用NaOH必须过量;③反应液直接加热煮沸,才有明显的红色沉淀;④加热沸腾不能太久,否则会有黑色沉淀,这是Cu(OH)2受热分解生成CuO所致。 5. 短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( ) A. 原子半径:r(Y) > r(Z) > r(W) B. Z、W形成的两种化合物中,阴、阳离子个数比相同 C. Y的气态氢化物的热稳定性比Z 的强 D. 仅由X、Y、Z形成的化合物只能是共价化合物 【答案】B 【解析】试题分析:Z是地壳中含量最高的元素,Z为O;由X的原子半径比Y的小,X与W同主族,短周期元素X、Y、Z、W 的原子序数依次增大,则X为H,W为Na;原子最外层电子数之和为13,则Y的最外层电子数为13-1-1-6=5,Y为第二周期的N元素。A.电子层越多,半径越大,同周期原子序数大的原子半径小,则原子半径为r(W)>r(Y)>r(Z),故A错误;B.元素Z(O)、W(Na)形成的两种化合物氧化钠、过氧化钠中,阴、阳离子个数比相同均为1:2,故B正确;C.非金属性Z>Y,则元素Y的简单气态氢化物的热稳定性比Z的弱,故C错误;D.只含X、Y、Z三种元素的化合物,若为硝酸盐,则为离子化合物,若为硝酸,则是共价化合物,故D错误;故选B。 考点:考查了原子结构与元素周期律的相关知识。 6.锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法错误的是( ) A. 钛网与直流电源的正极相连,发生还原反应 B. 石墨电极的反应为2H2O+2e-=H2↑+2OH- C. 电解过程中硫酸钠溶液浓度保持不变 D. 生成葡萄糖酸的化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr 【答案】A 【分析】由题干可知,在钛网上NaBr将被氧化为溴单质,失电子发生氧化反应,钛网作阳极,与电源的正极相连,石墨电极作阴极,发生还原反应,电极反应为:2H2O+2e-=H2↑+2OH-。 【详解】A. 由分析可知,在钛网上NaBr将被氧化为溴单质,失电子发生氧化反应,钛网作阳极,与电源的正极相连,A项错误; B. 石墨电极作阴极,发生还原反应,电极反应为:2H2O+2e-=H2↑+2OH-,B项正确; C. 电解过程中,左侧发生的反应为2Br--2e-=Br2、CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr,右侧电极反应为:2H2O+2e-=H2↑+2OH-,左侧产生的H+经过质子交换膜不断向右侧提供被消耗的H+,右侧硫酸钠溶液的浓度不变,C项正确; D. 电解过程中溴离子氧化生成的Br2将葡萄糖氧化为葡萄糖酸,化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr,D项正确; 答案选A。 7.25℃时,将0.0l mol • L -1 NaOH溶液滴入20mL0.01mol·L-1CH3COOH溶液的过程中,溶液中由水电离出的c(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是( ) A. x=20,a点的纵坐标为1.0×10-12 B. b点和d点所示溶液的pH相等 C. 滴定过程中,c(CH3COO-)与c(OH-)的比值逐渐增大 D. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) 【答案】D 【解析】A、a点是0.01mol·L-1CH3COOH,电离出的H+ 浓度小于0.01mol·L-1,a点水电离的H+ 大于1.0×10-12,x<20ml,故A错误;B、b点酸性和d点显碱性,所示溶液的pH不相等,故B错误;C、滴定过程中,不断地加碱,c(OH-)一直增大,c(CH3COO-)与c(OH-)的比值逐渐减小, 故C错误;D、e点所示溶液中,醋酸的量是NaOH的2倍,由物料守恒可得c(Na+)=2c(CH3COO-)+2c(CH3COOH),故D正确;故选D。 第Ⅱ卷 8.锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下: 已知氢氧化锶在水中的溶解度: 温度(℃) 0 10 20 30 40 60 80 90 100 溶解度(g/100mL) 0.91 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2 (1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为_________________________。 (2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。 ①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=___________。 ②若pH过大,将导致氢氧化锶的产率降低,请解释原因_______________________________ _______________________________________________。 (3)“趁热过滤”的目的是____________________________________,“滤渣”的主要成分为___________________________________。 (4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____________、过滤、洗涤、干燥。 (5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,请写出吸收时的离子方程式__________________________________;再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3溶液。请写出电解时阳极的电极反应:________________________。 【答案】(1). SrSO4+4CSrS+4CO↑ (2). 1.2×10-10 mol•L-1 (3). OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出 (4). 防止温度降低使氢氧化锶析出而造成损失 (5). Ca(OH)2、Mg(OH)2 (6). 降温结晶 (7). 2Fe3++H2S=2Fe2++S↓+2H+ (8). Fe2+—e—=Fe3+ 【解析】(1)根据图中信息,隔绝空气焙烧时SrSO4只被碳还原成SrS,同时生成一氧化碳,反应化学方程式为:SrSO4 + 4C SrS + 4CO↑;(2)①95℃时水的离子积KW=1.0×10-12,pH为12,c(H+)=10-12mol/L,c(OH-)==1mol/L,c(Mg2+)= ==1.2×10-10 mol•L-1;②OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出,导致氢氧化锶的产率降低;(3)“趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为在碱性条件下沉淀下来的Mg(OH)2和微溶物Ca(OH)2;(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥;(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,铁离子将硫离子氧化为硫单质,吸收时的氧化产物为S;再用石墨电极电解吸收液,电解过程将氯化亚铁氧化为氯化铁,故电解后可在“脱硫”中循环利用的物质是FeCl3。 9.甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。 I.甲酸能与醇发生酯化反应 该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验: 有关物质的性质如下: 沸点/℃ 密度(g·cm-3) 水中溶解性 甲醇 64.5 0.79 易溶 甲酸 100.7 1.22 易溶 甲酸甲酯 31.5 0.98 易溶 (1)装置中,仪器A的名称是_____________________,长玻璃管c的作用是______________________________________。 (2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________。 (3)要从锥形瓶内所得 混合物中提取甲酸甲酯,可采用的方法为__________________________________。 II.甲酸能脱水制取一氧化碳 (1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→______________________(按气流方向从左到右,用小写字母表示)。 (2)装置B的作用是__________________________________。 (3)一定条件下,CO能与NaOH 固体发生反应:CO+NaOH HCOONa。 ①为了证明“CO与NaOH 固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________________________________________________________________。 ②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0 g配制成100 mL溶液,量取20.00 mL该溶液于锥形瓶中,再加入___________作指示剂,用1.5 mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05 mL,则产物中甲酸钠的质量分数为___________(计算结果精确到0.1%)。 【答案】(1). 直形冷凝管 (2). 平衡内外气压,冷凝回流产品 (3). HCOOH+ CH3OHHCOOCH3+H2O (4). 蒸馏 (5). c→b→e→d→f (6). 除去CO中的HCOOH 蒸气 (7). 加入稀硫酸酸化后,再滴加酸性高锰酸钾溶液,能够使溶液褪色 (8). 酚酞 (9). 81.1% 【解析】I.(1)由装置图可知,仪器A为直形冷凝管;由于产物甲酸甲酯的沸点较低,为防止其大量挥发,所以长玻璃管c的作用冷凝回流产品,也能起到平衡内外气压的作用; (2) 甲酸和甲醇进行酯化反应的化学方程式HCOOH+ CH3OHHCOOCH3+H2O; (3)根据甲酸、甲醇和甲酸甲酯的沸点都有较大差别,可采用蒸馏的方法提取混合物中的甲酸甲酯; II.(1)用甲酸脱水制取一氧化碳时,要用浓硫酸催化脱水,再用碱石灰进行除杂,最后用排水法收集CO,所以正确的连接顺序为a→c→b→e→d→f ; (2) 由于甲酸的沸点不高,在加热时会有一定量的挥发,所以装置B的作用是除去CO中的HCOOH蒸气; (3) ①已知甲酸(HCOOH)是还原性酸,所以可用氧化性物质来检验是否有甲酸生成,所以取固体产物,配成溶液,加入稀硫酸酸化后,再滴加酸性高锰酸钾溶液,溶液的紫色褪去,即证明CO与NaOH 固体发生了反应;②这是用标准盐酸来滴定未知碱溶液的操作,所以用酚酞作指示剂,已知消耗盐酸的物质的量为1.5 mol/L×5.05 ×10-3L=7.575×10-3 mol,所以8.0g固体产物中含NaOH的质量为7.575×10-3 mol×5×40g/mol=1.515g,则产物中甲酸钠的质量分数为=81.1%。 点睛:本题的关键是通过甲酸、甲醇和甲酸甲酯的沸点,知道它们的沸点较低,易挥发,需要从产物中除去,且沸点之间差距较大,可通过蒸馏的方法进行分离提纯,又甲酸具有还原性,为甲酸钠的检验提供了思路。 10.工业上以CO2和NH3为原料合成尿素。在尿素合成塔中主要反应可表示如下: 反应Ⅰ:2NH3(g)+CO2(g)NH2CO2NH4(s) ΔH1=-159.47 kJ·mol-1 反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1 总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH3 回答下列问题: (1)在相同条件下,反应Ⅰ分别在恒温恒容容器中和绝热恒容容器中进行,二者均达到平衡后,c(CO2)恒温________c(CO2)绝热(填“大于”“小于”或“等于”);ΔH3=____________。 (2)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4 mol NH3和0.2 mol CO2放入容积为2 L的密闭容器中,t1时达到化学平衡,c(CO2)随时间t变化曲线如图甲所示,在0~t1时间内该化学反应速率υ(NH3)=____________;若其他条件不变,t1时将容器体积压缩到1 L,t2时达到新的平衡。请在图甲中画出t1~t2时间内c(CO2)随时间t变化的曲线。___________________________________ (3)在150 ℃时,将2 mol NH3和1 mol CO2置于a L 密闭容器中,发生反应Ⅲ,在t时刻,测得容器中CO2转化率约为73%,然后分别在温度为160 ℃、170 ℃、180 ℃、190 ℃时,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线(见图乙)。在150~170 ℃之间,CO2转化率呈现逐渐增大的变化趋势,其原因是_______ _______________________________________________________________________________,180 ℃时反应Ⅲ的平衡常数K=____________(用含a的式子表示)。 (4)侯氏制碱法主要原料为NaCl、CO2和NH3,其主要副产品为NH4Cl,已知常温下,NH3·H2O的电离常数Kb=1.8×10-5,则0.2 mol·L-1 NH4Cl溶液的pH约为________(取近似整数)。 【答案】(1). 小于 (2). -86.98 kJ·mol-1 (3). mol∙L-1∙min-1 (4). (5). 反应未达到平衡状态,温度越高反应速率越快,CO2转化率越向平衡靠拢 (6). 12a2 (7). 5 【分析】(1)反应Ⅰ分别在恒温恒容和绝热恒容中进行,二者均达到平衡,绝热容器中温度升高平衡逆向进行,二氧化碳浓度增大;用盖斯定律计算∆H3; (2)由图甲知在0~t1时间内,二氧化碳浓度的变化量为0.1mol/L-0.025mol/L=0.075mol/L,根据υ=进行计算;体积压缩为原来的一半,浓度瞬时增大为原来的一倍,变为0.05mol/L,增大压强平衡正向移动,因生成物为固体,最终达到的平衡状态时CO2的浓度仍为0.025mol/L,据此画出曲线; (3)由图乙可知二氧化碳的转化率随温度的升高而增大,温度达到170℃时达到最大值,反应达到平衡状态,温度继续升高,二氧化碳的转化率逐渐减小,说明平衡逆向进行;180 ℃时二氧化碳的转化率为75%,利用三段法进行计算; (4)铵根离子水解使溶液呈酸性,NH4+的水解平衡常数Kh==与c2(H+)=Kh·c(NH4+)计算出c(H+),进一步计算pH。 【详解】(1)反应Ⅰ分别在恒温恒容和绝热恒容中进行,二者均达到平衡,由于反应I是放热反应,绝热容器中温度升高平衡逆向进行,二氧化碳浓度增大,c(CO2)恒温小于c(CO2)绝缘;利用盖斯定律可知I+II得总反应,2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1; (2)由图甲知在0~t1时间内,二氧化碳浓度的变化量为0.1mol/L-0.025mol/L=0.075mol/L,则∆c(NH3)=0.15mol/L, υ(NH3)=== mol∙L-1∙min-1;体积压缩为原来的一半,浓度瞬时增大为原来的一倍,变为0.05mol/L,增大压强平衡正向移动,因生成物为固体,最终达到的平衡状态时CO2的浓度仍为0.025mol/L,据此曲线为:; (3)由图乙可知二氧化碳的转化率随温度的升高而增大,温度达到170℃时达到最大值,反应达到平衡状态,温度继续升高,二氧化碳的转化率逐渐减小,说明平衡逆向进行,所以在150~170 ℃之间,CO2转化率呈现逐渐增大的变化趋势,其原因是反应未达到平衡状态,温度越高反应速率越快,CO2转化率越向平衡靠拢; 设CO2转化了x mol/L 2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) 始(mol/L) 0 转(mol/L) 2x x x 平(mol/L) -2x -x x 180 ℃时二氧化碳的转化率为75%,则有100%=75%,解得x= 平衡常数K===12a2; (4)铵根离子水解使溶液呈酸性,NH4的水解平衡常数Kh===,水解生成的c(NH3·H2O)近似等于c(H+),则c2(H+)=Kh·c(NH4+),c(H+)==≈10-5mol/L,pH=-lg[c(H+)]=5。 11.卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题: (1)溴原子的价层电子排布图为________________。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。 氟 氯 溴 碘 第一电离能/ (kJ·mol-1) 1 681 1 251 1 140 1 008 (2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是_______________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。 (3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。 (4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。 (5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。 【答案】 (1). (2). I (3). 氢键 (4). CsICl2CsCl+ICl (5). sp3 (6). Cl2O(或OF2等) (7). 8 (8). 12 (9). a3ρ NA×10-21 【分析】(1)Br原子的价电子排布式为4s24p5;元素的第一电离能越小,失电子能力越强,越容易失电子成为阳离子; (2)氢键能使HF分子之间缔合;碘在水中的溶解度小,在碘化钾溶液中明显增大,是由于I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质CsCl,同时生成ICl,据此写出方程式; (3)ClO2-中心Cl原子价层电子对数=2+=4,且含有两个孤电子对,根据价层电子对互斥理论判断杂化轨道类型,等电子体空间构型和键合形式相似; (4)利用均摊法计算; (5)该晶胞中F-为8个,Ca2+为8×+6×=4,两个最近Ca2+核间距为a nm=a×10-7cm,晶胞棱长=a×10-7cm,晶胞的体积V为(a×10-7)3cm3,则=,代入数据进行计算。 【详解】(1)Br原子的价电子排布式为4s24p5,价层电子排布图为;元素的第一电离能越小,失电子能力越强,越容易失电子成为阳离子,由表格中的数据可知,易形成阳离子的是I; (2)氢键能使HF分子之间缔合,所以氢键导致HF分子缔合;I2在水中溶解度小,在碘化钾溶液中明显增大,是由于I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质为CsCl,同时生成ICl,方程式为:CsICl2CsCl+ICl; (3)ClO2-中心Cl原子价层电子对数=2+=4,且含有两个孤电子对,根据价层电子对互斥理论可知杂化轨道类型为sp3,等电子体空间构型和键合形式相似,与该离子具有相同立体构型和键合形式的有Cl2O(或OF2等); (4)平均每个晶胞中碘原子的个数=(8×+6×)×2=8;碘晶体中碘分子的配位数=3×8÷2=12; (5)该晶胞中F-为8个,Ca2+为8×+6×=4,两个最近Ca2+核间距为a nm=a×10-7cm,晶胞棱长=a×10-7cm,晶胞的体积V为(a×10-7)3cm3,则=,M==g/mol=a3ρ NA×10-21 g/mol,则CaF2的相对分子质量可以表示为a3ρ NA×10-21。 12.有机物A~M有如图转化关系,A与F分子中含碳原子数相同,均能与NaHCO3溶液反应,且A中含一个卤素原子,F的分子式为C9H10O2;D能发生银镜反应;M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种。 已知:(R1、R2代表烃基或氢原子) 请回答: (1)B、F的结构简式分别为_____________、____________ (2)反应①~⑦中,属于消去反应的是_____________(填反应序号)。 (3)D发生银镜反应的化学方程式为_____________________________________________;反应⑦的化学方程式为___________________________________________ (4)A的相对分子质量在180~260之间,从以上转化中不能确认A中含有哪种卤素原子,确定该官能团的实验步骤和现象为______________________________________________ __________________________________________________________________ (5)符合下列条件F的同分异构体共有________种。 a.能发生银镜反应 b.能与FeCl3溶液发生显色反应 c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6 【答案】(1). (2). (3). ④ (4). +2Ag↓+2NH3+H2O (5). +(n-1)H2O (6). 取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子 (7). 2 【分析】A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,均含有﹣COOH,F的分子式为C9H10O2,其不饱和度为=5,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种,说明F含有苯环,F中应含有乙基,且与羧基处于对位,故F为,M为.由A→B→C的转化可知,C中含有﹣COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为,故D为,B为,A的相对分子质量在180〜260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为,X相对原子质量大于180﹣28﹣76﹣45=31,小于260﹣28﹣76=111,X可能为Cl或Br。C发生消去反应生成E为,E与氢气发生加成反应生成F。C发生缩聚反应生成高聚物H为。 【详解】A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,均含有﹣COOH,F的分子式为C9H10O2,其不饱和度为 =5,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种,说明F含有苯环,F中应含有乙基,且与羧基处于对位,故F为,M为.由A→B→C的转化可知,C中含有﹣COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为,故D为,B为,A的相对分子质量在180〜260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为,X相对原子质量大于180﹣28﹣76﹣45=31,小于260﹣28﹣76=111,X可能为Cl或Br。C发生消去反应生成E为,E与氢气发生加成反应生成F。C发生缩聚反应生成高聚物H为。 (1)B、F的结构简式分别为、, 故答案为:、; (2)反应①属于取代反应,还发生中和反应,反应②属于复分解反应,反应③⑥属于氧化反应,反应④属于消去反应,反应⑤属于加成反应,反应⑦属于缩聚反应, 故答案为:④; (3)D发生银镜反应的化学方程式为:; 反应⑦的化学方程式为:, 故答案为:; ; (4)根据上面的分析可知,X可能为Cl或Br,要确定X是哪种官能团的实验步骤和现象为:取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子, 故答案为:取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子; (5)符合下列条件的F()的同分异构体:a.能发生银镜反应,说明分子中存在醛基;b.能与FeCl3溶液发生显色反应,说明分子中存在酚羟基;c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6,说明有4种氢原子,符合以上条件的F分子中有2个甲基、1个酚羟基、1个﹣CHO,且2个甲基处于间位,另2个分别处于对位,结构简式为,所以F的同分异构体有2种, 故答案为:2。 查看更多