2018届二轮复习压轴题评分细则示例课件(146张)(全国通用)
二、压轴题评分细则示例
第二篇 揭秘阅卷规则 教你满分答卷
阅卷案例
(14分)《华北电力大学学报(社会科学版)》2014年第2期的文章《欧盟暂
停征收航空碳排放税的法律思考》,该文章从欧盟暂停征收航空碳排放
税的背景入手,分析了欧盟征收航空碳排放税的争议焦点所在,最后对
欧盟暂停征收航空碳排放税进行了评析,并提出征收航空碳排放税是未
来趋势的观点,希望在反对声中换一个视角来阐述征收航空碳排放税对
于环境保护、技术革新和国际法的促进作用。
(一)基本概念、基本理论综合题
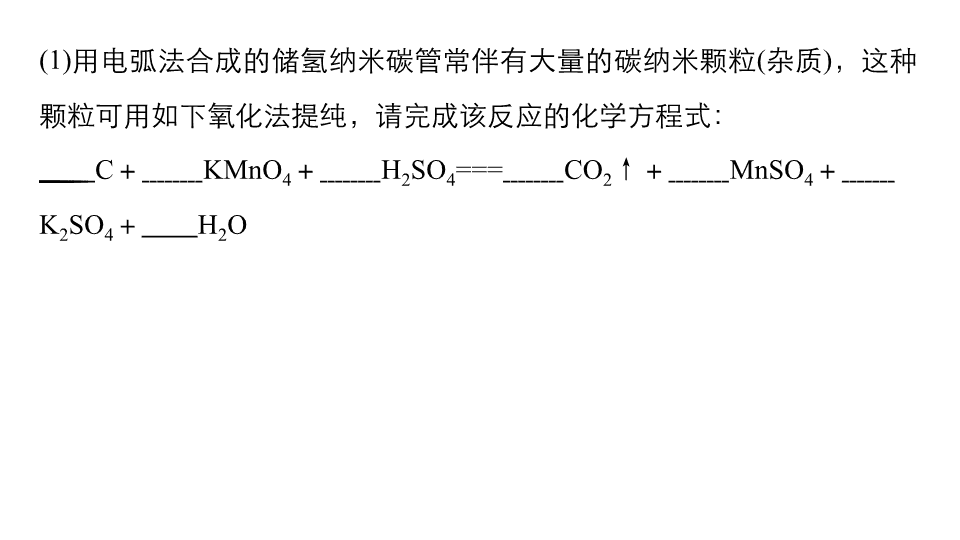
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种
颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
C+ KMnO4+ H2SO4=== CO2↑+ MnSO4+
K2SO4+ H2O
物质
n/mol
T/℃
活性炭 NO E F
初始 2.030 0.100 0 0
T1 2.000 0.040 0.030 0.030
T2 2.005 0.050 0.025 0.025
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂
质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量
如下表:
上述反应T1 ℃时的平衡常数为K1,T2 ℃时的平衡常数为K2。
①计算K1= 。
②根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1大于T2 b.T1小于T2 c.无法比较
(3)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41 kJ·mol-1
[已知:2H2O (g)===2H2 (g)+O2 (g)
ΔH=+484 kJ·mol-1]
①写出CO完全燃烧生成CO2的热化学方程式:
。
②某温度下,在一容积可变的容器中, CO转化生成CO2的反应达到平衡
时, CO、O2和CO2的物质的量分别为4 mol、2 mol和4 mol。保持温度和
压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移
的是 。
A.均增加1 mol B.均加倍
C.均减少1 mol D.均减半
(4)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸
盐Na2FeO4的装置如图所示。其中Y为CO2。
写出石墨Ⅰ电极上发生反应的电极反应式: 。
写出电解池中生成FeO 的电极反应式为 。
标准答案评分细则阅卷现场得分技巧
标准答案
(1)5 4 6 5 4 2 6(2分)
(2)①0.562 5(9/16)(2分) ②c(2分)
(3)①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1(2分) ②A(2分)
评分细则阅卷现场得分技巧
评分细则
(1)有一系数出错或漏写不得分,数字难以辨认不得分。
(2)①小数或分数均可,写小数时应准确,否则扣分。
②参考标准答案。
(3)①无状态、无单位(或单位错)、数字错均不得分。
②写成“a”不得分。
(4)不化简成最简比扣1分,化学方程式不配平不得分。
阅卷现场得分技巧
阅卷现场
得分技巧
得分技巧
(1)读题要求:坚持三读。
①泛读,明确有几个条件及求解的问题。
②细读,圈出关键字、关键词,把握数量关系。
③精读,深入思考,挖掘隐含信息,尤其是图像、图表中的信息。
(2)做题要求:①看准题目要求,不要答非所问。
②卷面整洁规范,不要潦草了事。
③遇难而过,不要强攻拦路虎。
(3)心理要求:“我易人易不大意,人难我难不畏难”——向细心要分数。
类型一 热化学、速率平衡综合题
1.(17分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如
图1所示。[已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1]
精题精练与答题规范
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|
(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量
为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为
。
(5)恒容条件下,对于反应:2SO2(g)+O2(g)2SO3(g),下列措施中能使
n(SO3)/n(SO2)增大的有 (填编号)。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速
率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引
起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的
一段时间是 。
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 t3~t4 t5~t6 t6~t7
K1 K2 K3 K4
K1、K2、K3、K4之间的关系为 。
评分细则 标准答案
标准答案 (1)S(s)+O2(g)===SO2(g)
ΔH=-297 kJ·mol-1(2分)
(2)-78.64 kJ·mol-1(2分)
(3)大(2分)
(4)2 mol(2分)
2SO2+O2+4OH-===2SO +2H2O(1分)
(5)C(2分)
(6)升高温度(2分) t3~t4(2分)
(7)K4=K3
”或
“<”)-297.0 kJ·mol-1
+。
②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式: 。
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电
解质,该电解质能传导O2-粒子。
①正极反应式为 。
②S(g)在负极发生的反应为 、
。
③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因
。
④每生产1 L浓度为98%、密度为1.84 g·mL-1的浓硫酸,理论上可向用电
器提供 mol电子,将消耗 mol氧气。
⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫黄蒸气的转化
率,该工艺采取的措施有 。
评分细则 标准答案
标准答案 (1)①<(1分)
②S(s)+ O2(g)===SO3(g)
ΔH=-395.7 kJ·mol-1(2分)
(2)①O2+4e-===2O2-(2分)
②S-4e-+2O2-===SO2、S-6e-+3O2-===SO3(2分)
③SO3+H2O===H2SO4(2分)
④110.4(1分) 27.6(1分)
⑤硫黄(及二氧化硫)循环使用;用稀硫酸吸收SO3(减小生成物浓度,有利
于提高S的转化率)(2分)
评分细则
评分细则 (1)①写成“小于”不得分。
②“系数”与“数据”对应即得分。符号错、状态错、数据错均不得分。
(2)①②③根据标准答案得分。
④写上单位不扣分。
⑤不写括号内内容不扣分。
类型三 热化学、电化学、速率平衡、电解质溶液综合题
3.(14分)以下是对化学反应变化过程及结果的研究。请按要求回答问题:
(1)关于能量变化的研究
已知:①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-a kJ·mol-1
②CH3OH(l)+O2(g)===CO(g)+2H2O(l)
ΔH=-b kJ·mol-1
③H2O(g)===H2O(l) ΔH=-c kJ·mol-1
则:2CO(g)+O2(g)===2CO2(g) ΔH= kJ·mol-1。
(2)关于反应速率和限度的研究
①已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 CH3COOH HCN H2CO3
电离平衡常数(25 ℃) 1.8×10-5 4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
则等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液
的pH由大到小的顺序为 (填编号)。
②已知:
2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的
容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到
平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)
= 。
③下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解
平衡后,溶液中S2-的浓度、金属阳离子浓度变化情况。如果向三种沉淀
中加盐酸,最先溶解的是 (填化学式,
下同);向新生成的ZnS浊液中滴入足量含相同
浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀
会转化为 沉淀。
(3)关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为VO +2H+
+V2+ V3++VO2++H2O。
则充电时阳极反应式为 。
用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol 电子时,溶液的
pH= (不考虑溶液体积的变化)。
评分细则 标准答案
标准答案 (1)(-a+2b-4c)(2分)
(2)①cbda(2分) ②0.03 mol·L-1·min-1(2分)
③FeS(2分) CuS(2分)
(3)VO2++H2O-e-===VO +2H+(2分) 1(2分)
评分细则
评分细则 (1)写成“-(a-2b+4c)”得分。
(2)①写成c>b>d>a得分,写成a”)。
(5)根据等电子原理,写出CN-的电子式: , 1 mol O 中含有的π键
数目为 。
(6)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,
δ、α两种晶胞中铁原子的配位数之比为 。
标准答案评分细则阅卷现场考点分析
标准答案
(1)H (1分) 1s22s22p63s23p63d64s2或[Ar]3d64s2(2分)
(2)sp2、sp3 (2分) 如图 (2分)
(3)3(1分)
(4)>(1分)
(5) (2分) 2NA(2分)
(6)4 (1分) 4∶3(1分)
评分细则阅卷现场考点分析
评分细则
(1)写元素名称不得分,写成[Ar]3d64s2不得分。
(2)sp2、sp3各占1分,配位键按照标准答案评分。
(3)写成3NA不得分。
(4)写成“大于”不得分。
(5)电子式按照标准答案评分,写成2 mol也得分。
(6)参照标准答案评分。
阅卷现场考点分析
阅卷现场
考点分析
考点分析
高考对物质结构与性质的考查都是综合性的,重点考查基态原子(离子)的电
子排布式(原子轨道示意图)、电离能和电负性的理解和比较、化学键类型、
原子的杂化轨道类型与粒子空间结构、分子的性质以及晶体相关计算。
类型一 直接回答型
1.(15分)(1)A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周
期元素,其原子的第一至第四电离能如下表所示:
精题精练与答题规范
电离能/kJ·mol-1 I1 I2 I3 I4
A 932 1 821 15 390 21 771
B 738 1 451 7 733 10 540
根据上述信息,写出B的基态原子核外电子排布式 ,预测A和氯元素
形成的简单分子空间构型为 。
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合
物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若
产生白色沉淀,则该配合物的化学式为 ,中心离子的配位数
为 。
(3)参考下表中的物质熔点,回答下列问题:
物质 NaF NaCl NaBr NaI NaCl KCl RbCl CsCl
熔点/℃ 995 801 755 651 801 776 715 646
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律:
。
(4)C60可用作储氢材料。C60的结构如图1。已知金刚石中的C—C键长为
154.45 pm,C60中C—C键长为140~145 pm,有同学据此认为C60的熔点高
于金刚石,你认为是否正确? ,并阐述理由: 。科学家把C60
和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低
温时是一种超导体,该物质的K原子和C60分子的个数比为 。
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是 ,
1 mol三聚氰胺分子中含 mol σ键。
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直
径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用
含a、b、c的式子表示)。
评分细则 标准答案
标准答案 (1) 1s22s22p63s2或[Ne]3s2(1分) 直线形(1分)
(2)[Co(NH3)5Br]SO4(1分) 6(1分)
(3)随着阴、阳离子的半径增大,熔点逐渐降低(2分)
(4)不正确(1分) C60是分子晶体,熔化时破坏的是分子间作用力(2分)
3∶1(2分)
(5) sp2、sp3(1分) 15(1分)
评分细则
评分细则 (1)参照标准答案评分。
(2)写成Co(NH3)5BrSO4不得分。
(3)因素1分,结论1分。
(4)“不正确”、“不对”、“错误”均得分,指出C60是分子晶体得1分,
指出熔化时破坏的作用力得1分,写成“1∶3”不得分。
(5)sp2、sp3漏写或写错不得分。
类型二 推断回答型
2.(15分)A、B、C、D、E、F六种元素的原子序数依次增大。A的最高正价
和最低负价的绝对值相等。B的基态原子有3个不同的能级且各能级中电子
数相等。D的基态原子与B的基态原子的未成对电子数目相同,E基态原子
的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是
4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E原子的第一电离能由小到大的顺序为 (用元素符号回答)。
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
A.分子中都含有σ键和π键
B.中心原子都是sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有 。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如下图所示。
B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原
子的数目为 ,该晶体的化学式为 。
若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素
的原子半径分别为r1 pm、r2 pm、r3 pm,则该晶体的密度表达式为
g·cm-3。
评分细则 标准答案
标准答案 (1)3d84s2(2分)
(2)MgO>C>Mg不得分。
(3)有错或写成“e”均不得分。
(4)写成“孤电子”不得分。
(5)写成“Ni3MgC”得分,但写成“Ni3CMg”或“MgCNi3”均不得分。
表达式参照标准答案评分。