2021届新高考一轮复习人教版第15讲元素周期表 元素周期律作业
练案[15]第五章 物质结构 元素周期律
第15讲 元素周期表 元素周期律
A组 基础必做题
1.(2019·北京理综,6分)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( D )
A.In是第五周期第ⅢA族元素
B.In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
[解析] 本题考查原子结构、元素周期表和元素周期律,考查的核心素养是证据推理与模型认知。Rb为碱金属,属于第五周期元素,故In亦为第五周期元素,In与Al同主族,即为第ⅢA族元素,A项正确;In的中子数为115-49=66,质子数为49,质子数等于核外电子数,故中子数与电子数之差为17,B项正确;同主族元素,从上到下,原子半径逐渐增大,故原子半径:In>Al,C项正确;同周期主族元素从左到右,金属性逐渐减弱,故其最高价氧化物对应水化物的碱性逐渐减弱,即碱性In(OH)3
乙>Si
C.元素乙的简单气态氢化物的稳定性强于CH4
D.推测乙可以用作半导体材料
[解析] 本题通过元素推断,考查元素在周期表中的位置、原子半径比较、简单氢化物稳定性比较等。从示意图可以看出同一行的元素在同一主族,同一列的元素在同一周期,甲元素与B和Al在同一主族,与As在同一周期,则甲位于元素周期表中第四周期第ⅢA族为Ga元素,同理,乙元素位于第四周期第ⅣA族为Ge元素,A项正确;同周期元素从右到左,原子半径逐渐增大,同主族元素从上到下,原子半径逐渐增大,所以原子半径:Ga>Ge>Si,B项正确;同主族元素的非金属性从上到下越来越弱,则简单气态氢化物的稳定性越来越弱,元素乙的简单气态氢化物的稳定性弱于CH4,C项错误;乙为Ge元素,其处于非金属和金属元素的交界处,可用作半导体材料,D项正确。
4.(2020·湖北襄阳一模)随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
下列有关说法中正确的是( B )
A.元素f位于第三周期Ⅲ族
B.离子的半径大小为r(d2-)>r(e+)
C.元素h的氧化物对应水化物的酸性比g的强
D.由x、z组成的一种四原子化合物的电子式为x︰︰x
[解析] 本题考查物质结构与元素周期律。根据题意可推知,x、y、z、d、e、f、 g、 h分别为H、C、N、O、Na、Al、S、Cl。Al位于第三周期Ⅲ A族,A项错误;O2-、Na+具有相同的电子层结构,原子序数越小,离子半径越大,故r(O2-)>r(Na+),B项正确;Cl的最高价氧化物对应水化物的酸性比S的强,C项错误;由H、N组成的四原子化合物为NH3,其电子式为 ,D项错误。
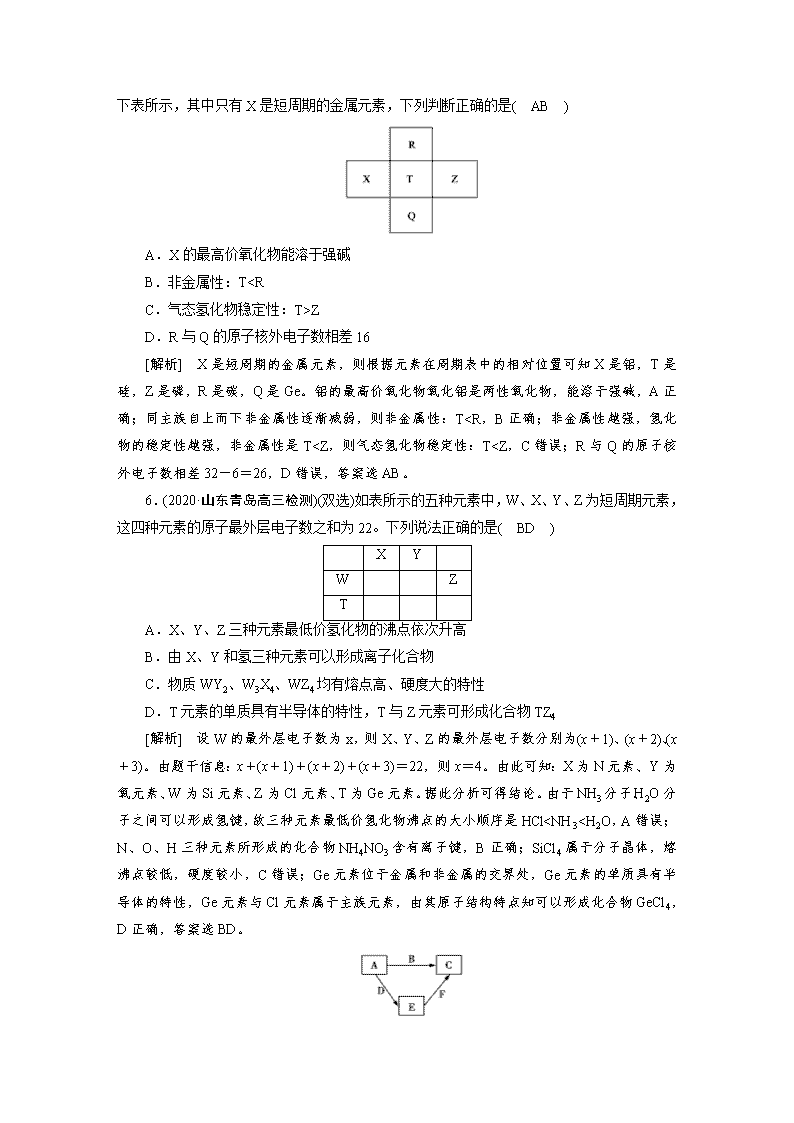
5.(2020·山东济南高三检测)
(双选)元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,下列判断正确的是( AB )
A.X的最高价氧化物能溶于强碱
B.非金属性:TZ
D.R与Q的原子核外电子数相差16
[解析] X是短周期的金属元素,则根据元素在周期表中的相对位置可知X是铝,T是硅,Z是磷,R是碳,Q是Ge。铝的最高价氧化物氧化铝是两性氧化物,能溶于强碱,A正确;同主族自上而下非金属性逐渐减弱,则非金属性:TAl>C>N>O>H 。
(2)X、L两元素按原子数目比1︰1构成分子B,B的电子式为 。
(3)硒(Se)是人体必需的微量元素,已知非金属性:SeY>X>W
B.最高价氧化物对应水化物的酸性:Y>X
C.简单阴离子的还原性:WX(C)>Y(N)>W(H),A错误;元素非金属性越强,其最高价氧化物对应的水化物的酸性越强,故最高价氧化物对应的水化物酸性Y>X,B正确;元素非金属性越弱,其简单阴离子的还原性越强,故简单阴离子的还原性:ZW
C.简单气态氢化物的热稳定性:Y>X
D.W2Y2中含有非极性键
[解析]
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,则d为Na2O2,结合图中转化关系可知,元素Y的单质气体m为O2,则Y为O,a为烃,b、c分别为CO2、H2O,e、f分别为Na2CO3、NaOH,结合原子序数可知,W为H,X为C,Y为O,Z为Na。O2-、Na+具有相同电子层结构,原子序数大的离子半径小,则简单离子半径:Na+CH4,故C正确。H2O2中含有O—O非极性键,故D正确。
13.(2020·山东东营高三检测)(双选)下图所示是短周期的一部分,已知B原子与C原子核外电子总数之和为A的4倍,则下列推断正确的是( AB )
A.A、B、C三者均为非金属元素
B.A、B、C三者核电荷数之和为40
C.A与B、A与C均可形成离子化合物
D.B与C只能形成一种共价化合物
[解析] 本题考查元素周期表的结构及物质结构的知识,短周期1、2、3周期中含元素种类分别为2、8、8。设B元素的核电荷数为x,则C的核电荷数为x+2,A的核电荷数为x+1-8=x-7,4(x-7)=x+x+2,x=15,即B为磷,A为氧,C为氯,可见选项A、B正确。C错误,因为P、O、Cl之间不能形成离子化合物。因此Cl与P可形成两种化合物PCl3和PCl5,所以D也错误。
14.(2020·辽宁锦州期末)如图是元素周期表的一部分,下列说法正确的是( B )
A.离子半径:W->X+>Y3-
B.可在灰色区域“甲”中寻找催化剂
C.气态氢化物的稳定性:Z>W
D.工业上电解X和W化合物的水溶液制备X
[解析] 由元素的位置可知,X为Na,Y为N,Z为Si,W为Cl。离子半径:W->Y3->X+,故A错误;非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性:W>Z,故C错误;电解NaCl溶液生成NaOH、氢气、氯气,应电解熔融NaCl制备Na,故D错误。
15.(2020·江西重点中学协作体联考)短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( D )
A.q与s均为酸性氧化物
B.Z的含氧酸是一种强酸
C.Y的氢化物比Z的氢化物稳定是因为Y的氢化物之间存在氢键
D.原子半径:W
查看更多