- 2021-07-06 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学课时分层作业22电解原理的应用 人教版选修4
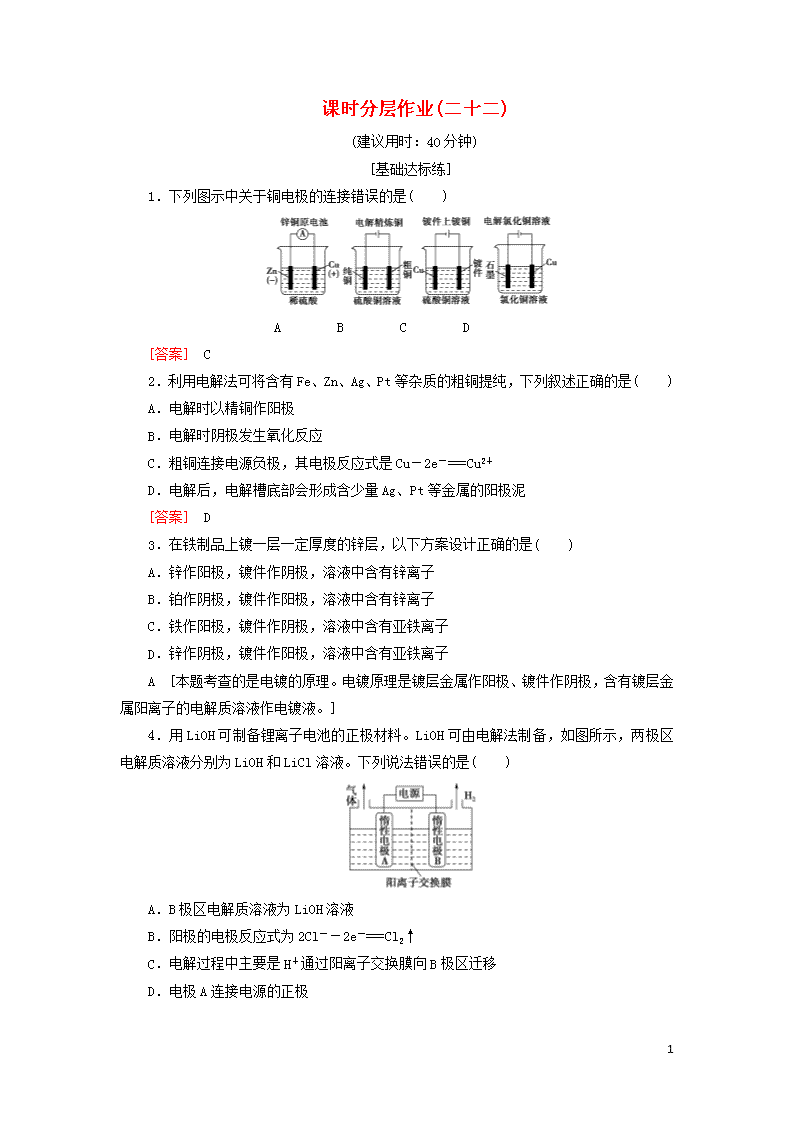
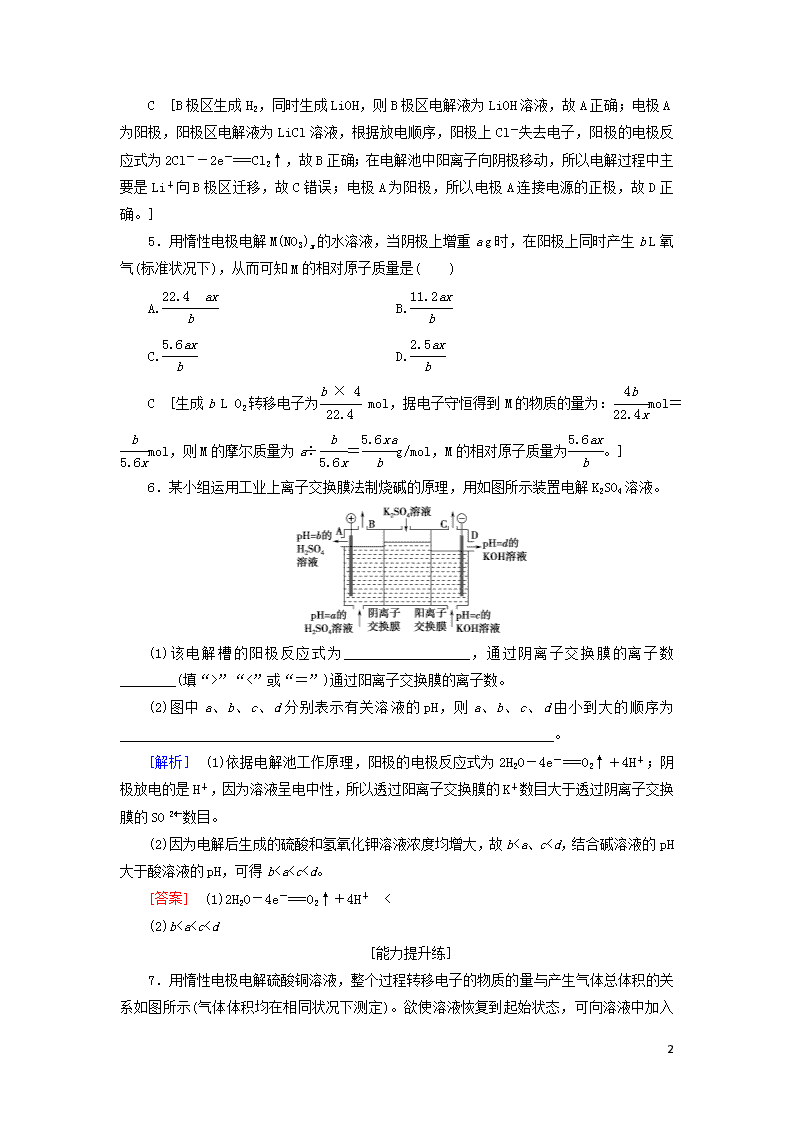
课时分层作业(二十二) (建议用时:40分钟) [基础达标练] 1.下列图示中关于铜电极的连接错误的是( ) A B C D [答案] C 2.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( ) A.电解时以精铜作阳极 B.电解时阴极发生氧化反应 C.粗铜连接电源负极,其电极反应式是Cu-2e-===Cu2+ D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 [答案] D 3.在铁制品上镀一层一定厚度的锌层,以下方案设计正确的是( ) A.锌作阳极,镀件作阴极,溶液中含有锌离子 B.铂作阴极,镀件作阳极,溶液中含有锌离子 C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 D.锌作阴极,镀件作阳极,溶液中含有亚铁离子 A [本题考查的是电镀的原理。电镀原理是镀层金属作阳极、镀件作阴极,含有镀层金属阳离子的电解质溶液作电镀液。] 4.用LiOH可制备锂离子电池的正极材料。LiOH可由电解法制备,如图所示,两极区电解质溶液分别为LiOH和LiCl溶液。下列说法错误的是( ) A.B极区电解质溶液为LiOH溶液 B.阳极的电极反应式为2Cl--2e-===Cl2↑ C.电解过程中主要是H+通过阳离子交换膜向B极区迁移 D.电极A连接电源的正极 4 C [B极区生成H2,同时生成LiOH,则B极区电解液为LiOH溶液,故A正确;电极A为阳极,阳极区电解液为LiCl溶液,根据放电顺序,阳极上Cl-失去电子,阳极的电极反应式为2Cl--2e-===Cl2↑,故B正确;在电解池中阳离子向阴极移动,所以电解过程中主要是Li+向B极区迁移,故C错误;电极A为阳极,所以电极A连接电源的正极,故D正确。] 5.用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况下),从而可知M的相对原子质量是( ) A. B. C. D. C [生成b L O2转移电子为 mol,据电子守恒得到M的物质的量为:mol=mol,则M的摩尔质量为a÷=g/mol,M的相对原子质量为。] 6.某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。 (1)该电解槽的阳极反应式为__________________,通过阴离子交换膜的离子数________(填“>”“<”或“=”)通过阳离子交换膜的离子数。 (2)图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为______________________________________________________________。 [解析] (1)依据电解池工作原理,阳极的电极反应式为2H2O-4e-===O2↑+4H+;阴极放电的是H+,因为溶液呈电中性,所以透过阳离子交换膜的K+数目大于透过阴离子交换膜的SO数目。 (2)因为电解后生成的硫酸和氢氧化钾溶液浓度均增大,故b查看更多
相关文章
- 当前文档收益归属上传用户