2019学年高二化学下学期期末联考试题 新版新人教版
2019学年高二化学下学期期末联考试题
相对原子质量: H:1 C:12 N: 14 O:16 Ca:40
一、选择题(本题共16小题,每小题3分,共48分。均为单选题)
1.化学在生产和生活中有重要的应用。下列说法正确的是
A.工业生产玻璃、水泥,均需要用石灰石为原料
B.14C可用于文物年代的鉴定,14C与12C互为同素异形体
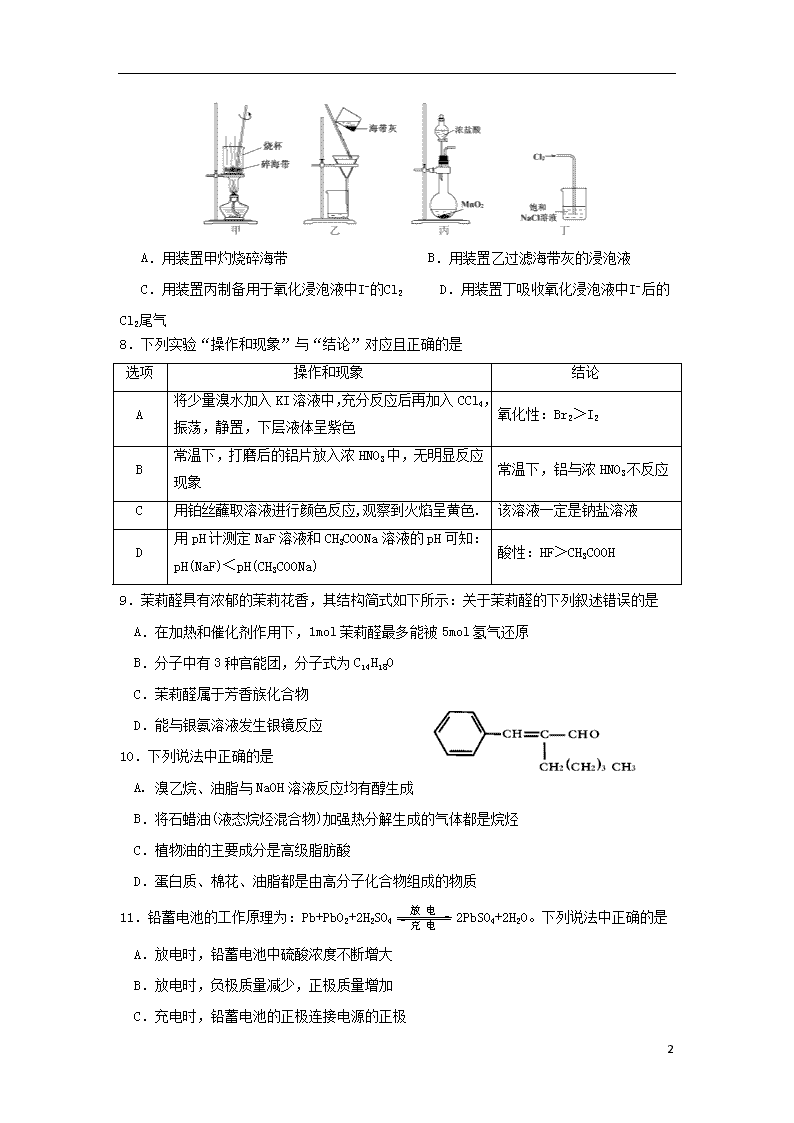
C.煤的气化和石油的分馏都是物理变化
D.粗硅制备单晶硅不涉及氧化还原反应
2.用化学用语表示 NH3+ HClNH4Cl中的相关微粒,其中正确的是
A.中子数为8的氮原子: B.HCl的电子式:
C.NH3的结构式: D.Cl−的结构示意图:
3.阿伏加德罗常数为NA ,下列叙述错误的是
A.18gH2O中所含电子数为10NA
B.等物质的量的C2H4和CO所含分子数均为NA
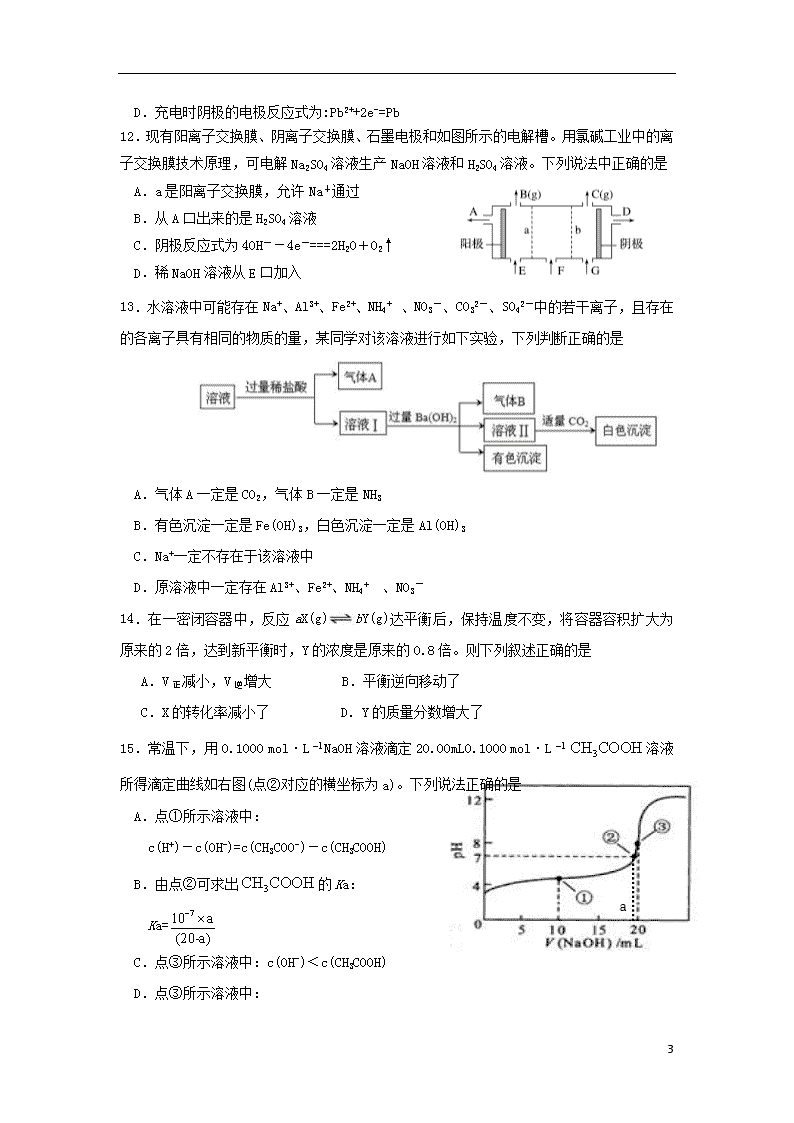
C.1 mol Fe与过量的稀HNO3反应,转移3NA 个电子
D.常温常压下,氧气和臭氧的混合物32g中约含有2NA个氧原子
4.浓硫酸在与含有水分的蔗糖作用过程中不能显示的性质是
A.酸性 B.吸水性 C.脱水性 D.强氧化性
5.短周期主族元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为10,且X与Z在周期表中位置上下相邻,Y原子最外层电子数等于X原子次外层电子数,下列说法不正确的是
A.X与Z可形成共价化合物 B.X的氢化物的稳定性大于Z的氢化物的稳定性
C.原子半径X
c(Na+)>c(OH-)>c(H+)
16.水泥是重要的建筑材料。用以下方法测定水泥中钙元素的含量:水泥样品中钙元素转化为草酸钙沉淀后,经稀H2SO4处理,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L−1的KMnO4溶液32.00 mL,则该水泥样品中钙的质量分数为
A. 20% B. 30% C. 40% D. 50%
二、填空题(本题共5小题,共52分)
17.(8分)已知A、B、C、E的焰色反应均为黄色,其中B常作食品的膨化剂,A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色、无味的气体D放出。X为一种黑色固体单质,X有多种同素异形体,其氧化物之一参与大气循环且为温室气体,F为单质,G为冶炼铁的原料,G溶于盐酸中得到两种盐。A~H之间有如下的转化关系(部分物质未写出):
(1)写出物质的化学式:B________,F________。
(2)物质C的电子式为_________________,A固体中所含化学键类型____________________________。
(3)写出A与B反应生成E的化学方程式:___________________________________________________。
(4)写出G与稀硝酸反应的离子方程式:_____________________________________________________。
18.(10分)在如右图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂可以制得白色的Fe(OH)2沉淀。请回答以下问题:
(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂后,
11
(填打开或夹紧)止水夹,塞紧塞子后,试管Ⅰ中有气体产生,
该气体的作用是 。
(4) 检验试管Ⅱ出口处排出的气体的纯度。当排出的气体纯净时,再______(填打开或夹紧)止水夹。检验该气体纯度的方法是 。
(5)试管Ⅰ中溶液流入试管Ⅱ中,其原因是 。
19.(10分)钇(Y)是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:①在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
②有关金属离子形成氢氧化物沉淀时的pH见下表。
离子
开始沉淀时的pH
完全沉淀时的pH
Fe3+
2.7
3.7
Y3+
6.0
8.2
请回答下列问题:
(1)钇矿石的组成可用氧化物的形式表示,其中Fe的化合价是+2,Y的化合价是_______。写出Be的氧化物与氢氧化钠共熔时的化学反应方程式________________________________________。
(2)混合溶液的主要成分除NaOH外,还有_____________________(填化学式)。
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在______________的范围内。
(4)加氨水调至pH=6,此时发生反应的离子方程式为_____________________________________。
(5)写出草酸钇隔绝空气加热生成Y2O3的化学方程式_____________________________________。
20.(12分)硫及其化合物转化是资源利用和环境保护的重要研究课题。
11
(1)已知S的燃烧热为297kJ/mol,H2S完全燃烧的热化学方程式为:
H2S(g) + 3/2O2(g)=SO2(g) +H2O (l) △H=﹣586.0kJ/mol,
则H2S不完全燃烧生成固态硫和液态水的热化学方程式为① 。
以H2S完全燃烧反应组成固体氧化物燃料电池的负极反应式为② 。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g) 2SO3(g)
①工业生成过程中,SO2和O2的转化率 (填“前者大”、“后者大”、“一样大”或“无法判断”)。
②在容积为2.0L恒温(T1℃)恒容密闭容器甲中充入2molSO2和1.2molO2进行上述反应。测得部分数据如下表,前20s平均反应速率υ(O2)= ,该温度下的平衡常数K= 。
t/s
0
10
20
30
40
n(SO3)/mol
0
0.6
1.0
1.2
1.2
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 的H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
21. (12分)化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
11
已知:RCOOHRCOCl;D与FeCl3溶液能发生显色反应。
请回答下列问题:
(1)A→B的反应类型是_______________。D→E的反应条件是_______________,
(2)有关G的下列说法正确的是________。
A.属于芳香烃 B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应 D.1 mol G最多可以跟4 mol H2反应
(3)E的结构简式为_________________________。
(4)F与足量NaOH溶液充分反应的化学方程式为_______________________________________。
(5)E的同分异构体很多种,其中同时符合下列条件的同分异构体有________种。
①与E具有相同官能团 ②苯环上有两种不同化学环境的氢原子
(6)写出由A制备乙二醇的合成路线(其他试剂任选)合成路线流程图示例如下:
______________________________________________________________________________
湖南省湘东五校联盟2018年上期高二联考
化学解析
总分:100分 时量:90分钟 考试时间2018年7月8日
由 株洲二中 浏阳一中 攸县一中 株洲八中 醴陵一中 联合命题
一、选择题(本题共16小题,每小题3分,共48分。)
1.【答案】A【解析】生产玻璃原料为石灰石、纯碱和石英,生产水泥原料为石灰石和黏土,A正确;12C和14C互为同位素,B错;煤的气化是化学变化,C错;制备单晶硅涉及氧化还原反应,D错。
2.【答案】C【解析】A选项N原子的质量数和质子数写反了,A错;HCl是共价化合物,B错;NH3结构式正确;D选项Cl-最外层电子数为8,D错。
3.【答案】B【解析】1molH2O所含电子数为10NA,A正确;等物质的量的C2H4和CO不一定是1mol,B错; Fe与过量的稀HNO3
11
反应,生成硝酸铁,C正确;氧气和臭氧的混合物32g中,含氧原子2mol,D正确。
4.【答案】A【解析】浓硫酸在与含有水分的蔗糖作用过程中,实验开始时,浓硫酸吸水放热,体现浓硫酸吸水性;接着蔗糖炭化,体现浓硫酸脱水性;反应放出刺激性气味的气体,体现浓硫酸强氧化性;反应中没有生成硫酸盐,不体现酸性。
5.【答案】C【解析】X、Y、Z分别为碳、镁、硅三种元素,C和Si可以形成SiC,形成共价化合物,A正确;碳元素非金属性比硅强,其氢化物稳定性更强,B正确;原子半径是Cc(CH3COO-)>c(OH-)>c(H+),D错误。
16.【答案】C【解析】由题意知Ca2+物质的量即为H2C2O4物质的量,n(Ca2+)=n(H2C2O4)==mol=4.0×10-3mol
w(Ca2+)=×100%=×100%=40%
二、填空题(本题共5小题,共52分)
17.(8分)【答案】(1)NaHCO3(1 分) Fe(1 分)
(2) Na+[]2-Na+(1 分) 离子键、(极性)共价键(1 分)(答全才给分)
(3)NaHCO3+ NaOH= H2O + Na2CO3(2 分)
(4)3Fe3O4+28H++NO===9Fe3++NO↑+14H2O(2 分)
【解析】(1)依题干信息,B为NaHCO3,X为碳,据框图关系便可推出E为Na2CO3(2) 因A与B按1:1比例溶于水只得E,故A为NaOH,A与C按任意比溶于水放出D同时只得一种溶质,推得C为 Na2O2(3)(4)G为冶炼铁的原料,根据框图关系,推得F为Fe,G为Fe3O4。不难写出A与B反应生成E的化学方程式:NaHCO3+ NaOH= H2O + Na2CO3,G与稀硝酸反应的离子方程式:3Fe3O4+28H++NO===9Fe3++NO↑+14H2O
18.(10分)【答案】(1)去除水中溶解氧(1 分)
(2)NaOH溶液(1 分) (3)打开(1 分) 排除试管Ⅰ和Ⅱ中空气(2 分)
(4)夹紧(1 分) 用小试管收集少量氢气,将试管移近火焰,移开拇指点火,如果听到轻微的爆鸣声,说明纯净.(2 分)
(5)试管Ⅰ中产生H2使压强大于大气压(2 分)
【解析】本题为实验制备题。本实验中制备的Fe(OH)2易被O2氧化,故所用溶液要排除氧气的影响。故操作为在试管Ⅰ中加入铁粉和稀H2SO4,打开止水夹,产生的H2将整个装置中的空气排尽后,再将止水夹夹紧,则试管Ⅰ中产生的H2将试管Ⅰ中的FeSO4溶液压入试管中Ⅱ的NaOH溶液中,生成白色的沉淀Fe(OH)2。
19.(10分)【答案】(1)+3(1 分) BeO+2NaOHNa2BeO2 +H2O(2 分)
(2)Na2SiO 3 、Na2BeO2 (2 分)(答对一个给1分,有错不给分)
(3)3.7~6.0(1 分) (4)Y3+ +3NH3·H2O ==Y(OH)3↓+3NH4+(2 分)
11
(5)Y2(C2O4)3Y2O3 +3CO↑+3CO2 ↑(2 分)
【解析】(1)根据化合价代数和为0,Y的化合价为;根据信息铍与铝的化学性质相似,得出:BeO+2NaOHNa2BeO2 +H2O
(2)钇矿石可表示为Y2O3·FeO·2BeO·SiO2,由流程可知溶液中还含有Na2SiO 3 、Na2BeO2
(3)三价铁离子开绐沉淀至沉淀完全范围为2.7~3.7,钇离子开绐沉淀至沉淀完全范围为6.0~8.2,故使三价铁离子沉淀完全而钇离子不沉淀范围为3.7~6.0
(4)由较强碱制较弱碱,不妨得出:Y3+ +3NH3·H2O ==Y(OH)3↓+3NH4+
(5)在隔绝空气条件下加热分解生成,故Y2(C2O4)3Y2O3 +3CO↑+3CO2 ↑
20.(12分)【答案】
⑴H2S(g)+1/2 O2(g)===S(s) +H2O(l) △H=-289kJ/mol (2分)
H2S + 3O2--6e-===SO2 + H2O (2分)
⑵①前者大(1分) ②0.0125mol/(L·S) (2分),7.5 (2分)
⑶①0.043 (1分) ②5(2分)
【解析】⑴考查盖斯定律,由流程H2S→S→SO2便可得出:H2S(g)+1/2 O2(g)===S(s) +H2O(l) △H=-289kJ/mol;根据负极发生氧化反应,O2-导电可得负极反应:H2S + 3O2--6e-===SO2 + H2O ⑵考查可逆反应的速率与限度,工业生产中增加O2的浓度来提高SO2的转化率,故:SO2和O2的转化率前者大;根据图表物质的量变化、时间及体积求出前20s平均反应速率υ(O2)=0.0125mol/(L·S) ,再依据平衡时K=求出该温度下的平衡常数K=7.5 ⑶物料守恒与Ksp的计算,依图像pH=13时,c(S2-)=0.057mol·L-1则溶液中的c(H2S)+c(HS-)=0.1mol·L-1-0.057mol·L-1=0.043mol·L-1;由Ksp(MnS)=2.8×10-13,则某溶液含0.020 mol·L-1Mn2+开始沉淀时c(S2-)=1.4×10-11mol·L-1,再依图像得出pH=5
21. (12分)【答案】
(1)氧化反应(1分) 浓硫酸,加热(1分) (2)CD(2分)(答对一个给1分,有错不给分)
(3) (2分)
(4) +3NaOH +CH3COONa+CH3OH+H2O(2分)
(5)3种(2分) (6) (3分)
11
(每对一步,给1分;条件不对,酌情扣分)
【解析】 根据A、B、C和CH3COCl之间的转化条件,并结合已知信息“RCOOHRCOCl”,可推知:A为CH3CH2OH,B为CH3CHO,C为乙酸;由“E和H反应生成F”可知E为,则D为。(1)A→B的反应类型是明显为醇氧化为醛,即为氧化反应,D→E的反应为酯化反应条件为浓硫酸、加热。(2)A项,G除了C、H元素外还有O元素,A错误;B项,G分子结构中没有酚羟基,B错误;C项,G分子结构中有羟基、酯基、碳碳双键和苯环,故可以发生水解、加成、氧化、酯化等反应,C正确;D项,一个分子中含有一个苯环和一个碳碳双键,故1 mol G最多可以跟4 mol H2反应,D正确。(4)F分子结构中含有两个酯基与NaOH溶液发生水解反应,并且要注意其中一个酯基水解后生成酚羟基,能继续与NaOH溶液发生反应。(5)①发生水解反应,说明分子中含有酯基,②与FeCl3溶液能发生显色反应,说明分子中含有酚羟基,③苯环上有两种不同化学环境的氢原子,说明苯环上有两个取代基且位于对位,由此可判断满足条件E的同分异构体有三种 。(6)根据所提供的原料与目标物质,可以确定为一元合成二元必须通过消去与加成,便可顺利写出合成路线流程图。
11