- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】江苏省江都区大桥高级中学2019-2020学年高二6月学情调研
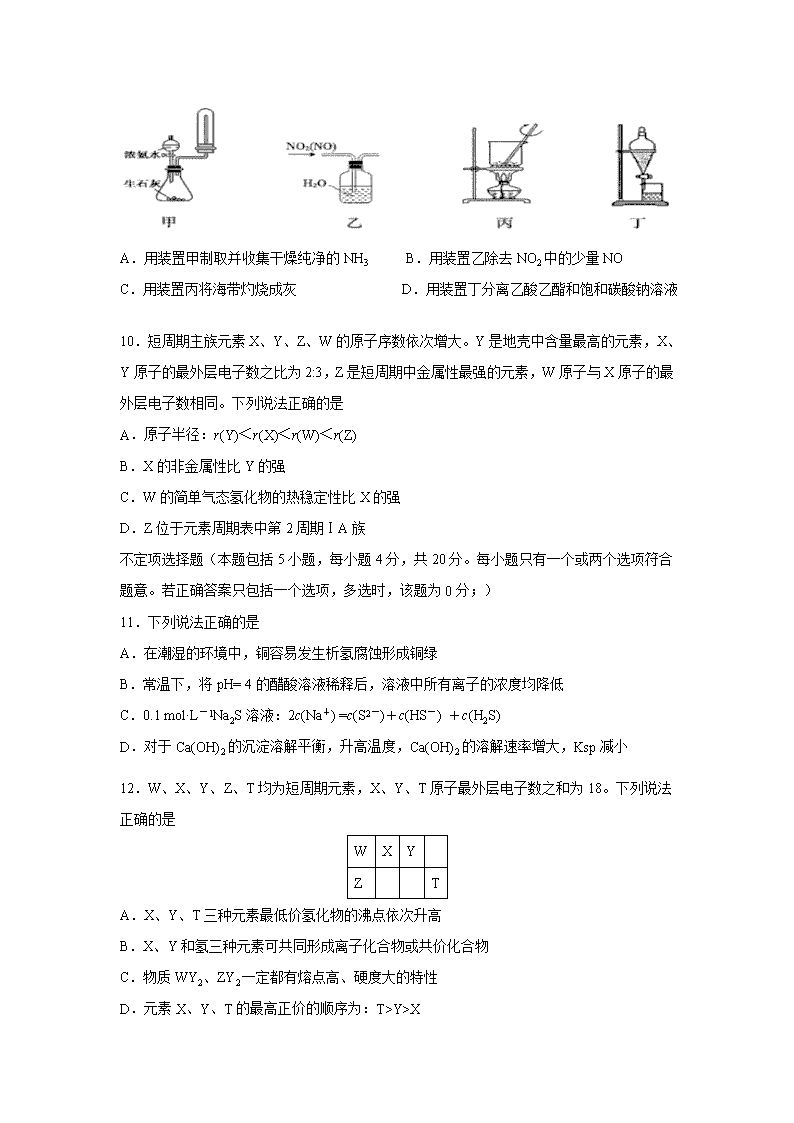
江苏省江都区大桥高级中学2019-2020学年高二6月学情调研 1、本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分,考试时间90分钟。 2、本试卷可能用到的相对原子质量 C:12 H :1 O:16 N:14 Mn-55 第I卷(选择题 共40分) 单项选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意) 1.化学与环境、材料、信息、能源关系密切,下列说法正确的是 A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 B.绿色化学的核心是利用化学原理治理环境污染 C.分馏法提炼汽油 D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 2.下列有关化学用语表示正确的是 A.CH2F2的电子式: B.羟基的电子式: C.对硝基甲苯的结构简式: D.异丙醇的结构简式:CH3CH2CH2OH 3.下列有关工业生产叙述正确的是 A.电解精炼铜时,将粗铜与电源的负极相连 B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 D.工业上通常使用电解法制备金属钠、镁、铝等 4.下列物质性质与应用对应关系正确的是 A.漂白粉在空气中不稳定,可用于漂白纸张 B.医用酒精能使蛋白质变性,可用于消毒杀菌 C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀 5.25℃时,下列各组离子在指定溶液中一定能大量共存的是 A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO42- B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3- C.使甲基橙变红色的溶液中:Fe2+、K+、NO3-、SO42- D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl- 6.设NA为阿伏加德罗常数的值。下列说法正确的是 A.常温下,0.05 mol·L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA B.1 mol氯气和足量NaOH溶液反应转移的电子数目为2NA C.常温下,9.2 g NO2和N2O4的混合气体中含有的氮原子数目为0.2 NA D.标准状况下,22.4 L甲苯中含C-H数目为8 NA 7. 下列物质的转化在给定条件下能实现的是 ① ② ③ ④ ⑤ A. ①⑤ B. ②③ C. ②⑤ D. ③④ 8.下列离子方程式中,正确的是 A.用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑ B.碳酸钠溶液显碱性:CO32—+H2OHCO3—+OH— C.氯气通入冷水中:Cl2 +H2O Cl- +ClO- +2H+ D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O 9.下列装置进行相应的实验,能达到实验目的的是 A.用装置甲制取并收集干燥纯净的NH3 B.用装置乙除去NO2中的少量NO C.用装置丙将海带灼烧成灰 D.用装置丁分离乙酸乙酯和饱和碳酸钠溶液 10.短周期主族元素X、Y、Z、W的原子序数依次增大。Y是地壳中含量最高的元素,X、Y原子的最外层电子数之比为2:3,Z是短周期中金属性最强的元素,W原子与X原子的最外层电子数相同。下列说法正确的是 A.原子半径:r(Y)<r(X)<r(W)<r(Z) B.X的非金属性比Y的强 C.W的简单气态氢化物的热稳定性比X的强 D.Z位于元素周期表中第2周期ⅠA族 不定项选择题(本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;) 11.下列说法正确的是 A.在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 B.常温下,将pH= 4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 C.0.1 mol·L-1Na2S溶液:2c(Na+) =c(S2-)+c(HS-) +c(H2S) D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 12.W、X、Y、Z、T均为短周期元素,X、Y、T原子最外层电子数之和为18。下列说法正确的是 W X Y Z T A.X、Y、T三种元素最低价氢化物的沸点依次升高 B.X、Y和氢三种元素可共同形成离子化合物或共价化合物 C.物质WY2、ZY2一定都有熔点高、硬度大的特性 D.元素X、Y、T的最高正价的顺序为:T>Y>X 13.下列说法正确的是 A.MgO、Al2O3是耐高温材料,工业上常用其电解冶炼对应的金属 B.常温,4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的△H<0 C.NaHR(H2R为二元弱酸)溶液的酸碱性取决于HR-的电离程度和水解程度的相对大小 D.催化剂能改变反应的活化能和焓变 14.下列根据实验操作和现象所得出的结论正确的是 选项 实验操作 实验现象 结 论 A 用铂丝蘸取溶液进行焰色反应 火焰呈黄色 溶液中无K+ B 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 溶液中一定含有SO42- C 向一定浓度的CuSO4溶液中通入适量H2S气体 出现黑色沉淀 H2S的酸性比H2SO4强 D 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+ 15.氮氧化物与悬浮在大气中海盐粒子的相互反应: 4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+ Cl2(g),ΔH 在恒温条件下,向2 L恒容密闭容器中加入0.4mol NO2和0.2 mol NaCl,10 min反应达到平衡时n(NaNO3)= 0.1mol,NO2的转化率为α。下列叙述中正确的是 A.10min内NO浓度变化表示的速率v(NO)=0.01 mol·L-1·min-1 B.若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于α C.若升高温度,平衡逆向移动,则该反应的ΔH>0 D.若起始时向容器中充入NO2(g) 0.1 mol、NO(g)0.2 mol和Cl2(g)0.1 mol(固体物质足量),则反应将向逆反应方向进行 非 选 择 题 (共60分) 16.(12分)工业上制备K2FeO4的流程如下: (1)配制FeSO4溶液时,需加入铁粉和稀硫酸,试说明加铁粉的原因 , 加稀硫酸原因 。 (2)用饱和KOH溶液结晶的原因是 。 (3)洗涤时用乙醚作洗涤剂的原因是 。 (4)经测定第一、二次氧化时的转化率分别为a和b,结晶时的转化率为c,若要制备d Kg的K2FeO4,则需要FeSO4·7H2O Kg。(K2FeO4的相对分子质量是198;FeSO4·7H2O的相对分子质量是278;答案用分数表示) (5)电解法也能制备K2FeO4。用KOH溶液作电解液,在阳极可以将铁氧化成FeO42-,试写出此时阳极的电极反应式 。 17.(12分)碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下。 (1) “氧化”时若Cl2过量,则会将I2氧化为HIO3,写出该反应的化学方程 式 。 (2)“吹出”在吹出塔中进行,含碘卤水从 (填“塔顶”或“塔底”)进入, 请解释这样做的原因 (3)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为 ;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、IO进入水溶液;分液后再酸化,即得粗碘。加入NaOH后溶液中I-、IO的物质的量之比为 。 (4)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为 IO,再将其与卤水按一定比例混合、酸化制取粗碘。处理含I-为254 mg/L的卤水1m3,理论上需20%的H2O2 g。 18.(12分)硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题: (1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式 。 (2)上述制备过程中,检验沉淀洗涤是否完全的方法是 。 (3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式 。 (4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程) 19.(12分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。 (1)已知:SO2 (g) +Cl2 (g)+ SCl2 (g)2SOCl2 (g) △H=a kJ·mol-1 SO2Cl2(g)+ SCl2 (g) 2SOCl2(g) △H=b kJ·mol-1 则反应:SO2(g) + Cl2(g)SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示); 该反应平衡常数表达式为K = 。 (2)磺酰氯可与白磷发生反应为:P4 + 10 SO2Cl2 = 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。 (3)某学习小组的同学依据反应:SO2(g)+ Cl2(g)SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。 吸滤瓶 ①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为 。 ②有关图-1所示的装置说法正确的是 (不定项选择)。 a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液 b.B处反应管内五球中玻璃棉上的活性炭作催化剂 c.B处反应管冷却水应从m接口通入 d.装置C处吸滤瓶应放在冰水中冷却 e.D处U形管中盛放的可能是碱石灰 (4)Li-SO2Cl2军用电池,如图-2所示,已知电池反应为:2Li + SO2Cl2 = 2LiCl + SO2↑ ;则电池工作时,正极的电极反应式为 。 20.(12分)铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂。 (1)Fe基态原子核外电子排布式为 。 (2)H、N、O的电负性从小到大的顺序是 。 (3)与NO2+互为等电子体的一种分子为 (填化学式)。 氨基(-NH2)中氮原子的杂化类型为 。 (4)1mol苯胺分子中含有σ键的数目为 。 (5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为 。 参考答案 1 C 2B 3D 4B 5A 6 C 7C 8 B 9D 10A 11 D 12B 13BC 14B 15BD 16. (1)抑制FeSO4的水解 防止FeSO4被氧化 (2)提供K+ (3)减少K2FeO4的损失 (4)139d除以 99abc (5) Fe+8OH--6e-= FeO42-+4H2O 17.(12分) (1)5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl (2)塔顶 因热空气密度小,且气体与溶液逆向接触,有利于提高吹出率 (3)萃取(或萃取 分液) 5∶1 (4)170 18.(12分) (1)2CaO·3B2O3·5H2O(2分) (2)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全。(2分) (3)MgSO4+CO2+2NH3+H2O=MgCO3+(NH4)2SO4(2分) (4)n (B2O3)=0.01mol(1分) n (MgO)=0.02mol (1分) n (H2O) = (1.68 g -0.7 g -0.8 g) /18 g·mol-1= 0.01mol (2分) 故其组成为:Mg2B2O5·H2O或2MgO·B2O3·H2O。(2分) (说明:其它合理解法亦可,B、Mg物质的量各1分,氧、水的物质的量各1分,组成2分) 19.(12分) (1)a-b (2分); c(SO2Cl2)/[c(SO2)·c(Cl2)](2分) (2)2(2分) (3)①MnO2 +4HCl(浓) MnCl2 + Cl2↑ +2H2O(2分) ②bde(2分,漏选得1分,错选不给分) (4)SO2Cl2 + 2e- = 2Cl-+ SO2↑(2分) 20.(12分) (1)[Ar]3d64s2 (2)H<N<O (3)N2O (或CO2、CS2等); sp3 (4)14 mol (5)Fe4N (每空2分) 查看更多