- 2021-07-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019学年高一化学下学期期末考试试题 新 版 新目标
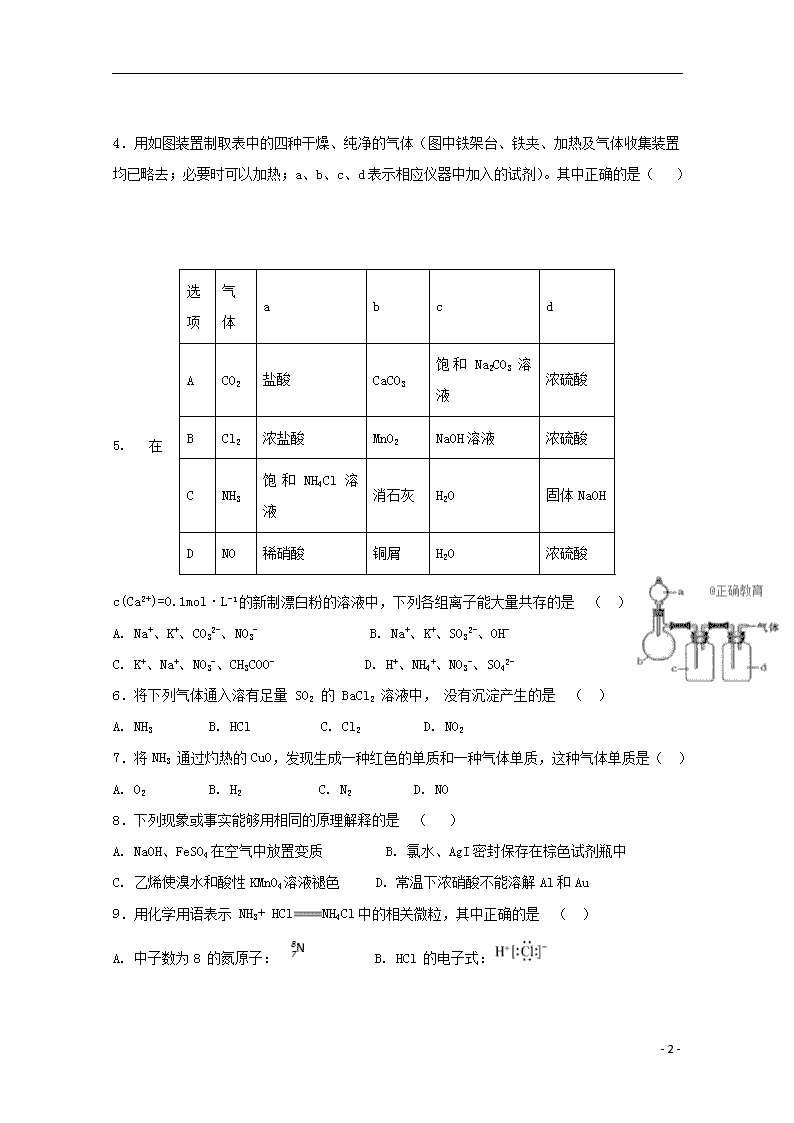
绥化一中2019学年度第二学期期末考试 高一化学试卷 可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 Ca 40 Cu 64 Fe 56 Zn 65 Br 80 Ag 108 I 127 Ba 137 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷共60分,第Ⅱ卷共40分,满分100分,考试时间为90分钟。 第Ⅰ卷 选择题(60分) 一、选择题( 本题有30个小题,每小题只有1个选项正确,每小题2分,共60分。) 1、化学与生活、生产科技密切相关。下列说法错误的是 ( ) A. 单质硅可用于制取通信芯片 B. 《天工开物》中描述:“世间丝、麻、袭、褐皆具素质……文中的丝、麻主要成分是蛋白质 C. 航母上拦阻索中的钢丝属于金属材料 D. 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 2..下列有关从海带中提取碘的实验原理和装置能达到实验目的的是 ( ) A. 用装置甲灼烧碎海带 B. 用装置乙过滤海带灰的浸泡液 C. 用装置丙制备用于氧化浸泡液中I−的Cl2 D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气 3.若NA表示阿伏加德罗常数,则下列说法不正确的是 ( ) A. 23g 钠在空气中充分燃烧,转移的电子数为NA B. 50ml 12mol/L的盐酸与足量的MnO2共热,充分反应后,转移电子数为0.3NA C. 0.6mol过氧化钠晶体中所含阴离子的数目为0.6NA D. 常温常压下,8.8gN2O 和CO2混合气体所含的原子总数为0.6NA - 9 - 4.用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( ) 选项 气体 a b c d A CO2 盐酸 CaCO3 饱和Na2CO3溶液 浓硫酸 B Cl2 浓盐酸 MnO2 NaOH溶液 浓硫酸 C NH3 饱和NH4Cl溶液 消石灰 H2O 固体NaOH D NO 稀硝酸 铜屑 H2O 浓硫酸 5.在c(Ca2+)=0.1mol·L-1的新制漂白粉的溶液中,下列各组离子能大量共存的是 ( ) A. Na+、K+、CO32-、NO3- B. Na+、K+、SO32-、OH- C. K+、Na+、NO3-、CH3COO- D. H+、NH4+、NO3-、SO42- 6.将下列气体通入溶有足量 SO2 的 BaCl2 溶液中, 没有沉淀产生的是 ( ) A. NH3 B. HCl C. Cl2 D. NO2 7.将NH3 通过灼热的CuO,发现生成一种红色的单质和一种气体单质,这种气体单质是( ) A. O2 B. H2 C. N2 D. NO 8.下列现象或事实能够用相同的原理解释的是 ( ) A. NaOH、FeSO4在空气中放置变质 B. 氯水、AgI密封保存在棕色试剂瓶中 C. 乙烯使溴水和酸性KMnO4溶液褪色 D. 常温下浓硝酸不能溶解Al和Au 9.用化学用语表示 NH3+ HClNH4Cl中的相关微粒,其中正确的是 ( ) A. 中子数为8 的氮原子: B. HCl 的电子式: - 9 - C. NH3的结构式: D. Cl−的结构示意图: 10.X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是 ( ) A. 简单气态氢化物稳定性:W >X B. Y元素的相对原子质量为18 C. X2H4的分子中极性键和非极性键数目比为4:l D. 电解Z的熔融氯化物可以冶炼单质Z 11.下列实验方案、现象和结论都合理的是( ) 实验目的 实验方案、现象 结论 A 检验溶液中有无NH4+ 用试管取少量的待检测溶液,加入少量的稀NaOH溶液,用一块湿润的红色石蕊试纸放在试管口 若试纸变蓝,则有NH4+,否则无NH4+ B 检验溶液中有无K+ 用洁净的铂丝蘸取待测液进行焰色反应,火焰呈黄色 原溶液中一定无K+ C 检验溶液中有无SO42- 用试管取少量的待检测溶液,加入稀盐酸无现象,再加入BaCl2 溶液,出现白色沉淀 原溶液中有SO42- D 检验淀粉水解产物有无还原性 用试管取少量的淀粉溶液加入适量的稀硫酸,加热一段时间后,加入少量的新制Cu(OH)2悬浊液,加热至沸腾,产生大量的砖红色沉淀 水解产物有还原性 12.将43.8g Al、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为 ( ) A. 39.2g B. 44.8g C. 58.8g D. 66.4g 13.下列事实不能用元素周期律解释的 ( ) A. 碱性:NaOH>Al(OH)3 B. 相对原子质量:Ar>K C. 酸性:HClO4>HIO4 D. 稳定性:HF>HCl - 9 - 14.下列物质①乙烯,②乙醇,③丙烷,④苯,在一定条件下可以发生加成反应的是 ( ) A. ①④ B. ①② C. ②④ D. ②③ 15.下列说法正确的是 ( ) A. 甲基环已烷一氯代物有4 种 B. 乙二醇与丙三醇互为同系物 C. 蛋白质是仅由碳、氢、氧元索组成的物质 D. 苯的邻二元取代物只有一种,可以证明苯分子中没有单、双键交替结构 16.下列物质中①苯②甲苯③苯乙烯④乙烷⑤乙烯,既能使酸性高锰酸钾溶液褪色也能使溴水因反应而褪色的是 ( ) A. ①②③④ B. ③④⑤ C. ③⑤ D. ②③④⑤ 17.下列反应中前者属于取代反应,后者属于加成反应的是 ( ) A. 光照甲烷与氯气的混合物;乙烯使酸性高锰酸钾溶液褪色 B. 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 C. 苯滴入浓硝酸和浓硫酸的混合液中水浴加热;乙烯与水蒸气在一定条件下反应生成乙醇 D. 在苯中滴入溴水,溴水褪色;乙烯使溴水褪色 18.乙烷中混有少量乙烯气体,欲除去乙烯并得到纯净干燥的乙烷气体,选用的试剂最好是( ) A. 氢氧化钠溶液,浓硫酸 B. 酸性高锰酸钾溶液,浓硫酸 C. 溴水,浓硫酸 D. 饱和碳酸钠溶液,浓硫酸 19.下列说就正确的是 ( ) A. 甲苯的一氯代物有3种 B. 乙烯通入溴的CCl4溶液中,发生加成反应 C. 乙醇不能使酸性高锰酸钾溶液褪色 D. 可以用NaOH溶被来分离乙酸和乙酸乙酯 20.下列用水就能鉴别的一组物质是( ) A. 苯、己烷、四氯化碳 B. 苯、乙醇、四氯化碳 C. 硝基苯、乙醇、四氯化碳 D. 溴苯、乙醇、乙酸 21.欲除去下列物质中混入的少量杂质(括号内物质为杂质),能达到目的的是( ) A. 乙醇(乙酸):加入新制生石灰,蒸馏 B. 苯(溴):加入氢氧化钠溶液,过滤 C. 乙醇(水):加入金属钠,充分振荡静置后,分液 - 9 - D. 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气 22.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) A. 1mol甲基(CH3-)所含的电子数为10NA B. 46g由NO2和N2O4组成的混合气体中,含有的原子总数为3NA C. 常温常压下,1mol分子式为C2H6O的有机物中,含有C-O键的数目为NA D. 标准状况下22.4L四氯化碳中含有C-Cl键的数目为4NA 23.分子式为C5H10O2且可NaHCO3溶液反应生成CO2的有机化合物有(不含立体异构)( ) A. 4种 B. 6种 C. 7种 D. 9种 24.下列对有机物的认识正确的是( ) A. 油脂的水解反应又叫皂化反应 B. 乙醇发生氧化反应生成乙酸,乙酸和乙醇发生取代反应生成乙酸乙酯 C. 分子式为C5H12O的醇类有5种结构 D. 有机物甲的分子式为C3H6,则甲与乙烯(C2H4)互为同系物 25.葡萄酸的结构简式为。下列有关葡萄酸说法不正确的是( ) A. 葡萄酸能发生取代反应 B. 葡萄酸既能与乙醇发生酯化反应,也能与乙酸发生酯化反应 C. 葡萄酸能与Na和NaOH反应 D. 葡萄酸能使溴的四氯化碳溶液褪色 26.下列五种烃:①异戊烷、②新戊烷、③正戊烷、④丙烷、⑤丁烷,按它们的沸点由高到低的顺序排列正确的是( ) A.①>②>③>④>⑤ B.②>③>⑤>④>① C.④>⑤>②>①>③ D.③>①>②>⑤>④ 27.下列冶炼金属的方法错误的是 ( ) A. 加热分解制金属Hg B. 高温下用CO还原赤铁矿炼铁 C. 电解溶液制金属Na D. Fe和溶液湿法炼铜 28.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( ) A.植物油不能使溴的四氯化碳溶液褪色 B.淀粉水解的最终产物是葡萄糖 C.葡萄糖能发生氧化反应和水解反应 - 9 - D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 29.某有机物的结构简式如图所示:下列有关该有机物的叙述正确的是( ) A.该有机物的分子式为C11H14O3 B.该有机物可能易溶于水且具有水果香味 C.该有机物可能发生的化学反应类型有:水解、酯化、氧化、取代 D.1mol该有机物在Ni作催化剂的条件下能与4molH2发生加成反应 30.相同状况下,1molCH3COOH分别与1molC2H518OH和1molC2H516OH发生酯化反应,两者生成水的质量 ( ) A.前者大 B.后者大 C.相等 D.不能判断 第Ⅱ卷 非选择题(40分) 二、 填空题: 31. (9分)I.写出下列反应的化学方程式,并指出反应类型: (1)用乙烯制备聚乙烯:____________________________________;反应类型 。 (2)乙醇在加热有铜作催化剂的条件下反应: ; 反应类型 。 (3)乙酸乙酯在稀硫酸加热条件下水解: ; 反应类型 。 II.现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH 请回答: (1)写出⑤的官能团的名称______。 (2)与①互为同系物的是______(填序号)。 (3)写出④ 的同分异构体的结构简式________________。 三、推断题: 32.(13分)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白: - 9 - (1)在这些元素中,化学性质最不活泼的是 (填元素符号,下同)。 (2)从①到③的元素中,非金属性最强的是________ (3)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强 的化合物的电子式是_________。 (4) 最高价氧化物是两性氧化物的元素是 ;写出它的最高价氧化物与氢氧化 钠反应的离子方程式 。 (5) 用结构式表示元素①与③形成的一种可溶于水的化合物_________ 。 (6)写出元素④的单质与水反应的化学方程式 。 (7)写出元素①的单质和元素⑥最高价氧化物对应水化物的浓溶液反应的化学方程 式 。 四、实验题: 33.(8分)利用海水可以提取溴和镁,提取过程如下: (1)提取溴的过程中,经过2次转化的目的是__________,吸收塔中发生反应的离子方程式是 ,蒸馏塔中发生反应的离子方程式是___________ _。 (2)从溶液中得到晶体的主要操作是__________、_________、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是_____ _____。 (3)据上述流程,将海水中溴元素(海水中离子含量为)转化为工业溴,整个流程中至少需要标准状况下的体积为_________L(忽略溶解)。 34.(10分)实验室制备硝基苯的主要步聚如下: ①配制一定比例的浓硫酸和浓硝酸的混合酸,加入反应器中。 - 9 - ②向室温下混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。 ③在50℃~60℃下发生反应。 ④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤。 ⑤将无水氯化钙干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。 (1) 配制一定比例浓硝酸和浓硫酸混合酸时,操作要注意的事项是____________________。 (2)步骤③中,为了使反应在50℃~60℃下进行,常用方法是________________________。 (3)步骤④中,洗涤、分离粗硝基苯应使用的仪器是_____________________________________。 (4)步骤④中,粗产品用5%的NaOH溶液洗涤的目的是_____________________________。 (5)纯硝基苯是无色、密度比水________(填“大”或“小”),具有________气味的油状液体。 - 9 - 期末考试高一化学试题 答案 一、 选择题 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 答案 B B B D C B C B C C C C B A D 题号 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 答案 C C C B B A B A B D D C B D C 31. (9分) I.(1)nCH2=CH2 加聚反应 (2)2CH3CH2OH+O22CH3CHO+2H2O 氧化反应 (3) CH3COOCH2CH3+H2O 稀硫酸 CH3COOH+ CH3CH2OH 取代反应 II. (1)羧基 (2) ④ (3) CH3 CH (CH3 )CH3 32.(13分)(1)Ar (2)O (3) HClO4 (4)Al Al2O3+ 2OH﹣=2AlO2﹣+H2O (5) O=C=O (6)2Na+2H2O=2NaOH+H2↑ (7)C+2H2SO4(浓) =CO2↑+2SO2↑+2H2O 33.(1)对溴元素进行富集 (2) 加热浓缩 冷却结晶 (3) 179.2 34.(8分)(1)先将浓硝酸注入容器,再缓缓注入浓硫酸,并及时搅拌和冷却 (2)将反应器放在50℃~60℃的水浴中加热 (3)分液漏斗 (4)除去粗产品中残留的硝酸和硫酸 (5)大 苦杏仁 - 9 -查看更多