- 2021-07-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习水溶液中的离子平衡作业(全国通用)
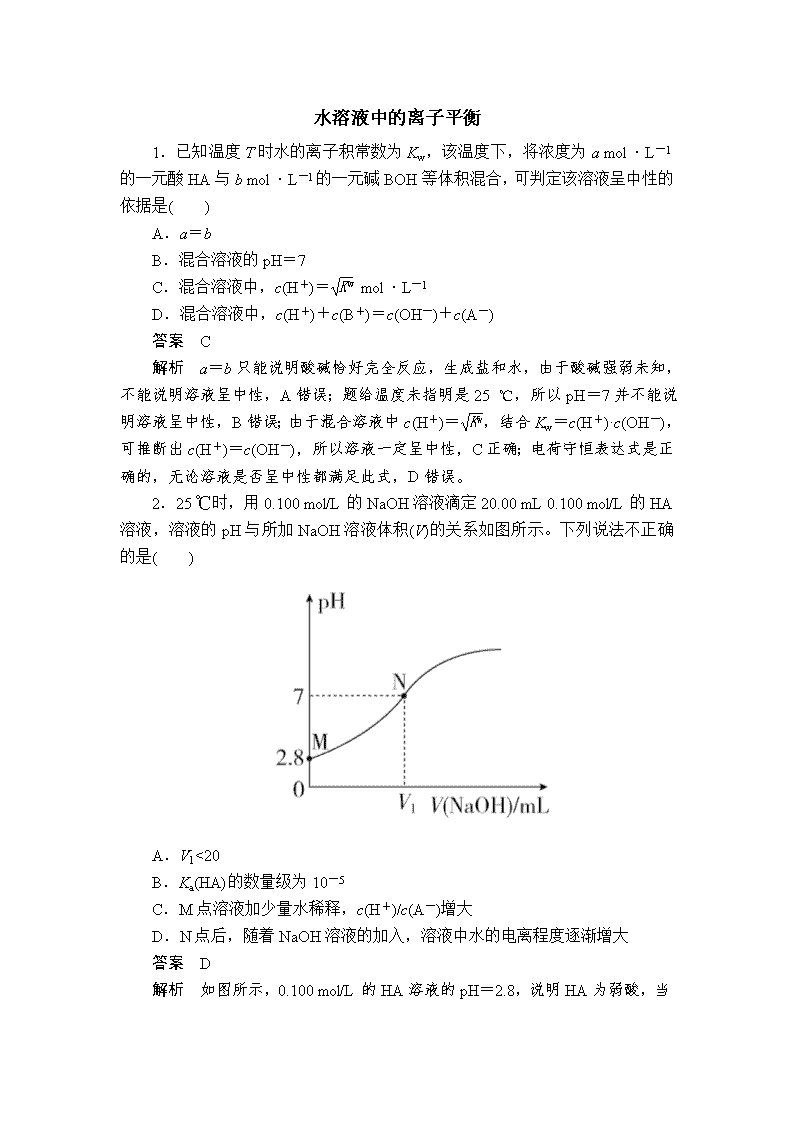
水溶液中的离子平衡 1.已知温度 T 时水的离子积常数为 Kw,该温度下,将浓度为 a mol·L-1 的一元酸 HA 与 b mol·L-1 的一元碱 BOH 等体积混合,可判定该溶液呈中性的 依据是( ) A.a=b B.混合溶液的 pH=7 C.混合溶液中,c(H+)= Kw mol·L-1 D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) 答案 C 解析 a=b 只能说明酸碱恰好完全反应,生成盐和水,由于酸碱强弱未知, 不能说明溶液呈中性,A 错误;题给温度未指明是 25 ℃,所以 pH=7 并不能说 明溶液呈中性,B 错误;由于混合溶液中 c(H+)= Kw,结合 Kw=c(H+)·c(OH-), 可推断出 c(H+)=c(OH-),所以溶液一定呈中性,C 正确;电荷守恒表达式是正 确的,无论溶液是否呈中性都满足此式,D 错误。 2.25 ℃时,用 0.100 mol/L 的 NaOH 溶液滴定 20.00 mL 0.100 mol/L 的 HA 溶液,溶液的 pH 与所加 NaOH 溶液体积(V)的关系如图所示。下列说法不正确的 是( ) A.V1<20 B.Ka(HA)的数量级为 10-5 C.M 点溶液加少量水稀释,c(H+)/c(A-)增大 D.N 点后,随着 NaOH 溶液的加入,溶液中水的电离程度逐渐增大 答案 D 解析 如图所示,0.100 mol/L 的 HA 溶液的 pH=2.8,说明 HA 为弱酸,当 HA 与 NaOH 恰好反应完时,所得到的溶液 pH>7,当滴定到 pH=7 时,表明消 耗的 V(NaOH)<20 mL,A 正确;Ka(HA)=c(H+)·c(A-) c(HA) =10-2.8×10-2.8 0.1-10-2.8 ≈ 10-5.6 0.1 =10-4.6=100.4×10-5,B 正确;M 点溶液存在两个电离:HA H++A-, H2O H++OH-,加水稀释时,c(H+)减小的程度比 c(A-)减小的程度小, c(H+) c(A-) 增大,C 正确;N 点后,加入 NaOH 溶液生成 NaA 的过程中,水的电离 程度是逐渐增大的,恰好变为 NaA 溶液后,继续滴加 NaOH 溶液,水的电离程 度是逐渐减小的,D 错误。 3.室温下,下列溶液中微粒浓度关系一定正确的是( ) A.0.1 mol/L Na2CO3 溶液,加水稀释,c(HCO- 3 ) c(CO2- 3 ) 减小 B.pH=7 的氨水与氯化氨的混合溶液中:c(Cl-)>c(NH+ 4 ) C.0.1 mol/L 的硫酸铝溶液中:c(SO2- 4 )>c(Al3+)>c(H+)>c(OH-) D.pH=2 的醋酸溶液和 pH=12 的 NaOH 溶液等体积混合:c(Na + )= c(CH3COO-)+c(CH3COOH) 答案 C 解析 Na2CO3 溶液中存在碳酸根离子的水解平衡,CO2- 3 +H2O HCO- 3 + OH-,c(HCO- 3 ) c(CO2- 3 ) = Kh c(OH-),加水稀释,溶液的碱性减弱,但水解平衡常数(Kh) 不变,因此c(HCO- 3 ) c(CO2- 3 ) 增大,A 错误;氨水与氯化铵的混合溶液存在电荷守恒: c(OH-)+c(Cl-)=c(NH+ 4 )+c(H+),室温下,混合液 pH=7,则 c(OH-)=c(H+), 故 c(Cl-)=c(NH+ 4 ),B 错误,硫酸铝溶液中铝离子水解,溶液显酸性,则 c(SO2- 4 ) >c(Al3+)>c(H+)>c(OH-),C 正确;醋酸的浓度大于氢氧化钠的浓度,等体积 混合后醋酸过量,c(Na+)<c(CH3COO-)+c(CH3COOH),D 错误。 4.下列关于溶液的说法错误的是( ) ①NaHCO3 溶液加水稀释, c(Na+) c(HCO- 3 ) 增大 ②浓度均为 0.1 mol·L-1 的 Na2CO3、NaHCO3 混合溶液:2c(Na+)=3[c(CO2- 3 ) +c(HCO- 3 )] ③在 0.1 mol·L-1 氨水中滴加 0.1 mol·L-1 盐酸,恰好中和时溶液的 pH=a, 则由水电离产生的 c(OH-)=10-a mol·L-1 ④向 0.1 mol·L-1 Na2SO3 溶液中加入少量 NaOH 固体,c(Na+)、c(SO2- 3 )均增 大 ⑤Na2S 稀溶液中:c(H+)=c(OH-)+c(H2S)+c(HS-) A.②⑤ B.①③④ C.①③ D . ③ ④ 答案 A 解析 加水稀释 NaHCO3 溶液,促进 HCO - 3 的水解,n(HCO- 3 )减少,而 n(Na +)不变, c(Na+) c(HCO- 3 ) 增大,①正确;Na2CO3、NaHCO3 物质的量浓度相同,相 当于按物质的量 1∶1 混合,根据 Na 和 C 守恒,有 2c(Na+)=3[c(CO2- 3 )+c(HCO- 3 ) +c(H2CO3)],②不正确;0.1 mol·L-1 氨水中滴加 0.1 mol·L-1 盐酸,恰好中和生 成 NH4Cl,NH4Cl 溶液中由水电离产生的 c(OH-)与溶液中的 c(H+)相等,c(OH-) 水=c(H+)=10-a mol·L-1,③正确;加入少量 NaOH 固体,c(Na+)增大,c(OH-) 增大,使 SO2- 3 +H2O HSO- 3 +OH-平衡逆向移动,c(SO2- 3 )增大,④正确;根 据质子守恒,有 c(OH-)=c(H+)+2c(H2S)+c(HS-),⑤不正确。 5.已知部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数(25 ℃) K=1.77×10-4 K=5.0×10-10 K1=4.3×10-7 K2=5.6×10-11 下列叙述错误的是( ) A.NaCN 溶液中通入少量 CO2 发生的离子反应为:CN-+H2O+CO2===HCN +HCO- 3 B.等体积、等物质的量浓度的 HCOONa 和 NaCN 溶液中所含阴离子总数 前者大于后者 C.等物质的量浓度的 NaHCO3 和 Na2CO3 混合溶液中:c(Na + )>c(OH -)>c(HCO- 3 )>c(CO2- 3 )>c(H+) D.中和等体积、等 pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的 量前者小于后者 答案 C 解析 向 NaCN 溶液中通入少量 CO2,因为酸性:H2CO3>HCN>HCO- 3 ,故 反应生成 HCN 和碳酸氢钠,不能生成 CO2- 3 ,反应的离子方程式为:CN-+H2O +CO2===HCN+HCO- 3 ,A 正确;根据电荷守恒定律:c(Na+)+c(H+)=c(OH-) +c(CN-)和 c(Na+)+c(H+)=c(OH-)+c(HCOO-),由于甲酸的酸性大于 HCN, 所以等物质的量浓度的 HCOONa 和 NaCN 溶液,NaCN 溶液水解能力强,c(OH -)较大,c(H+)相对较小,由于两溶液 c(Na+)相等,所以 HCOONa 溶液中所含阴 离子总数大于 NaCN 溶液所含阴离子总数,B 正确;碳酸钠溶液中碳酸根离子水 解 能 力 大 于 碳 酸 氢 钠 溶 液 中 碳 酸 氢 根 离 子 水 解 能 力 , 所 以 溶 液 中 c(HCO- 3 )>c(CO2- 3 );由于溶液中的 c(OH-)主要是由 c(HCO- 3 )和 c(CO2- 3 )水解产生 的,所以 c(HCO- 3 )>c(CO2- 3 )>c(OH-),C 错误;由于酸性 HCOOH 大于 HCN,所 以等体积、等 pH 的 HCOOH 溶液和 HCN 溶液,HCN 溶液的浓度较大,HCN 溶质的量较大,消耗 NaOH 的物质的量较多,即中和等体积、等 pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的量前者小于后者,D 正确。 6.常温下,下列说法不正确的是( ) A.0.2 mol·L-1 的 NaHCO3 溶液中:c(Na+)>c(HCO- 3 )>c(OH-)>c(H+) B.0.02 mol·L-1 的 NaOH 溶液与 0.04 mol·L-1 的 NaHC2O4 溶液等体积混合: 2c(OH-)+c(C2O2- 4 )=c(HC2O- 4 )+2c(H+) C.叠氮酸(HN3)与醋酸酸性相近,0.1 mol·L-1 NaN3 水溶液中离子浓度大 小顺序为:c(Na+)>c(N- 3 )>c(OH-)>c(H+) D.向氨水中逐滴滴入盐酸至溶液的 pH=7,则混合液中 c(NH+ 4 )=c(Cl-) 答案 B 解析 NaHCO3 溶液呈碱性,溶液中离子浓度关系为 c(Na+)>c(HCO- 3 )>c(OH -)>c(H+),A 正确;混合后得到等物质的量浓度的 Na2C2O4、NaHC2O4 的混合溶 液,根据电荷守恒得:c(OH-)+ 2c(C2O2- 4 )+c(HC2O- 4 )=c(Na+)+c(H+),根据物 料守恒得:2c(Na+)=3[c(C2O2- 4 )+c(HC2O- 4 )+c(H2C2O4)],消去 c(Na+),得:2c(OH -)-c(C2O2- 4 )=c(HC2O- 4 )+3c(H2C2O4)+2c(H+),B 错误;NaN3 为强碱弱酸盐, N - 3 水解使溶液呈碱性,c(Na+)>c(N- 3 )>c(OH-)>c(H+),C 正确;根据电荷守恒得: c(NH+ 4 )+c(H+)=c(Cl-)+c(OH-),pH=7,则 c(OH-)=c(H+),故 c(NH+ 4 )=c(Cl -),D 正确。 7.在一隔热系统中,向 20.00 mL 0.01000 mol·L-1 的醋酸溶液中逐滴加入 0.01000 mol·L-1 的 NaOH 溶液,测得混合溶液的温度变化如下图所示。下列相关 说法错误的是( ) A.从 b 点到 c 点的溶液中:c(CH3COOH) c(CH3COO-) 逐渐减小 B.a 点对应溶液中存在:c(CH3COO-)-c(Na+)=c(H+)-c(OH-) C.b 点和 c 点对应的溶液中,Kw 相同 D.b 点溶液中存在:c(OH-)=c(CH3COOH)+c(H+) 答案 C 解析 b 点醋酸与氢氧化钠恰好反应生成醋酸钠,醋酸钠溶液中存在水解平 衡:CH3COO-+H2O CH3COOH+OH-,继续加入氢氧化钠,氢氧根离子浓 度增大,使水解平衡左移,则从 b 点到 c 点的溶液中:c(CH3COOH) c(CH3COO-) 逐渐减小, A 正确;a 点溶液中溶质为等浓度的醋酸和醋酸钠,据电荷守恒有 c(Na+)+c(H+) =c(CH3COO-)+c(OH-),即 c(CH3COO-)-c(Na+)=c(H+)-c(OH-),B 正确;b 点和 c 点对应的溶液温度不同,Kw 不相同,C 错误;b 点醋酸与氢氧化钠恰好反 应生成醋酸钠,醋酸钠溶液中存在质子守恒:c(OH-)=c(CH3COOH)+c(H+),D 正确。 8.已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的 pH, 纵坐标为 Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。25 ℃时,下列说法中不正 确的是( ) A.往 ZnCl2 溶液中加入过量氢氧化钠溶液,反应的离子方程式为 Zn2++4OH -===[Zn(OH)4]2- B.若要从某废液中完全沉淀 Zn2+,通常可以调控该溶液的 pH 在 8.0~12.0 之间 C.pH=8.0 与 pH=12.0 的两种废液中,Zn2+浓度的比值为 108 D.该温度时,Zn(OH)2 的溶度积常数(Ksp)为 1×10-10 答案 D 解析 根据图像,往 ZnCl2 溶液中加入过量 NaOH 溶液,Zn2 + 最终以 [Zn(OH)4]2-的形式存在,故离子方程式为:Zn2++4OH-===[Zn(OH)4]2-,A 正确; 控制溶液的 pH 在 8.0~12.0 之间时,可以将该废液中的 Zn2+完全沉淀,B 正确; 由 a 点可知 pH=7.0 即 c(OH-)=10-7 mol·L-1 时,lg c(Zn2+)=-3.0,即 c(Zn2+) =10-3 mol·L-1,则 Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=10-17,pH =8.0 即 c(OH-)=10-6 mol·L-1 时,c(Zn2+)=Ksp[Zn(OH)2] c2(OH-) = 10-17 (10-6)2 mol·L - 1 =10 - 5 mol· L - 1 ,pH = 12.0 即 c(OH - )= 10 - 2 mol·L - 1 时 , c(Zn2 + )= Ksp[Zn(OH)2] c2(OH-) = 10-17 (10-2)2 mol·L-1=10-13 mol·L-1,故两种废液中 Zn2+浓度 的比值为 10-5 10-13 =108,C 正确,D 错误。 9.一定温度下,下列溶液的离子浓度关系式正确的是( ) A.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1 B.pH=a 的氨水,稀释 10 倍后,其 pH=b,则 a=b+1 C.pH=2 的 H2C2O4 溶液与 pH=12 的 NaOH 溶液任意比例混合:c(Na+)+ c(H+)=c(OH-)+c(HC2O- 4 ) D . 已 知 酸 性 CH3COOH>H2CO3>HClO , 则 pH 相 同 的 ①CH3COONa ②NaHCO3 ③NaClO 三种溶液的 c(Na+):①>②>③ 答案 D 解析 pH=5 的 H2S 溶液中 H+的浓度为 1×10-5 mol·L-1,但是 HS-的浓 度会小于 H+的浓度,H+来自于 H2S 的第一步电离、HS-的电离和水的电离,故 H+的浓度大于 HS-的浓度,A 错误;弱碱不完全电离,弱碱稀释 10 倍时,pH 减小不到一个单位,a查看更多