- 2021-07-06 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
内蒙古师范大学锦山实验学校2019-2020学年高一上学期期中考试化学
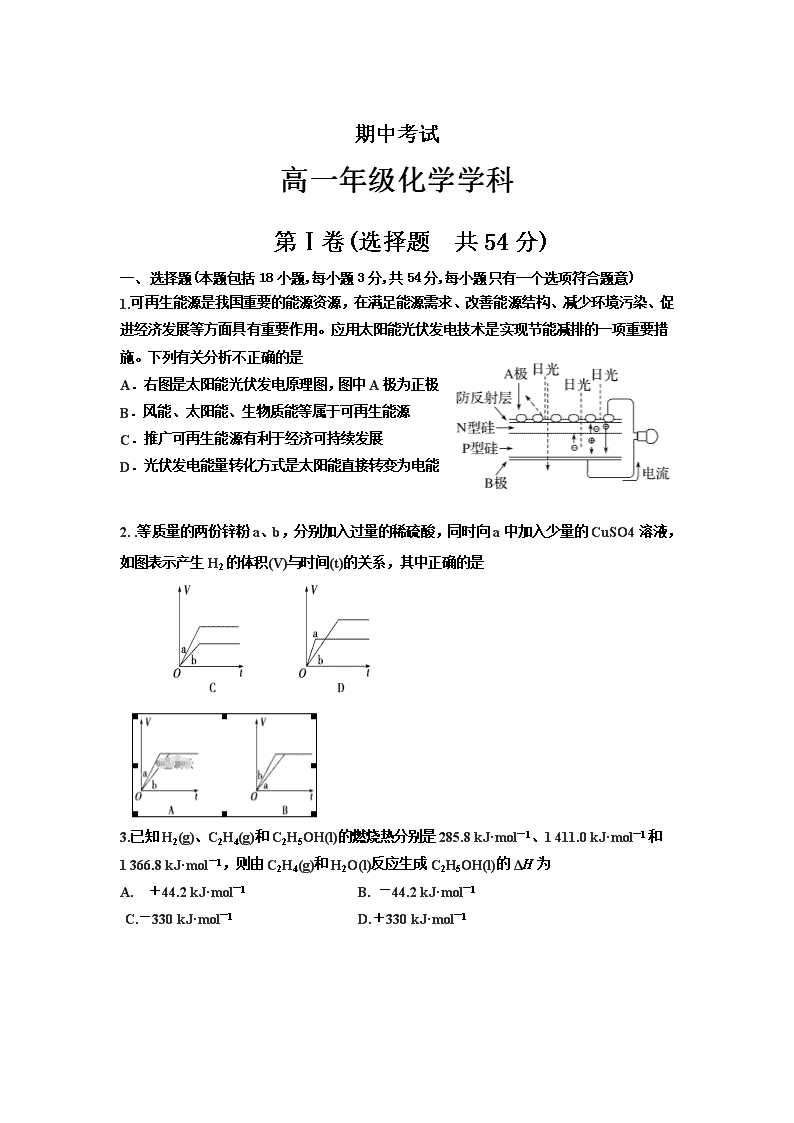
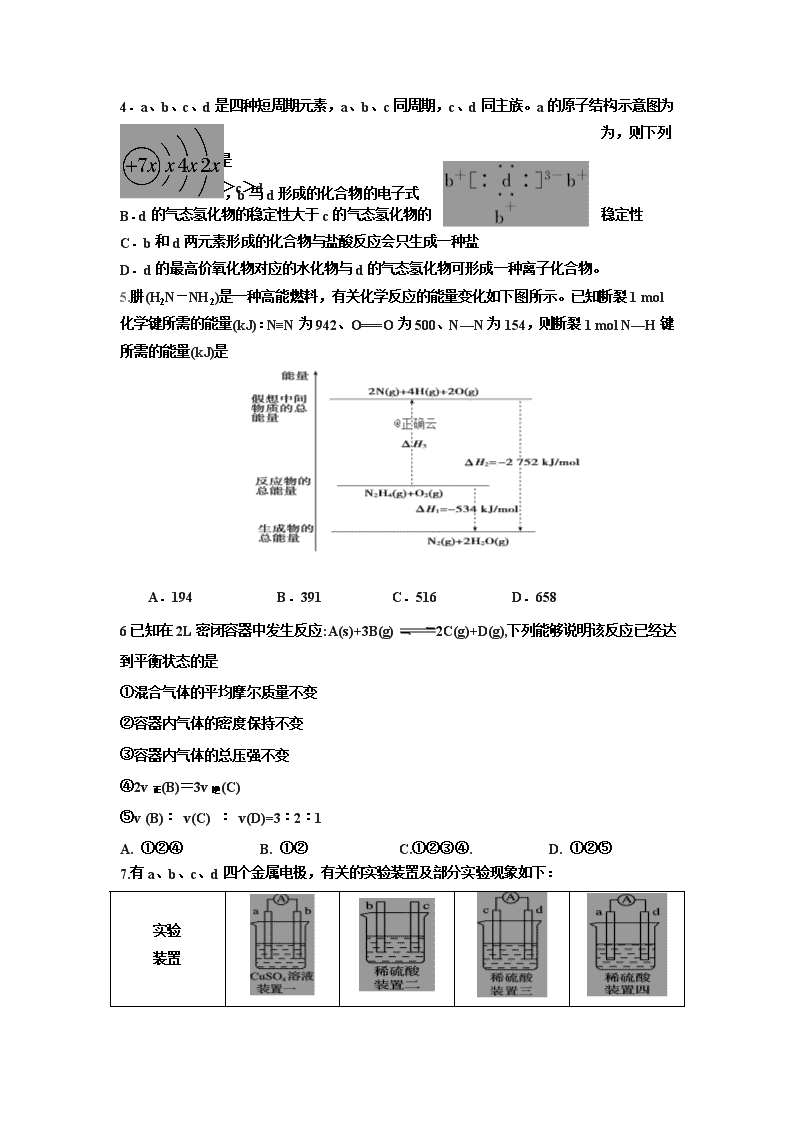
期中考试 高一年级化学学科 第Ⅰ卷(选择题 共54分) 一、 选择题(本题包括18小题,每小题3分,共54分,每小题只有一个选项符合题意) 1.可再生能源是我国重要的能源资源,在满足能源需求、改善能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能减排的一项重要措施。下列有关分析不正确的是 A.右图是太阳能光伏发电原理图,图中A极为正极 B.风能、太阳能、生物质能等属于可再生能源 C.推广可再生能源有利于经济可持续发展 D.光伏发电能量转化方式是太阳能直接转变为电能 2. .等质量的两份锌粉a、b,分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 3.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ·mol-1、1 411.0 kJ·mol-1和 1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为 A. +44.2 kJ·mol-1 B. -44.2 kJ·mol-1 C.-330 kJ·mol-1 D.+330 kJ·mol-1 4.a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为,b与d形成的化合物的电子式为,则下列叙述中不正确的是 A.原子半径:a>c>d B.d的气态氢化物的稳定性大于c的气态氢化物的稳定性 C.b和d两元素形成的化合物与盐酸反应会只生成一种盐 D.d的最高价氧化物对应的水化物与d的气态氢化物可形成一种离子化合物。 5.肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是 A.194 B.391 C.516 D.658 6已知在2L密闭容器中发生反应:A(s)+3B(g) 2C(g)+D(g),下列能够说明该反应已经达到平衡状态的是 ①混合气体的平均摩尔质量不变 ②容器内气体的密度保持不变 ③容器内气体的总压强不变 ④2v正(B)=3v逆(C) ⑤v (B)︰ v(C) ︰ v(D)=3︰2︰1 A. ①②④ B. ①② C.①②③④. D. ①②⑤ 7.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下: 实验 装置 部分实 验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极 由此可判断这四种金属的活动性顺序是 A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c 8.已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)===2CO(g) ΔH2 2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5 下列关于上述反应焓变的判断正确的是 A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 9.一定条件下,发生可逆反应M(g)+3N(g) 2W(g),若M、N、W起始浓度分别为c1、c2、c3,当反应达平衡时,M、N、W的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是 A.c1︰c2=1︰3(若c1大于0) B.当4v正(M)=v逆(N)时,该反应向正反应方向进行 C. c1可能为0.04 mol·L-1 D.0 ≤c2≤0.42 mol·L-1 10. 可逆反应A(g)+ 2B(g)3C(g)+ 4D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是 A.v(A)= 0.15 mol/(L·min ) B.v(B)= 0.5 mol/(L·min) C.v(C)= 0.6mol/(L·min) D.v(D)= 0.02 mol/(L·s) 11.元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布。下列推测正确的是 A.X和Z两元素形成的化合物中化学键类型相同 B.原子半径:X>Y,离子半径:X+>Z2- C.同族元素中Z的氢化物沸点最高、气态氢化物最稳定 D.同周期元素中Y的含氧酸的酸性最强 12.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是 A.若Y的最高正价为+m,则X的最高正价一定为+m B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 D.若X(OH)n为强碱,则Y(OH)n也一定为强碱 13.如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是 选 项 M N P A 锌 铜 稀硫酸 B 铜 铁 稀盐酸 C 银 锌 硝酸银溶液 D 锌 铁 硝酸铁溶液 14.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是 A.最高价氧化物对应水化物的酸性:X>W>Z B. 原子半径:W>Z>Y>X C.最简单气态氢化物的热稳定性:Y>X>W>Z D.元素X、Z、W的最高化合价分别与其主族序数相等 15.镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁-空气燃料电池,镁-海水燃料电池,镁-过氧化氢燃料电池,镁-次氯酸盐燃料电池。如图为镁-次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是 A.放电过程中OH-移向正极 B.电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl- C.镁电池中镁均为负极,发生氧化反应 D.镁—过氧化氢燃料电池,酸性电解质中正极反应式为 H2O2+2H++2e-===2H2O 16.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应 SO2(g) + NO2(g) SO3(g) + NO(g) 达到平衡,正反应速率随时间变化的示意图如右图所示。下列说法不正确的是 A 反应在c点未达到平衡状态 B 反应速率a点<b点 C 反应物浓度a点>b点 D. t1~t2=t2~t3时,NO2的转化率:a~b段>b~c段 17.由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y。下列有关说法正确的是 A.石墨Ⅰ极为正极,石墨Ⅱ极为负极 B.Y的化学式可能为NO C.石墨Ⅰ极的电极反应式为NO2+NO -e-===N2O5 D.石墨Ⅱ极上发生氧化反应 m n p s r q ① ② 18.短周期元素W、X、Y、Z的原子序数依次增大,n、p、q、s是由这些元素组成的二无化合物,常温常压下s是液体,其余均是无色气体。r是元素X的单质,是空气的主要成分之一,物质n能使湿润的红色石蕊试纸变蓝,单质m常用于自来水杀菌、消毒,上述物质的关系如图所示,下列说法错误的是 A、原子半径:W查看更多
相关文章
- 当前文档收益归属上传用户