- 2021-07-06 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届甘肃省临洮县第四中学高二上学期期中考试(2016
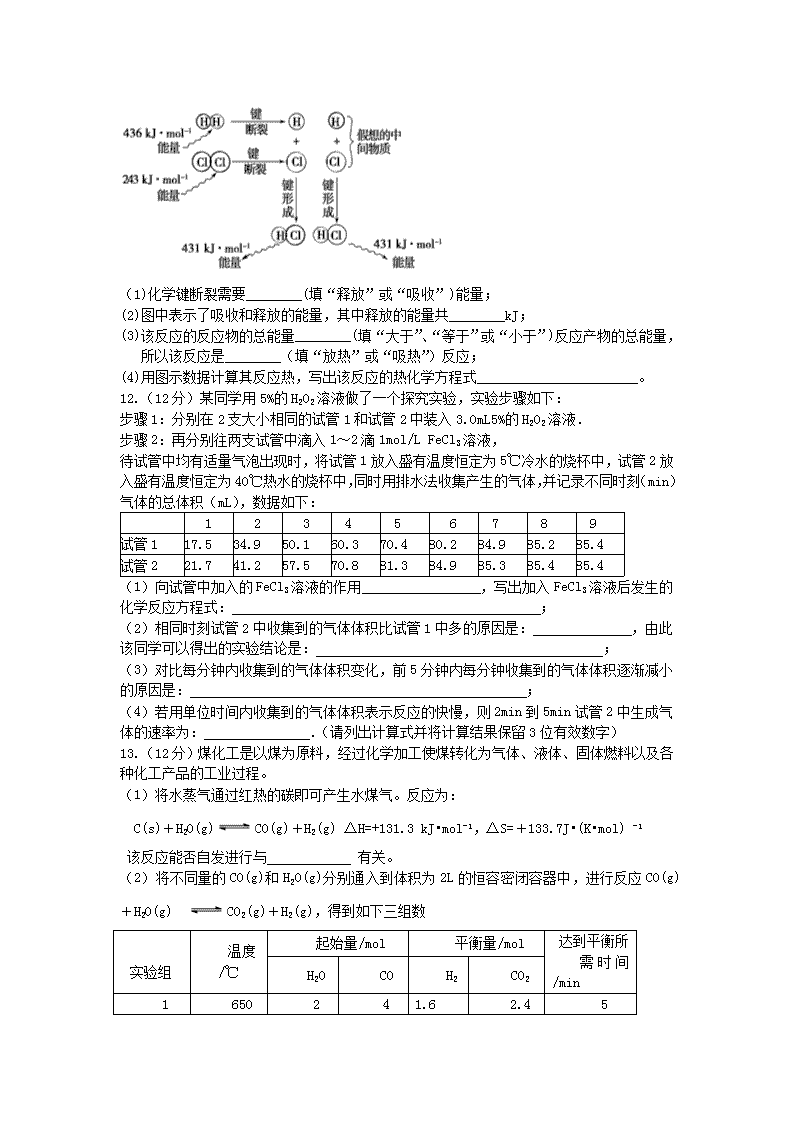
高二化学期中试卷 一、选择题(每小题只有一个选项符合题意,每小题5分,共50分) 1.下列设备工作时,将化学能转化为电能的是( ) A.硅太阳能电 B.锂离子电池 C.太阳能集热器 D.燃气灶 2.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN﹣N吸收167kJ热量,生成1molN≡N放出942kJ.根据以上信息和数据,下列说法正确的是( ) A.N4属于一种新型的化合物 B.N4与N2互为同素异形体 C.N4沸点比P4 (白磷)高 D.1mo1N4气体转变为N2将吸收882kJ热量 3.反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( ) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大. A.①④ B.②③ C.①③ D.②④ 4.随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一.反应:2NO(g)+2CO(g)2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570K时平衡常数为1×1059.下列说法正确的是( ) A.提高尾气净化效率的最佳途径是研制高效催化剂 B.提高尾气净化效率的常用方法是升高温度 C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 5.已知反应:①101kPa时,2C(s)+O2(g)═2CO(g);△H=﹣221kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=﹣57.3kJ/mol.下列结论正确的是( ) A.碳的燃烧热小于110.5 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为﹣57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ 6.已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B﹣A﹣B)的能量变化如图所示,下列有关叙述中正确的是( ) A.该反应的进行一定需要加热 B.该反应的△H=﹣(E1﹣E2)kJ/mol C.该反应中反应物的键能总和大于生成物的键能总和 D.断裂1 mol A﹣A和2 mol B﹣B放出E1 kJ能量 7.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( ) A.CH3OH(l)+O2(g)═CO2(g)+2H2O(l);△H=+725.8 kJ/mol B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=﹣1452 kJ/mol C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=﹣725.8 kJ/mol D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1452 kJ/mol 8.不能用勒夏特列原理来说明的事实是( ) A.合成氨在高压下进行是有利的 B.温度过高对合成氨不利 C.使用催化剂能使合成氨速率加快 D.及时分离从合成塔中出来的混合气,有利于合成氨 9.能够证明反应SiO2(s)+4HF(g)SiF4(g)+2H2O(g)已经达到平衡的是( ) A.2v正(HF)=v逆(H2O) B.v(H2O)=2v(SiF4) C.SiO2的质量保持不变 D.反应物不再转化为生成物 10.如图是可逆反应A+2B ⇌2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断 ( ) A.正反应是吸热反应 B.若A、B是气体,则D是液体或固体 C.若A、B是气体, 则C、D中至少有一种不是气体 D.A、B、C、D均为气体 二、 填空题(共50分) 11.(12分)(Ⅰ) 下列说法正确的是 。 ①所有的燃烧反应都是放热反应. ②反应物的总能量低于生成物的总能量时,一定不能发生反应 ③物理变化过程中,也可能有热量的变化 ④C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨比金刚石稳定 ⑤一个反应的焓变因反应物的用量和反应条件的改变而发生改变 ⑥加入催化剂,改变了反应的途径,反应的ΔH也随之改变 (Ⅱ)实验测得1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出184.6 kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图: (1)化学键断裂需要________(填“释放”或“吸收”)能量; (2)图中表示了吸收和释放的能量,其中释放的能量共________kJ; (3)该反应的反应物的总能量________(填“大于”、“等于”或“小于”)反应产物的总能量,所以该反应是________(填“放热”或“吸热”)反应; (4)用图示数据计算其反应热,写出该反应的热化学方程式_______________________。 12.(12分)某同学用5%的H2O2溶液做了一个探究实验,实验步骤如下: 步骤1:分别在2支大小相同的试管1和试管2中装入3.0mL5%的H2O2溶液. 步骤2:再分别往两支试管中滴入1~2滴1mol/L FeCl3溶液, 待试管中均有适量气泡出现时,将试管1放入盛有温度恒定为5℃冷水的烧杯中,试管2放入盛有温度恒定为40℃热水的烧杯中,同时用排水法收集产生的气体,并记录不同时刻(min)气体的总体积(mL),数据如下: 1 2 3 4 5 6 7 8 9 试管1 17.5 34.9 50.1 60.3 70.4 80.2 84.9 85.2 85.4 试管2 21.7 41.2 57.5 70.8 81.3 84.9 85.3 85.4 85.4 (1)向试管中加入的FeCl3溶液的作用 ,写出加入FeCl3溶液后发生的化学反应方程式: ; (2)相同时刻试管2中收集到的气体体积比试管1中多的原因是: ,由此该同学可以得出的实验结论是: ; (3)对比每分钟内收集到的气体体积变化,前5分钟内每分钟收集到的气体体积逐渐减小的原因是: ; (4)若用单位时间内收集到的气体体积表示反应的快慢,则2min到5min试管2中生成气体的速率为: .(请列出计算式并将计算结果保留3位有效数字) 13.(12分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。 (1)将水蒸气通过红热的碳即可产生水煤气。反应为: C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1 该反应能否自发进行与 有关。 (2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数 实验组 温度/℃ 起始量/mol 平衡量/mol 达到平衡所 需时间/min H2O CO H2 CO2 1 650 2 4 1.6 2.4 5 2 900 1 2 0.4 1.6 3 ①实验1中以υ(CO2) 表示的平均反应速率为 。实验1中CO2的平衡转化率 为_ 。900℃是该反应的平衡常数 。 ②该反应为 (填“吸”或“放”)热反应 (3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________ 。 a.升高温度 b.充入He(g),使体系压强增大 c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2 14.(14分)在2L的密闭容器中,由CO2和H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响, (1)实验结果如图1所示(注:T2>T1,均大于300℃). ①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为 . ②通过分析图1,温度对反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的影响可以概括为 . ③下列情形能说明上述反应已达到平衡状态的是 (填字母). A.体系压强保持不变 B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存 C.CH3OH与H2物质的量之比为1:3 D.每消耗1mol CO2的同时生成3mol H2 E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变 ④已知H2(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJ·mol﹣1和﹣726.5kJ·mol﹣1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式: 。 (2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示。 ①该反应的平衡常数表达式K= ,250℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104 kPa下的平衡常数。 ②实际生产中,该反应条件控制在250℃、1.3×104 kPa左右,选择此压强而不选择更高压强的理由是 。 高二化学期中考试答案 一、单选题(每小题5分,共50分) 1-5 BBCAD 6-10 CBCCB 二、填空题 11.(12分)(Ⅰ)①③④(3分) (Ⅱ)(1)吸收;(1分) (2)862 ; (3)大于;放热 ; (其余每空2分) 12.(12分)(1)催化作用(或加快反应速率);2H2O22H2O+O2↑; (2)2中温度高;温度越高反应速率越快; (3)H2O2的浓度随着反应的进行逐渐减小; (4)(81.3mL-41.2 mL)/(5min-2min)=13.4mL/min.(每空2分) 13.(12分)(1)①温度 (2)①0.16mol/(L.min) 40% 0.17; ② 放 (3)c.d (每空2分) 14.(14分)(1)① mol/(L·min); ② 当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动; ③ ADF; ④ CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=﹣130.9 kJ·mol﹣1;(3分) (2)① ;(1分) >; ② 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而使生产成本增加。(其余每空2分)查看更多