- 2021-07-06 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版实验设计与探究作业
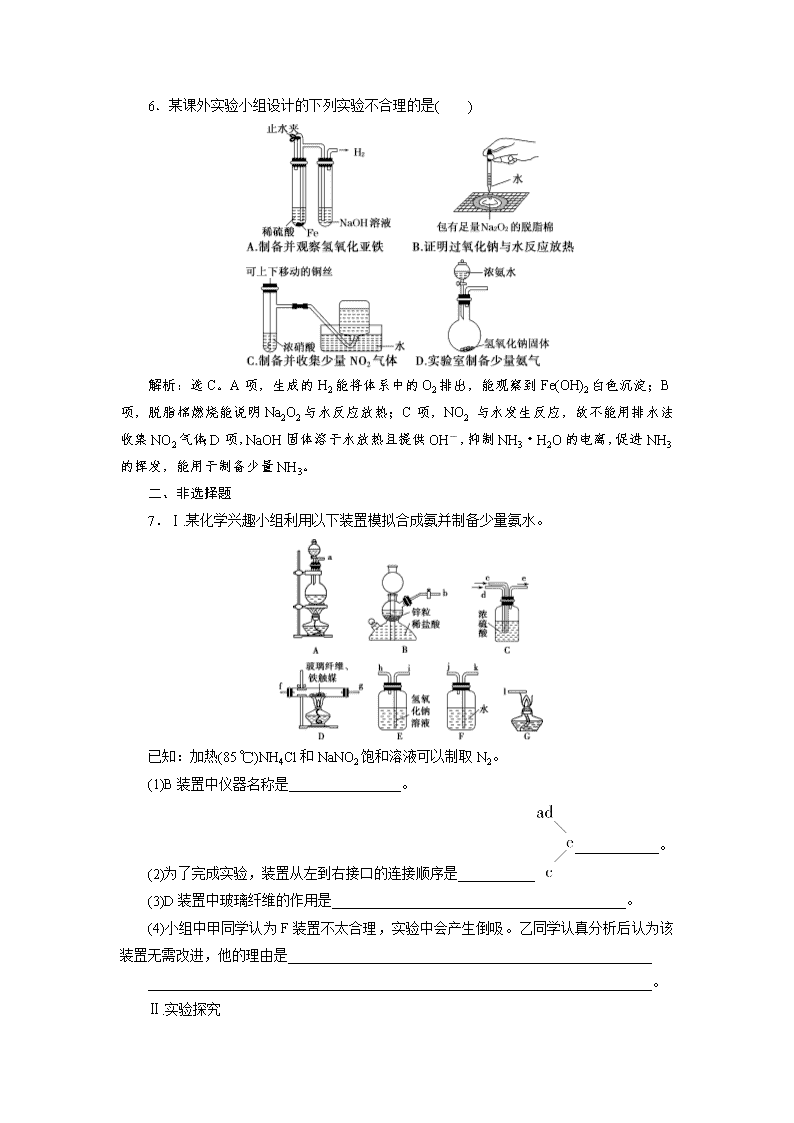
实验设计与探究 一、选择题 1.下列相关实验的设计能达到预期目的的是( ) 相关实验 预期目的 A 在少量食用碱中滴加食醋 探究食用碱是碳酸钠还是碳酸氢钠 B 在食用盐中滴加少量淀粉液 探究食用盐是否为加碘盐 C 用激光笔照射淀粉液 探究淀粉液是胶体还是溶液 D 将鸡蛋清溶于水后,滴加AgNO3溶液 验证蛋白质中含有硫元素 解析:选C。碳酸钠、碳酸氢钠均能与乙酸反应生成二氧化碳,A不能达到预期目的;食用盐中加入的是化合态的碘,不能用淀粉检验,B不能达到预期目的;蛋白质不是电解质,不能电离出硫离子,D不能达到预期目的。 2.下列实验装置或操作设计正确,且能达到实验目的的是( ) A.实验Ⅰ:配制一定物质的量浓度的稀硫酸 B.实验Ⅱ:用二氧化碳做喷泉实验 C.实验Ⅲ:进行中和热的测定 D.实验Ⅳ:验证酸性强弱H2SO4>H2CO3>HClO 解析:选B。一定物质的量浓度溶液的配制,应该先在烧杯中稀释,待冷却后再转移到容量瓶内,故A错误;二氧化碳易溶于氢氧化钠溶液,打开弹簧夹,挤压胶头滴管,可以产生喷泉现象,故B正确;进行中和热的测定缺少环形玻璃搅拌棒,故C错误;二氧化碳通入NaClO溶液中会生成HClO,但是该反应没有现象,无法通过该实验看出是否有HClO生成,故D错误。 3.某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是( ) 选项 实验及现象 结论 A 将湿润的红色石蕊试纸放在试管口,试纸变蓝 反应中有NH3产生 B 收集产生的气体并点燃,火焰呈淡蓝色 反应中有H2产生 C 收集气体的同时测得溶液的pH为8.6 弱碱性溶液中Mg也可被氧化 D 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 弱碱性溶液中OH-氧化了Mg 解析:选D。A.能使湿润的红色石蕊试纸变蓝的气体只有NH3。B.由于NH4Cl溶液水解后显酸性,故产生的气体中含有H2。C.pH=8.6的溶液显碱性,故弱碱性溶液中Mg可被氧化。D.溶液中有气泡产生,生成的气体是H2,是H+将Mg氧化,而不是OH-将Mg氧化。 4.下列实验设计能够成功的是( ) A.检验亚硫酸钠试样是否变质: 试样溶液白色沉淀沉淀不溶解 B.除去乙酸乙酯中混有的乙酸: 混合液溶液分层得到上层液体 C.证明酸性条件下H2O2氧化性比I2强: NaI溶液溶液变蓝色 D.鉴定盐A的成分是FeBr3: 解析:选B。Na2SO3与Ba(NO3)2反应生成的BaSO3可被HNO3氧化生成BaSO4,A错误;乙酸能与Na2CO3反应,上层液体是乙酸乙酯,B正确;在NaI溶液中加HNO3酸化,HNO3可氧化I-,C错误;若盐A是FeBr2,也会出现同样的现象,D错误。 5.某同学为探究SO2与Ba2+只有在碱性条件下才能形成BaSO3沉淀,设计了如下方案,你认为可行的是( ) A.将SO2通入Ba(OH)2溶液中观察有白色沉淀生成 B.将SO2通入Ba(NO3)2溶液中观察有白色沉淀生成 C.将SO2分别通入BaCl2溶液、BaCl2与HCl的混合溶液、Ba(OH)2溶液中,观察到只有Ba(OH)2溶液中有白色沉淀生成 D.将SO2通入BaCl2与NH3的混合溶液中有白色沉淀生成 解析:选C。A、D项方案不能说明SO2与Ba2+在非碱性条件下不能反应生成BaSO3沉淀;B项中SO2溶解后会形成酸性溶液,NO在酸性条件下可将SO氧化成SO,得到的沉淀是BaSO4。 6.某课外实验小组设计的下列实验不合理的是( ) 解析:选C。A项,生成的H2能将体系中的O2排出,能观察到Fe(OH)2白色沉淀;B项,脱脂棉燃烧能说明Na2O2与水反应放热;C项,NO2 与水发生反应,故不能用排水法收集NO2气体;D项,NaOH固体溶于水放热且提供OH-,抑制NH3·H2O的电离,促进NH3的挥发,能用于制备少量NH3。 二、非选择题 7.Ⅰ.某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水。 已知:加热(85 ℃)NH4Cl和NaNO2饱和溶液可以制取N2。 (1)B装置中仪器名称是________________。 (2)为了完成实验,装置从左到右接口的连接顺序是_______________________。 (3)D装置中玻璃纤维的作用是__________________________________________。 (4)小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是____________________________________________________ ________________________________________________________________________。 Ⅱ.实验探究 (5)该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是Ag(NH3)2OH,该小组同学对其组成进行了如下实验探究: ①在洁净的小试管中加入2 mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液。 ②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用____________洗涤,得到白色固体。 ③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体的主要成分是______________________。 (6)请根据以上探究,设计实验来制备少量纯净的Ag(NH3)2OH溶液:取2 mL 2%的AgNO3溶液于洁净的小试管中,__________________________________________________ ________________________________________________________________________ ________________________________________________________________________, 即得到纯净的Ag(NH3)2OH溶液。 解析:本实验分两部分,Ⅰ是物质的制备,反应原理为N2+3H22NH3,NH3+H2ONH3·H2O,该实验可分解为“常见仪器的使用”“装置的连接”“实验安全(防倒吸)”三个小实验;Ⅱ是探究物质的成分,依据元素化合物的性质即可作答。 (2)根据实验原理N2+3H22NH3,A装置产生N2(含水蒸气),B装置产生H2(含HCl和水蒸气),H2通过E装置除去HCl后与N2一同通入C装置(干燥、混合、调节两气体比例),得到N2和H2的混合气体,然后进入D装置,与铁触媒接触发生反应,生成的NH3中混有未反应的N2、H2,该混合气体通入F装置中制得氨水,尾气中的H2用G装置处理,因此装置接口的连接顺序是 (或gf)kjl。 (4)弄清产生倒吸的原理本问就不难回答。产生倒吸的原理是大量气体迅速溶于水,导致导管内气体压强迅速减小,液体被外界气压压入导管内从而产生倒吸现象。本题中反应产生的NH3中含有大量的未反应的N2和H2,这两种气体均难溶于水,不会使导管内压强迅速减小,因而也就不会产生倒吸现象。 (5)在银氨溶液中加入无水乙醇, 溶液变浑浊,说明得到的沉淀物难溶于乙醇,因此可用无水乙醇洗涤该沉淀。由实验现象可知,该白色固体中含有Ag(NH3)和NO,因此其成分是 Ag(NH3)2NO3。 (6)实验探究①中制备银氨溶液的反应原理为AgNO3+NH3·H2O===AgOH↓ +NH4NO3,AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O,按此反应原理分析,实验方案就不难设计了。 答案:(1)启普发生器 (2)bih fg(或gf)kjl (3)增大气体与催化剂铁触媒的接触面积 (4)该反应为可逆反应,反应物的转化率低,NH3中混有较多难溶于水的气体,F装置中不会产生倒吸 (5)无水乙醇 Ag(NH3)2NO3 (6)逐滴加入稀NaOH溶液至不再有沉淀生成,过滤,用适量蒸馏水洗涤,再将固体转移至小试管中,逐滴加入2%的稀氨水至沉淀恰好溶解(其他合理答案均可) 8.某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。 已知:①NO+NO2+2OH-===2NO+H2O; ②气体液化温度:NO2:21 ℃、NO:-152 ℃。 (1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。 甲:A→C→F→D→B;乙:A→B→C→E;丙:A→F→D→B。 甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓硝酸反应产生的气体中含有NO?甲:________;乙:________;丙:________。(填“能”或“不能”) 具体说明不能验证的主要原因(能验证的方案,不必回答原因): 甲方案:_______________________________________________________________ ________________________________________________________________________。 乙方案:________________________________________________________________ ________________________________________________________________________。 丙方案:________________________________________________________________ ________________________________________________________________________。 (2)实验开始时首先通入足量的N2,其目的是__________________________________ ________________________________________________________________________。 (3)确认气体中含NO的现象是__________________________________________。 (4)如果O2过量,则B装置中发生反应的离子方程式是__________________________。 解析:(1)甲方案:从A装置中出来的气体经浓硫酸干燥和冰水浴冷却除去NO2,若在D装置中出现红棕色,可证明Cu与适量浓硝酸反应产生的气体中含有NO,最后尾气用B装置吸收。乙方案:混合气体在通过B装置时,因发生反应:NO+NO2+2NaOH===2NaNO2+H2O使NO消耗,后续实验无法验证产生的气体中是否有NO,且无尾气吸收装置。丙方案:混合气体通过F装置时,NO2与水蒸气发生反应:3NO2+H2O===2HNO3+NO,使部分NO2转化为NO,产生干扰,从而不能确认Cu和适量浓硝酸反应是否有NO生成。 (2)装置内的空气中含有氧气,会使生成的NO被氧化为NO2,而检验不到NO的存在,通入氮气可排尽整个装置中的空气,保证NO不损失。 (3)NO遇氧气生成红棕色NO2。 (4)如果氧气过量,则进入B装置中的气体为NO2和O2,在碱性条件下,氮的氧化物最终会被氧化为硝酸盐,离子方程式是4NO2+O2+4OH-===4NO+2H2O。 答案:(1)能 不能 不能 乙方案:混合气体在通过B装置时,因发生反应:NO+NO2+2NaOH===2NaNO2+H2O使NO消耗,后续实验无法验证产生的气体中是否有NO,且无尾气吸收装置 丙方案:混合气体通过F装置时,NO2与水蒸气发生反应:3NO2+H2O===2HNO3+NO,使部分NO2转化为NO,产生干扰,从而不能确认Cu和适量浓硝酸反应是否有NO生成 (2)排尽整个装置中的空气,防止产生的NO被氧气氧化生成NO2 (3)D装置中通入O2后有红棕色气体产生 (4)4NO2+O2+4OH-===4NO +2H2O 9.某化学小组设计以下实验方案,测定部分变质的小苏打样品中Na2CO3 的质量分数。 [方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。 (1)坩埚中发生反应的化学方程式为__________________________________________ ________________________________________________________________________。 (2)实验中,需加热至恒重的目的是___________________________________________ ________________________________________________________________________。 (3)实验中确定加热至恒重的方法是________________________________________ ________________________________________________________________________。 (4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果________(填“偏大”“偏小”或“不变”)。 [方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO===BaCO3↓+H2O) (1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为________。 (2)实验中判断沉淀是否完全的方法是_______________________________________ ________________________________________________________________________。 (3)实验中洗涤沉淀的操作是________________________________________________ ________________________________________________________________________。 (4)实验中判断沉淀是否洗涤干净的方法是___________________________________ ________________________________________________________________________。 [方案三]按下图所示装置进行实验: (1)B装置内所盛试剂是__________;D装置的作用是 ________________________________________________________________________。 分液漏斗中________(填“能”或“不能”)用稀盐酸代替稀硫酸进行实验。 (2)实验前称取17.90 g样品,实验后测得C装置增重 8.80 g,则样品中Na2CO3的质量分数为________________________________________________________________________。 (3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷,该缺陷是________________________________________________________________________ ________________________________________________________________________。 解析:本题考查了小苏打样品中Na2CO3质量分数的三种测定方法。方案一中,加热小苏打样品,发生反应2NaHCO3Na2CO3+CO2↑+H2O,根据样品的质量变化即可求出样品中Na2CO3的质量分数。为了减小误差,在实验过程中一定要注意将药品加热到质量恒定。方案二中,过滤操作中用到的玻璃仪器有烧杯、漏斗和玻璃棒。判断沉淀是否完全,实质是检验溶液中的CO和HCO是否完全沉淀。方案三中,利用C装置的质量变化来测定,因此不仅要设置B装置对气体进行干燥,同时要防止空气中的二氧化碳和水蒸气进入C装置,所以D装置的作用是防止空气中的水蒸气、二氧化碳进入C装置。由C装置的质量变化,得出Na2CO3和NaHCO3共计0.2 mol,其总质量为17.90 g, 不难得出两成分的质量分数。若根据题目给出的装置进行实验,要注意反应产生的CO2不能全部进入C装置而导致产生误差,因此要设置一个驱赶残留二氧化碳气体的装置。 答案:[方案一](1)2NaHCO3Na2CO3+CO2↑+H2O (2)保证NaHCO3分解完全 (3)两次称量固体的质量相同 (4)偏小 [方案二](1)玻璃棒 (2)静置,向上层清液中滴加少量Ba(OH)2溶液,观察是否有白色沉淀生成 (3)向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2~3次 (4)取少量最后一次洗涤液于试管中,滴加少量Na2SO4溶液,观察是否有白色沉淀生成 [方案三](1)浓H2SO4 防止空气中的水蒸气、二氧化碳进入C装置 不能 (2)29.6% (3)缺少一套将A、B装置中的CO2气体全部驱赶到C装置中的装置(或其他合理答案)查看更多