- 2021-07-06 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河北省辛集一中高二下学期3月月考化学试题 Word版
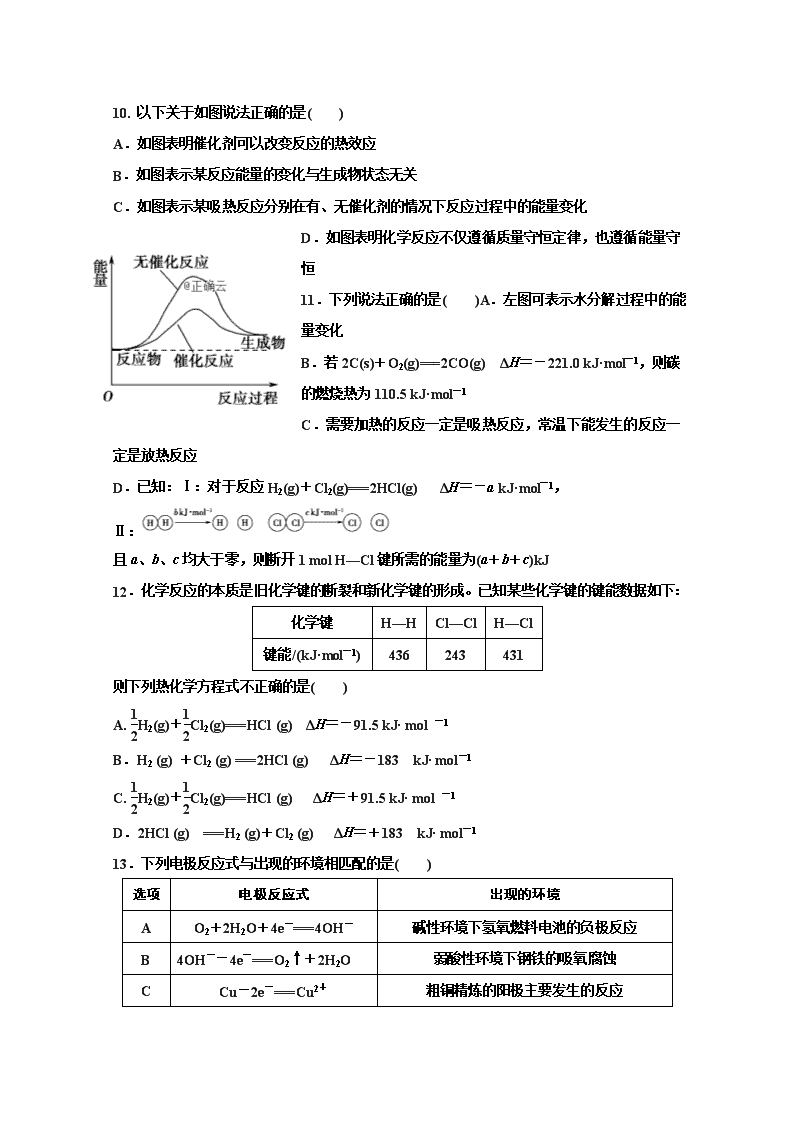
辛集市一中高二化学 月考试卷 (时间:90分钟 满分:100分) 可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Mg-24 Al-27 Si—28 S-32 Cl-35.5 K-39 Fe -56 Zn-65 Cu-64 Ag-108 第I卷(选择题)(本大题共35小题,共60分) 1.下列有关钢铁腐蚀与防护的说法正确的是( ) A.钢管与电源正极连接,钢管可被保护 B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀 D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+ 2. 下列有关电化学的示意图中正确的是( ) 3.下列叙述正确的是 ( ) A.铜锌稀硫酸形成的原电池放电时,溶液中阳离子向铜电极移动 B.充电时,把铅蓄电池的负极接在外接电源的正极 C.镀锌铁镀层破损后铁更易被腐蚀 D.碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e-===4OH- 4. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如下图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )A.液滴中的Cl-由a区向b区迁移 B液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=== 4OH- C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-===Cu2+ 5.下列叙述正确的是( ) A.K与N连接时,X为硫酸,一段时间后溶液的pH增大 B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e-===H2↑ C.K与M连接时,X为硫酸,一段时间后溶液的pH增大 D.K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-===2H2O+O2↑ 镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种6. 镁电池的反应原理为:xMg+Mo3S4MgxMo3S4 下列说法不正确的是( ) A.放电时,Mo3S4发生氧化反应 B.放电时,正极反应式:Mo3S4+2xe-===Mo3S C.充电时,Mg2+向阴极迁移 D.充电时,阴极反应式:xMg2++2xe-===xMg 7. 目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是PbPbO2H2SO4,下列关于该铅酸蓄电池的说法正确的是 ( ) A.充电时,电源的正极接蓄电池标“+”的一极,电池上标有“-”的一极发生氧化反应 B.“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 C.放电时在铅酸蓄电池的负极发生还原反应 D.若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12 L Cl2,电池内至少消耗H2SO4 0.10 mol 8.. 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l),通电时a电极质量增加,下列说法正确的是( ) A.电路中通过1 mol电子时,Y电极质量增加48 g B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+ SO(aq)+2e-===PbSO4(s)+2H2O(l) C.c、d电极产生气体的物质的量之比为1∶2 D.X极为负极 9.下列与金属腐蚀有关的说法中,不正确的是( ) A.钢铁在潮湿空气中生锈属于电化学腐蚀 B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀 C.金属腐蚀的本质是金属原子失去电子被氧化 D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 10. 以下关于如图说法正确的是( ) A.如图表明催化剂可以改变反应的热效应 B.如图表示某反应能量的变化与生成物状态无关 C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒 11.下列说法正确的是( )A.左图可表示水分解过程中的能量变化 B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1 C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g) ΔH=-a kJ·mol-1, Ⅱ: 且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为(a+b+c)kJ 12.化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下: 化学键 H—H Cl—Cl H—Cl 键能/(kJ·mol-1) 436 243 431 则下列热化学方程式不正确的是( ) A. H2(g)+Cl2(g)===HCl (g) ΔH=-91.5 kJ· mol -1 B.H2 (g) +Cl2 (g) ===2HCl (g) ΔH=-183 kJ· mol-1 C. H2(g)+Cl2(g)===HCl (g) ΔH=+91.5 kJ· mol -1 D.2HCl (g) ===H2 (g)+Cl2 (g) ΔH=+183 kJ· mol-1 13.下列电极反应式与出现的环境相匹配的是( ) 选项 电极反应式 出现的环境 A O2+2H2O+4e-===4OH- 碱性环境下氢氧燃料电池的负极反应 B 4OH--4e-===O2↑+2H2O 弱酸性环境下钢铁的吸氧腐蚀 C Cu-2e-===Cu2+ 粗铜精炼的阳极主要发生的反应 D H2-2e-===2H+ 用惰性电极电解H2SO4溶液的阳极反应 14.下列有关电化学装置的说法正确的是( ) A.用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-===2Ag+S2- B.用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 C.图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼 D.图4装置中若M是铜,则该装置能防止铁被腐蚀 15.Na在不同条件下与O2反应生成Na2O和Na2O2。已知:25 ℃、101 kPa时: ①2Na(s)+O2(g)===Na2O(s) ΔH1=-414 kJ·mol-1 ②2Na(s)+O2(g)===Na2O2(s) ΔH2=-511 kJ·mol-1 下列说法正确的是( ) A.等量的Na充分反应后,反应①和②生成物的阴阳离子个数比不相等 B.等量的Na充分反应后,反应①和②转移电子数不同 C.Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 D.25 ℃ 101 kPa下,Na2O2(s)+Na(s)===Na2O(s)ΔH=-158.5 kJ·mol-1 16.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则 ( ) A. 电流方向:电极Ⅳ→Ⓐ→电极Ⅰ B. 电极Ⅰ发生还原反应 C. 电极Ⅱ逐渐溶解 D. 电极Ⅲ的电极反应:Cu2++2e-===Cu 17.已知平衡:①C2H4(g)C2H2(g)+H2(g),②2CH4(g)C2H4(g)+2H2(g)。当升高温度时,①和②式均向右移动。 a.C(s)+2H2(g)CH4(g) ΔH1 b.2C(s)+H2(g)C2H2(g) ΔH2 c.2C(s)+2H2(g)C2H4(g) ΔH3 下列有关a、b和c中的ΔH1、ΔH2、ΔH3大小顺序排列正确的是( ) A.ΔH1>ΔH2>ΔH3 B.ΔH2>ΔH3>2ΔH1 C.ΔH2>ΔH1>ΔH3 D.ΔH3>ΔH2>2ΔH1 18.含乙酸钠和对氯酚()的废水可以利用微生物电池除去,其原理如图所示。下列有关说法不正确的是( ) A.B极是负极 B.质子从A极移向B极 C.B极的电极反应式:CH3COO--8e-+4H2O===2HCO+9H+ D.处理后的废水pH降低 19.热电池是一种可长期储备电能的电池,高氯酸钾广泛用于热电池。铁和高氯酸钾反应提供的能量使盐熔化导电,从而激活电池。铁和高氯酸钾的热电池反应为KClO4(s)+4Fe(s)===KCl(s)+4FeO(s) ΔH。下列说法正确的是( ) A.ΔH<0且参与反应的高氯酸钾越多,其值越小 B.在该热电池中,铁为负极,发生还原反应 C.正极反应式为KClO4(s)+8e-===KCl(s)+4O2-(l) D.生成1 mol FeO时转移8 mol电子 20. 一种利用菌种生成的硫化物作为介质的微生物燃料电池,电池内部有质子通过,该系统不经任何维护可连续运行5年。该电池的负极反应式为S2-+4H2O-8e-===SO+8H+。有关该电池的下列说法中正确的是( ) A.若有1.12 L氧气参与反应,则有0.2 mol电子发生转移 B.质子由正极移向负极 C.该电池的总反应为S2-+2O2===SO D.正极的电极反应式为2O2+8e-+4H2O===8OH- 21. 在水溶液中能大量共存的一组离子是( ) A.Na+、Ba2+、Cl-、NO B.Pb2+、Hg2+、S2-、SO C.NH、H+、S2O、PO D.Ca2+、Al3+、Br-、CO 22.下列离子方程式表达正确的是( ) A.SO2通入溴水中:SO2+2H2O+Br2===2H++SO+2HBr B.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO===BaSO4↓+2H2O C.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO D.硫化钠的水解反应:S2-+H3O+===HS-+H2O 23. 下列说法中正确的是( ) ①非金属元素不可能组成离子化合物 ②构成分子的粒子一定含有共价键 ③共价化合物中可能含有离子键 ④离子化合物中可能含有共价键 ⑤非极性键只存在于双原子单质分子里 ⑥不同元素组成的多原子分子里的化学键一定都是极性键 A.①②④⑥ B.②④⑤⑥ C.①③⑤⑥ D.只有④ 24.列实验过程中,始终无明显现象的是( ) A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中 C.NH3通入AlCl3溶液中 D.SO2通入Ba(NO3)2溶液中 25. 若A+酸===盐+水,则A不可能属于( ) A.氧化物 B.单质 C.碱 D.电解质 26. 某学习兴趣小组讨论辨析以下说法: ①通过化学变化可以实现16O与18O间的相互转化 ②灼烧钠的化合物时,火焰呈黄色,发生化学反应 ③碱性氧化物一定是金属氧化物 ④只由一种元素组成的物质一定为纯净物 ⑤石墨和C60具有相同的化学性质 ⑥糖类、蛋白质、油脂属于天然高分子化合物,其中说法正确的是( ) A.①② B.③⑤ C.①③④ D.③⑤⑥ 27. 下列分类正确的是( ) A.同位素:1H、D+、T2 B.电解质:H2O、CH3COOH、NH4HCO3 C.胶体:饱和氯化铁溶液、淀粉溶液、牛奶 D.硅酸盐产品:水晶、水泥、陶瓷 28 在4 ℃时,向100 mL水中溶解了22.4 L HCl气体(标准状况下测得)后得到溶液。下列说法中正确的是( ) A.该溶液物质的量浓度为10 mol/L B.所得溶液的体积为22.5 L C.根据题干数据,该溶液物质的量浓度无法求得 D.该溶液中溶质的质量分数因溶液的密度未知而无法求得 29.下列叙述中正确的是 ( ) A.可用盐酸清洗长期存放三氯化铁溶液的试剂瓶 B.酸式滴定管注入Na2CO3溶液之前应检查是否漏液 C.可用玻璃棒蘸少量待测物质的浓溶液做焰色反应 D.金属钠、镁、铝化学性质活泼,均须密封保存 30.下列关于实验的叙述正确的是( ) A.燃着的酒精灯不慎碰翻失火,应立即用水扑灭 B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗 C.配制硫酸亚铁溶液时,常向溶液中加入少量稀硝酸和少量铁粉 D.精制含有Ca2+、Mg2+、SO的粗盐时,先加BaCl2,再加Na2CO3 31.下列依据相关实验得出的结论正确的是( ) A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 D向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ 32. 分析如下残缺的反应:RO+________+6H+===3R2↑+3H2O。下列叙述正确的是( ) A.R的原子半径在同周期元素原子中最小 B.R一定是周期表中的第ⅤA族元素 C.上式中缺项所填物质在反应中作氧化剂D.RO中的R元素在所有的反应中只能被还原 33. 下列化学用语表达正确的是( ) A.N2的电子式:N⋮⋮N B.S2-的结构示意图: C.次氯酸的结构式:H—O—Cl D. Zr和Zr是同种核素 34. X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( ) A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z 35. 下列离子中半径最大的是( )A.Na+ B.Mg2+ C.O2- D.F- 第二卷 36. 如图甲、乙是电化学实验装置。请回答下列问题: (1)若两池中均盛放饱和NaCl溶液。 ①甲池中石墨棒的电极反应式__ ②将湿润的淀粉碘化钾试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了生成的碘。已知反应中A气体和I2的物质的量之比为5∶1,且生成两种酸的化学反应方程式为______________________________________________。 (2)若两池中均盛放CuSO4溶液,反应一段时间后: ①甲池中石墨棒上的电极反应式为__________________________________________。 ②如果起始时乙池盛有200 mL pH=5的CuSO4溶液(25 ℃ ),一段时间后溶液蓝色变浅,测定其pH变为1(不考虑体积变化),若要使溶液恢复到电解前的状态,可向溶液中加入____________(填写物质的化学式)________g。 37.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: (1)气体A中的大气污染物可选用下列试剂中的________吸收. a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水 (2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是________________________(注明试剂、现象). (3)由泡铜冶炼粗铜的化学反应方程式为_____________________________________ (4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________. a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应 c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属 (5)利用反应2Cu+O2+2H2SO4====2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________. 38. SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:①若A为CO,B为H2,C为CH3OH,则通入CO的一极为_____极。 ②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为_______________。 ③若A为NH3,B为O2,C为HNO3,则正极的电极反应式为__________________________________________________________________。 39.如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,乙装置中X为阳离子交换膜。根据要求回答下列相关问题: (1)通入氧气的电极为________(填“正极”或“负极”) 写出负极的电极反应: (2)铁电极为________(填“阳极”或“阴极”),石墨电极的电极反应为__________________________________________________________________。 (3)反应一段时间后,乙装置中生成的氢氧化钠主要在________(填“铁极”或“石墨极”)区。 (4)如果粗铜中含有锌、银等杂质,则丙装置中阳极上的电极反应为______________,反应一段时间,硫酸铜溶液的浓度将________(填“增大”、“减小”或“不变”)。 (5)若在标准状况下有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下的 体积为________;丙装置中阴极析出铜的质量为 40. (1) 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,原混合溶液中c(K+)为 mol·L-1电解后溶液中c(H+)为 mol·L-1 (2) 若用惰性电极电解CuSO4溶液一段时间后,需加入98 g Cu(OH)2固体,才能使电解质溶液复原,则这段时间,整个电路中转移的电子数为 41.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。 (1)飞船在光照区运行时,太阳能电池帆板将________能转化为________能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2 充电时,阳极的电极反应式为______________________;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性________(填“增大”、“减小”或“不变”)。 (2)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为________________________。 1BDABA 6ADADD 11ACCAD 16ABBCC 21ABDBB 26BBCAD 31DACDC 36(1)①O2+2H2O+4e-===4OH- ②5Cl2+I2+6H2O===10HCl+2HIO3 (2)①②CuO(或CuCO3) 0.8(或1.24) 37(1)cd (2)Fe3+ 取少量溶液,滴加KMnO4溶液,KMnO4褪色 (3)3Cu2O+2AlAl2O3+6Cu (4)bd (5)4H++O2+4e-===2H2O 38. 正极 ②SO2-2e-+2H2O===SO+4H+ ③O2+4e-+4H+===2H2O 39.(1)正极 CH3OCH3-12e-+16OH-===2CO+11H2O (2)阴极 2Cl--2e-===Cl2↑ (3)铁极 (4)Zn-2e-===Zn2+、Cu-2e-===Cu2+ 减小 (5)4.48 L 12.8 g 40. 0.2 0.4 4NA 41 (1)太阳 电 Ni(OH)2-e-+OH-===NiOOH+H2O 减小 (2)Zn-2e-+2OH-===Zn(OH)2查看更多