- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届安徽省淮北市第一中学高二下学期第一次月考(2018
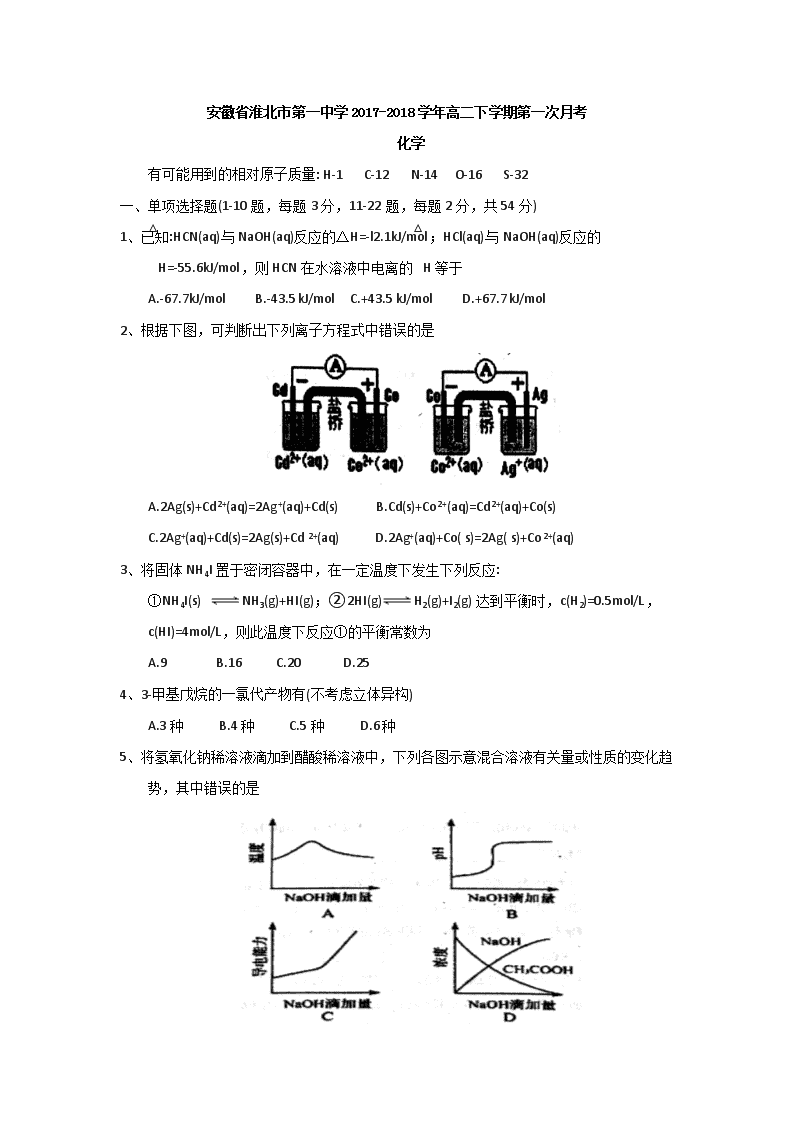
安徽省淮北市第一中学2017-2018学年高二下学期第一次月考 化学 有可能用到的相对原子质量: H-1 C-12 N-14 O-16 S-32 一、单项选择题(1-10题,每题3分,11-22题,每题2分,共54分) 1、已知:HCN(aq)与NaOH(aq)反应的△H=-l2.1kJ/mol;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/mol,则HCN 在水溶液中电离的△H等于 A.-67.7kJ/mol B.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7 kJ/mol 2、根据下图,可判断出下列离子方程式中错误的是 A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) B.Cd(s)+Co2+(aq)=Cd2+(aq)+Co(s) C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co( s)=2Ag( s)+Co2+(aq) 3、将固体NH4I置于密闭容器中,在一定温度下发生下列反应: ①NH4I(s) NH3(g)+HI(g);②2HI(g)H2(g)+I2(g) 达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为 A.9 B.16 C.20 D.25 4、3-甲基戊烷的一氯代产物有(不考虑立体异构) A.3种 B.4 种 C.5 种 D.6 种 5、将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是 6、下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是 A.甲苯 B.乙醇 C. 丙烯 D.乙烯 7、微生物电池是指在徽生物的作用下将化学能转化为电能的装置,其工作原理如下图所示。下列有关说法错误的是 A.正极反应 中 有CO2生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为C6H12O6+6O2=6CO2+6H2 8、下列各组中的物质均能发生加成反应的是 A.乙烯和乙醇 B.苯和氯乙烯 C.乙酸和溴乙烷 D.丙烯和丙烷 9、Mg—AgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是 A.负极反应式为Mg-2e-=Mg2+ B.正极反应式为Ag++e-=Ag C.电池放电时Cl-由正极向负极迁移 D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ 10、一定温度下,下列溶液的离子浓度关系式正确的是 A.pH=5 的H2S 溶液中,c (H+) =c (HS-)=1x10-5mol/L B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 C.pH=2 的H2C2O4溶液与pH=12 的NaOH溶液任意比例混合: c (Na+) +c (H+) =c(OH-) +c (HC2O4-) D.pH 相同的①CH3COONa②NaHCO3③NaClO 三种溶液的c (Na+):①>②>③ 11、下列反应中,属于取代反应的是 ①CH3CH=CH2+Br2CH3CHBrCH2Br ②CH3CH2OHCH2=CH2+H2O ③CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O ④CH3Cl+Cl2→CH2Cl2+HCl A.①② B.③④ C.①③ D.②④ 12、已知异丙苯的结构简式如下,下列说法错误的是 A.异丙苯的分子式为C9H12 B.异丙苯的沸点比苯高 C.异丙苯中碳原子可能都处于同一平面 D.异丙苯的和苯为同系物 13、羰基硫(COS) 可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S 混合加热并达到下列平衡: CO (g) +H2S (g)COS (g) +H2 (g) K=0.1 反应前CO物质的量为10mol,平衡后CO 物质的量为8mol,下列说法正确的是 A.升高温度,H2S 浓度增加,表明该反应是吸热反应 B.通入CO 后,正反应速率逐渐增大 C.反应前H2S 物质的量为7mol D.CO 的平衡转化率为80% 14、某有机物的结构简式如图所示,其名称正确的是 A.5-乙基-2-己烯 B.3-甲基庚烯 C.3-甲基-5-庚烯 D.5-甲基-2-庚烯 15、下列在制定溶液中的各组离子,一定能够大量共存的是 A.无色溶液中:CO32-、Al3+、Cl-、NO3- B.无色溶液中:NH4+、K+、CH3COO-、Cl- C.pH=l的溶液中:Fe2+、NH4+、Mg2+、NO3- D.水电离的c(H+)=10-12mol/L 的溶液中:Fe3+、SO42-、K+、Na+ 16、下列说法正确的是 A.将AlCl3溶液和Na2SO3溶液加热蒸干并灼烧可分别得到Al2O3、Na2SO3 B.在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变 C.A1露置在空气中会形成致密的氧化膜,Fe露置在空气中也会形成致密的氧化膜 D.反应为Cu+2AgNO3=Cu(NO3)2+2Ag的原电池装置中,盐桥中通常装有含琼胶的KCl饱和溶液 17、某单烯烃与H2加成后的产物是则该烯烃的结构式可能有 A.4种 B.5种 C.6种 D.7种 18、下列说法正确的是 A.植物油氢化过程中发生了加成反应 B.淀粉和纤维素互为同分异构体 C.环己烷与苯可用酸性KMnO4溶液鉴别 D.水可以用来分离溴苯和苯的混合物 19、由下列实验及现象不能推出相应结论的是 实验 现象 结论 A. 向2mL0.1FeCl3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 黄色逐渐消失,加KSCN溶液颜色不变 还原性:Fe>Fe2+ B. 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 CO2具有氧化性 C. 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 石蕊试纸变蓝 NH4HCO3显碱性 D. 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 一只试管中产生黄色沉淀,另一支中无明显现象 Ksp(AgI)查看更多