- 2021-07-06 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版物质的组成、性质及分类作业(1)
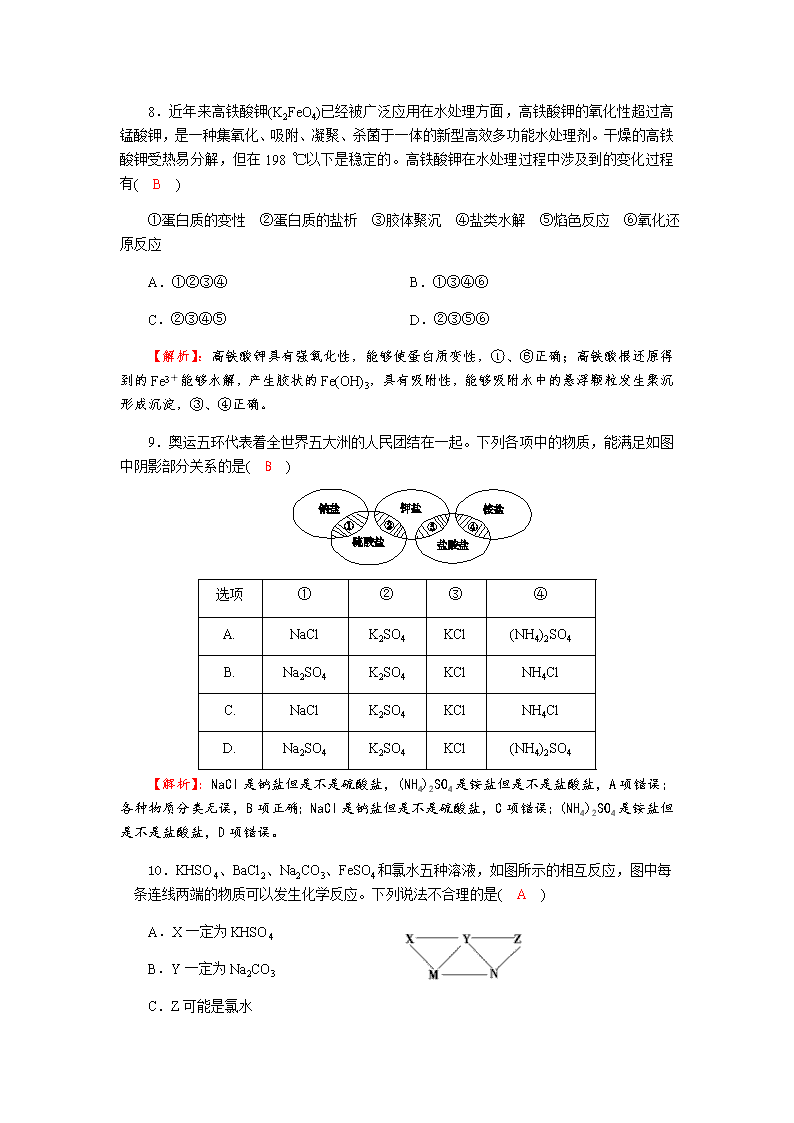
物质的组成、性质及分类 一、单项选择题:本题包括10小题,每小题5分,共50分。 1.下列物质分类正确的是( D ) A.SO2、SiO2、 CO均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体 C.烧碱、冰醋酸、四氯化碳均为电解质 D.漂白粉、水玻璃、氨水均为混合物 【解析】:漂白粉是混合物,水玻璃是硅酸钠的水溶液,属于混合物,氨水是氨气溶于水形成的混合物,D项正确。 2.下列关于物质分类的说法正确的是( A ) A.金刚石、白磷都属于单质 B.漂白粉、石英都属于纯净物 C.氯化铵、次氯酸都属于强电解质 D.葡萄糖、蛋白质都属于高分子化合物 【解析】:A 由一种元素组成的纯净物是单质,金刚石是碳元素形成的单质,白磷是磷元素形成的单质,A正确;B由一种物质组成的是纯净物,由不同种物质组成的是混合物。漂白粉是次氯酸钙和氯化钙组成的混合物,石英是二氧化硅,属于纯净物,B不正确;C 在溶液中或熔融状态下完全电离出离子的化合物是强电解质,不能完全电离,存在电离平衡的是弱电解质。氯化铵是强电解质,次氯酸是弱电解质,C不正确;D 蛋白质是高分子化合物,而葡萄糖是单糖,不是高分子化合物,D 不正确。 3.下列物质中属于纯净物的是( D ) ①由同种元素组成的物质 ②具有固定熔沸点的物质 ③由相同种类和相同数目的原子组成的分子 ④只有一种元素的阳离子和另一种元素的阴离子组成的物质 ⑤在氧气中燃烧只生成二氧化碳的物质 ⑥只含有一种分子的物质 A.②③⑥ B.④⑤⑥ C.①④ D.②⑥ 4.我国晋朝傅玄的《傅鹑觚集·太子少傅箴》中写道:“夫金木无常,方园应行,亦有隐括,习与性形。故近朱者赤,近墨者黑。”这里的“朱”指的是下列物质中的( A ) A.HgS B.Cu C.Cu2O D.Fe2O3 【解析】:“朱”指“朱砂”,是古代常用的一种颜料和药物,其主要成分是HgS。 5.下列实验装置或操作与微粒的大小无直接关系的是( C ) 【解析】:胶体、溶液、浊液三种分散系的本质区别是分散质粒子的大小不同;胶体粒子直径在1~100 nm之间,能透过滤纸,但不能透过半透膜,溶液中的粒子直径小于1 nm,可透过半透膜和滤纸,而浊液的分散质粒子直径大于100 nm,不能透过滤纸和半透膜;丁达尔效应是胶体粒子对光线的散射作用形成的,而溶液中的小分子或粒子对光线的散射作用非常微弱,故无此现象;萃取是利用了物质在不同溶剂中溶解性的不同,与分散质粒子大小无关。 6.下列逻辑关系图中正确的是( D ) A B C D 【解析】:根据分散质粒子直径的大小将分散系分为溶液、胶体和浊液,而气溶胶属于胶体的一种,A错误;氧化还原反应与吸热反应和放热反应的分类标准不同,B错误;钾盐与钠盐是根据盐中的阳离子进行分类的,碳酸盐是根据盐中的阴离子进行分类的,C错误。 7.人们从冰箱中取出的“常态冰”仅是冰存在的17种可能的形式之一。目前,科学家发现了一种全新的多孔、轻量级的“气态冰”可形成气凝胶的冰。下列有关说法正确的是( D ) A.“常态冰”和“气态冰”结构不同,是同素异形体 B.“气态冰”因其特殊的结构而具有比“常态冰”更活泼的化学性质 C.标准状况下,18 g “气态冰”的体积为22.4 L D.构成“气态冰”的分子中含有极性共价键 【解析】:“常态冰”和“气态冰”是水存在的不同形式,状态不同,但是同一种物质,A项错误;“气态冰”和“常态冰”是水存在的不同形式,物理性质不同,但化学性质相同,B项错误;“气态冰”是形成气凝胶的冰,标准状况下不是气体,18 g “气态冰”的体积小于22.4 L,C项错误;构成“气态冰”的分子是水分子,水分子中含有极性共价键,D项正确。 8.近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂。干燥的高铁酸钾受热易分解,但在198 ℃以下是稳定的。高铁酸钾在水处理过程中涉及到的变化过程有( B ) ①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应 A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥ 【解析】:高铁酸钾具有强氧化性,能够使蛋白质变性,①、⑥正确;高铁酸根还原得到的Fe3+能够水解,产生胶状的Fe(OH)3,具有吸附性,能够吸附水中的悬浮颗粒发生聚沉形成沉淀,③、④正确。 9.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( B ) 选项 ① ② ③ ④ A. NaCl K2SO4 KCl (NH4)2SO4 B. Na2SO4 K2SO4 KCl NH4Cl C. NaCl K2SO4 KCl NH4Cl D. Na2SO4 K2SO4 KCl (NH4)2SO4 【解析】:NaCl是钠盐但是不是硫酸盐,(NH4)2SO4是铵盐但是不是盐酸盐,A项错误;各种物质分类无误,B项正确;NaCl是钠盐但是不是硫酸盐,C项错误;(NH4)2SO4是铵盐但是不是盐酸盐,D项错误。 10.KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应。下列说法不合理的是( A ) A.X一定为KHSO4 B.Y一定为Na2CO3 C.Z可能是氯水 D.M、N必定各为BaCl2、FeSO4中的一种 【解析】:解答本题首先要确定每种物质能与其他几种物质发生反应,然后代入框图验证,得出答案。 二、非选择题:本大题包括4小题,共50分 11.(12分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示: (1)反应Ⅰ的化学方程式是 ______________________________________________。 (2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。 ①根据上述事实,下列说法正确的是________(选填序号)。 a.两层溶液的密度存在差异 b.加I2前,H2SO4溶液和HI溶液不互溶 c.I2在HI溶液中比在H2SO4溶液中易溶 ②辨别两层溶液的方法是_______________________________________________。 ③经检测,H2SO4层中c(H+):c(SO)=2.06:1。其比值大于2的原因是____________ ____________________________________________________________________。 【答案】:(1)SO2+2H2O+I2 = H2SO4+2HI (2)①ac ②观察颜色,颜色深的是HI层,颜色浅的是硫酸层 ③硫酸层中含有少量HI 【解析】:(1)根据图中信息可知反应I中反应物为SO2、H2O和I2,生成物为H2SO4和HI,根据氧化还原反应方程式的配平方法配平。 (2)①加入I2前溶液未出现分层,加入I2后,碘在HI溶液中溶解度大于在H2SO4溶液中溶解度,两溶液中密度存在差异,故出现分层现象。 ②由于I2+H2OHI+HIO,因此两层溶液中都含有I2、H+、I2、HIO等,但C(I2)不同,故可以观察颜色的深浅来辨别两层溶液。 ③H2SO4溶液中溶有低浓度的碘,碘单质可与水发生反应:I2+H2OHI+HIO,c(H+)增大,使溶液中c(H+)∶c(SO)的比值大于2。 12.(除标注外,每空1分,共10分)Fe3O4又称磁性氧化铁,请根据要求完成下列问题。 (1)Fe3O4固体(黑色)可以写成FeO·Fe2O3,属于________(填“混合物”或“纯净物”)。将其加入适量盐酸,所发生反应的化学方程式为_________________________________。 (2)通入过量氯气后,用此溶液进行以下实验: 取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为_______________________________________________,此反应属于 _______________________________________________。 (3)在小烧杯中加入20 mL蒸馏水,加热到沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸直至溶液呈________色,即可制得Fe(OH)3胶体。 (4)取另一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到________烧杯中的液体产生丁达尔效应,这个实验可以用来区别 _______________________________________________。 【答案】:(1)纯净物(2分) Fe3O4+8HCl===2FeCl3+FeCl2+4H2O(2分) (2)FeCl3+3NaOH===Fe(OH)3↓+3NaCl(2分) 复分解反应 (3)红褐 (4)乙 胶体和溶液 【解析】:(1)Fe3O4中铁元素有+3价、+2价两种价态,虽然可写成FeO·Fe2O3,但它是纯净物,与盐酸反应同时生成FeCl3和FeCl2。方程式为Fe3O4+8HCl===2FeCl3+FeCl2+4H2O。 (2)通入过量Cl2,将FeCl2氧化为FeCl3,加入NaOH溶液后生成Fe(OH)3红褐色沉淀,此反应为复分解反应。 (3)煮沸后变为红褐色,即得到Fe(OH)3胶体。 (4)此方法为胶体与溶液的区别。 13.(14分)氮的氧化物(NOx) 是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题: (1)氨气的制备 ①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。 ②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____________(按气流方向,用小写字母表示)。 (2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。 操作步骤 实验现象 解释原因 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 ①Y管中_____________ ②反应的化学方程式 ____________ 将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝集 打开K2 ③_______________ ④______________ 【答案】:(每空2分) (1)① A; 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O(或B;NH3·H2ONH3↑+H2O); ②d→c→f→e→i; (2)①红棕色气体颜色慢慢变浅; ②8NH3+6NO2 7N2 +12H2O; ③Z中NaOH溶液产生倒吸现象;④反应后气体分子数减少,Y管内压强小于外界大气压。 14.(14分)取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为______________________,反应后得到的溶液呈________色。用此溶液进行以下实验: (1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为__________________________,此反应属于__________反应。 (2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸直至溶液呈________色,即可制得Fe(OH)3胶体。 (3)取另一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3 溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到________烧杯中的液体产生丁达尔效应。这个实验可以用来区别__________。 (4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的HI稀溶液,边滴边振荡,会出现一系列变化。 ①先出现红褐色沉淀,原因是__________________。 ②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式: __________________________________________________。 ③最后溶液颜色加深,原因是______________,此反应的离子方程式是__________________________________________________。 (5)用稀盐酸代替HI稀溶液,能出现(4)中哪些相同的变化现象________(填序号)。 【答案】:Fe2O3+6HCl===2FeCl3+3H2O 黄 (1)FeCl3+3NaOH===3NaCl+Fe(OH)3↓ 复分解 (2)红褐 (3)乙 胶体和溶液 (4)①加入电解质后,胶体发生聚沉 ②Fe(OH)3+3H+===Fe3++3H2O ③有I2生成 2Fe3++2I-===I2+2Fe2+ (5)①② 【解析】:碱性氧化物与酸反应生成盐和水,故Fe2O3+6HCl===2FeCl3+3H2O,FeCl3溶液呈黄色。(1)向FeCl3溶液中滴入NaOH溶液发生复分解反应,此小题主要考查Fe(OH)3 沉淀的制备原理。(2)此题主要考查Fe(OH)3胶体的制法。(3)由胶体和溶液的性质不同,可据丁达尔效应将二者区别。(4)HI既有酸性又有强还原性,I-能使Fe(OH)3胶体聚沉,H+使Fe(OH)3沉淀溶解,生成的Fe3+又能氧化I-生成I2;而HCl只能使Fe(OH)3先聚沉再溶解。分析(5)时的关键在于Cl-比I-还原性弱,Cl-不能还原Fe3+,故导致现象不同。解题中常见错因:仅把HI当作“电解质”;仅把HI当作“酸”;忽略了I-的还原性。查看更多