- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习(浙江)水的电离平衡和溶液的酸碱性作业
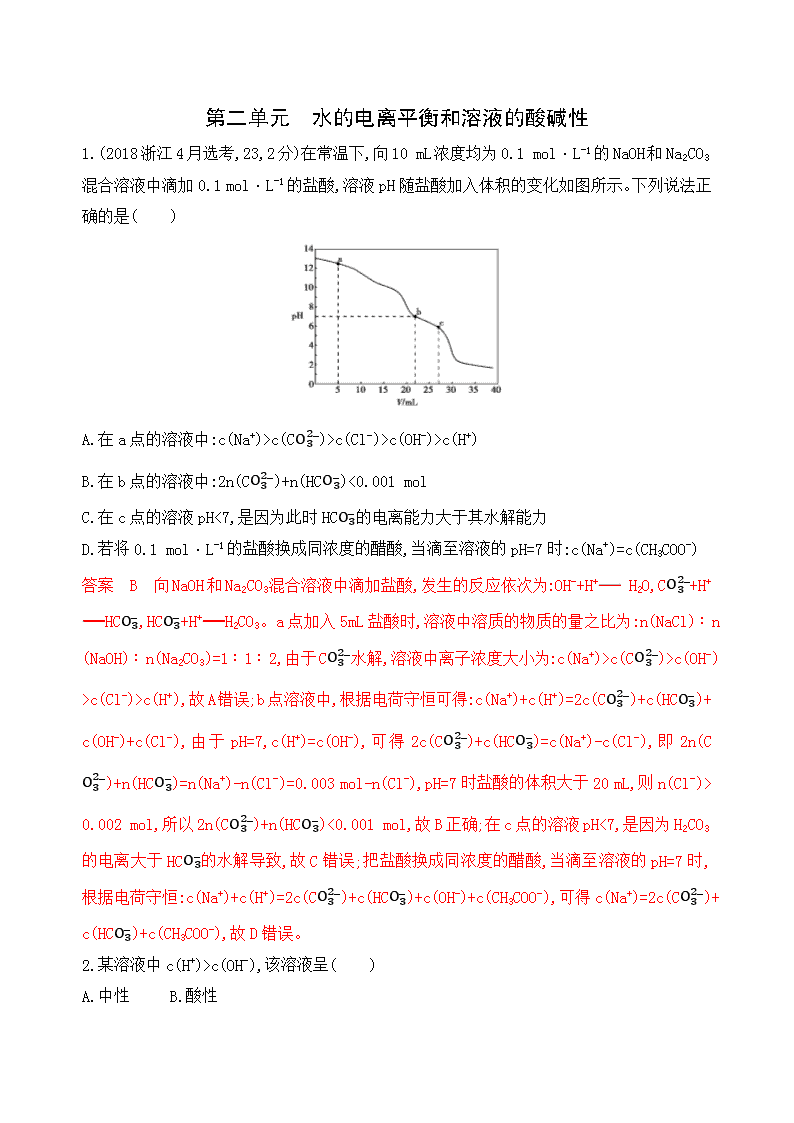
第二单元 水的电离平衡和溶液的酸碱性 1.(2018 浙江 4 月选考,23,2 分)在常温下,向 10 mL 浓度均为 0.1 mol·L-1 的 NaOH 和 Na2CO3 混合溶液中滴加 0.1 mol·L-1 的盐酸,溶液 pH 随盐酸加入体积的变化如图所示。下列说法 正确的是( ) A.在 a 点的溶液中:c(Na+)>c(C O3 2 -)>c(Cl-)>c(OH-)>c(H+) B.在 b 点的溶液中:2n(C O3 2 -)+n(HC O3 -)<0.001 mol C.在 c 点的溶液 pH<7,是因为此时 HC O3 -的电离能力大于其水解能力 D.若将 0.1 mol·L-1 的盐酸换成同浓度的醋酸,当滴至溶液的 pH=7 时:c(Na+)=c(CH3COO-) 答案 B 向 NaOH 和 Na2CO3 混合溶液中滴加盐酸,发生的反应依次为:OH-+H+ H2O,C O3 2 -+H+ HC O3 -,HC O3 -+H+ H2CO3。a 点加入 5 mL 盐酸时,溶液中溶质的物质的量之比为:n(NaCl)∶ n(NaOH)∶n(Na2CO3)=1∶1∶2,由于 C O3 2 -水解,溶液中离子浓度大小为:c(Na+)>c(C O3 2 -)>c(OH -)>c(Cl-)>c(H+),故 A 错误;b 点溶液中,根据电荷守恒可得:c(Na+)+c(H+)=2c(C O3 2 -)+c(HC O3 -) +c(OH-)+c(Cl-),由于pH=7,c(H+)=c(OH-),可得2c(C O3 2 -)+c(HC O3 -)=c(Na+)-c(Cl-),即2n(C O3 2 -) +n(HC O3 -)=n(Na+)-n(Cl-)=0.003 mol-n(Cl-),pH=7 时盐酸的体积大于 20 mL,则 n(Cl-)>0.00 2 mol,所以 2n(C O3 2 -)+n(HC O3 -)<0.001 mol,故 B 正确;在 c 点的溶液 pH<7,是因为 H2CO3 的电 离大于 HC O3 -的水解导致,故 C错误;把盐酸换成同浓度的醋酸,当滴至溶液的 pH=7 时,根据电 荷守恒:c(Na+)+c(H+)=2c(C O3 2 -)+c(HC O3 -)+c(OH-)+c(CH3COO-),可得 c(Na+)=2c(C O3 2 -)+c(HC O3 -) +c(CH3COO-),故 D 错误。 2.某溶液中 c(H+)>c(OH-),该溶液呈( ) A.中性 B.酸性 C.碱性 D.无法判断 答案 B c(H+)>c(OH-)的溶液呈酸性。 3.在两份相同的 Ba(OH)2 溶液中,分别滴入物质的量浓度相等的 H2SO4、NaHSO4 溶液,其导电能 力随滴入溶液体积变化的曲线如图所示。 下列分析不正确的是( ) A.①代表滴加 H2SO4 溶液的变化曲线 B.b 点,溶液中大量存在的离子是 Na+、OH- C.c 点,两溶液中含有相同量的 OH- D.a、d 两点对应的溶液均显中性 答案 C ①中的 a 点处 Ba(OH)2 和 H2SO4 恰好完全反应,Ba2+和 S O4 2 -完全转化为 BaSO4 沉淀, 溶液的导电能力达到最低;在溶液中继续滴加 H2SO4 溶液到 c 点,此时 H2SO4 过量,溶液呈酸性。 ②中 b 点处 Ba(OH)2 和 NaHSO4 按物质的量之比 1∶1 反应,此时除了生成 BaSO4 沉淀外,还生 成 NaOH;b→d 是继续加入的 NaHSO4 与 NaOH 反应的过程,因此②中 c 点溶液呈碱性。故 C 项 错误。 4.(2018 浙江 11 月选考,23,2 分)常温下,分别取浓度不同、体积均为 20.00 mL 的 3 种 HCl 溶液,分别滴入浓度为 1.000 mol·L-1、0.100 0 mol·L-1 和 0.010 00 mol·L-1 的 NaOH 溶液, 测得 3 个反应体系的 pH 随 V(NaOH)变化的曲线如图所示,在 V(NaOH)=20.00 mL 前后出现突 跃。 下列说法不正确...的是( ) A.3 种 HCl 溶液的 c(HCl):最大的是最小的 100 倍 B.曲线 a、b、c 对应的 c(NaOH):a>b>c C.当 V(NaOH)=20.00 mL 时,3 个体系中均满足:c(Na+)=c(Cl-) D.当 V(NaOH)相同时,pH 突跃最大的体系中的 c(H+)最大 答案 D A 项中,只要观察起始时三种 HCl 溶液的 pH 可发现 HCl 溶液浓度分别为 1.000 mol·L-1,0.100 0 mol·L-1 和 0.010 00 mol·L-1,最大的是最小的 100 倍,故 A 正确;B 项中, 根据反应后溶液的 pH 可知,pH 越大,氢氧化钠浓度越高,故 B 正确;C 项中,当 V(NaOH)=20.00 mL 时,恰好达到反应终点,这时溶液显中性,所以 3 个体系中均满足:c(Na+)=c(Cl-),故 C 正 确;D 项中,当 V(NaOH)相同时,pH 突跃最大的体系中的 c(H+)最小,D 错误。 5.25 ℃时,水的电离被抑制,且溶液 pH>7 的是( ) A.0.1 mol·L-1 的 NH4Cl 溶液 B.0.1 mol·L-1 的 NaCl 溶液 C.0.1 mol·L-1 的氨水 D.0.1 mol·L-1 的 NaHCO3 溶液 答案 C NH4Cl 溶液中 N H4 + 水解促进水的电离,溶液显酸性,pH<7,A 错误;NaCl 是强酸强碱 盐,对水的电离无影响,pH=7,B 错误;NH3·H2O 是弱碱,抑制水的电离,溶液显碱性,pH>7,故 C 正确;HC O3 -水解促进水的电离,故 D 错误。 6.常温下向 20 mL 0.1 mol/L HA 溶液中逐滴加入 0.1 mol/L NaOH 溶液,其 pH 变化情况如 图所示(忽略温度变化)。下列说法中不正确的是( ) A.HA 为弱酸 B.滴定终点位于 c 点和 d 点之间 C.滴定到 b 点时:n(Na+)+n(H+)-n(OH-)+n(HA)=0.002 mol D.滴定到 d 点时:c(OH-)>c(Na+)>c(A-)>c(H+) 答案 D 由图中曲线起点知 0.1 mol/L HA 溶液的 pH>1,所以 HA 是弱酸,故 A 正确;向 20 mL 0.1 mol/L HA 溶液中逐滴加入 0.1 mol/L NaOH 溶液,恰好中和时溶液呈碱性,pH>7,滴定终 点位于 c 点和 d 点之间,故 B 正确;滴定到 b 点时,根据电荷守恒知 n(Na+)+n(H+)-n(OH-)=n(A-),n(A-)+n(HA)=0.002 mol,即 n(Na+)+n(H+)-n(OH-)+n(HA)=0.002 mol,故 C 正确;d 点溶液是氢氧化钠溶液和 NaA 溶液的混合液,c(Na+)>c(OH-),故 D 错误。 7.已知 NaHSO4 在水中的电离方程式为 NaHSO4 Na++H++S O4 2 -,某温度下,向 pH=6 的蒸馏水中 加入 NaHSO4 晶体,保持温度不变,测得溶液的 pH=2,对于该溶液,下列叙述中不正确的是 ( ) A.该温度高于 25 ℃ B.水电离出的 c(H+)=1×10-10 mol·L-1 C.c(H+)=c(OH-)+c(S O4 2 -) D.该温度下加入等体积 pH=12 的 NaOH 溶液可使反应后的溶液恰好呈中性 答案 D 25 ℃时蒸馏水的 pH=7,现在蒸馏水的 pH=6,说明温度高于 25 ℃,A 正确;NaHSO4 溶液的 pH=2,c(H+)=10-2mol·L-1,该温度下 KW=1×1 0 - 12 ,故水电离出的 c(H+)水=c(OH-)= 1×10 - 12 10 - 2mol/L=1×10-10 mol·L-1,B 正确;NaHSO4 溶液中的电荷守恒式为 c(Na+)+c(H+)=c(OH-)+2c (S O4 2 -),由 NaHSO4 Na++H++S O4 2 -知溶液中 c(Na+)=c(S O4 2 -),故有 c(H+)=c(OH-)+c(S O4 2 -),C 正 确;该温度下 pH=12 的 NaOH 溶液中 c(OH-)=1 mol·L-1,与等体积的 pH=2 的 NaHSO4 溶液混合, 由于 n(OH-)>n(H+),故 NaOH 过量,反应后溶液呈碱性,D 错误。 8.亚氯酸钠(NaClO2)是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等的漂白。亚氯 酸钠在溶液中可生成 ClO2、HClO2、Cl O2 -、Cl-,其中 HClO2 和 ClO2 都具有漂白作用,但 ClO2 是 毒性很大的气体,经测定,25 ℃时各组分含量随 pH 变化情况如图所示(Cl-没有画出)。在 25 ℃时,下列分析正确的是( ) A.使用该漂白剂的最佳 pH 为 3 B.pH=5 时,溶液中 � ( ClO2 -) � ( HClO2 )= 1 10C.pH=6 时,NaClO2 溶液中:c(Na+)+c(H+)=c(Cl O2 -)+4c(OH-) D.NaClO2 溶液加水稀释所有离子浓度均减小 答案 B HClO2 是漂白织物的有效成分,ClO2 是有毒气体,要使漂白剂的漂白性强,即 HClO2 的含量高,又要使 ClO2 浓度较小,根据图像知,pH 过小时 ClO2 含量较高,pH 过大时 HClO2 的含 量较低,当溶液的 pH 为 4~5 时漂白效果最好,故 A 错误;在 25 ℃、pH=6 时 c(Cl O2 -)=c(HClO2), HClO2 的电离平衡常数 K= � ( H+ ) � ( ClO2 -) � ( HClO2 ) =10-6,pH=5 时 c(H+)=10-5mol/L,则 � ( ClO2 -) � ( HClO2 )= � � ( H+ )= 10 - 6 10 - 5 = 1 10 ,故 B 正确;pH=6 时 NaClO2 溶液中的电荷守恒式为 c(Na+)+c(H+)=c(Cl O2 -)+c(OH-)+c(Cl-),故 C 错 误;NaClO2 溶液加水稀释,碱性减弱,c(H+)增大,故 D 错误。 9.常温下,向 20 mL 浓度为 0.100 0 mol/L 的盐酸中逐滴加入 0.100 0 mol/L 的氨水,溶液 pH 随氨水体积的变化曲线如图所示。下列说法不正确的是( ) A.在 B 点时:c(H+)=c(OH-)+c(NH3·H2O) B.在 C 点时:c(Cl-)查看更多