高中化学第一章原子结构元素周期律第三节元素周期表的应用第2课时研究同主族元素的性质同步练习鲁科版必修第二册
第2课时 研究同主族元素的性质
课程标准
核心素养
1.以ⅠA、ⅦA族为例,掌握同主族元素性质的递变规律。
2.能运用原子结构理论初步解释同主族元素性质的递变规律。
1.宏观辨识与微观探析
建立原子结构、元素性质与物质性质之间的认识模型。
2.证据推理与模型认知
构建“位”“构”“性”关系认识模型,发展对元素及其化合物化学性质的认识模型。
3.科学探究与创新意识
形成实验探究元素性质递变规律、比较物质性质的思路方法,提高基于理论进行预测、提出假设的能力和基于实验事实概括、推理得出结论的能力。
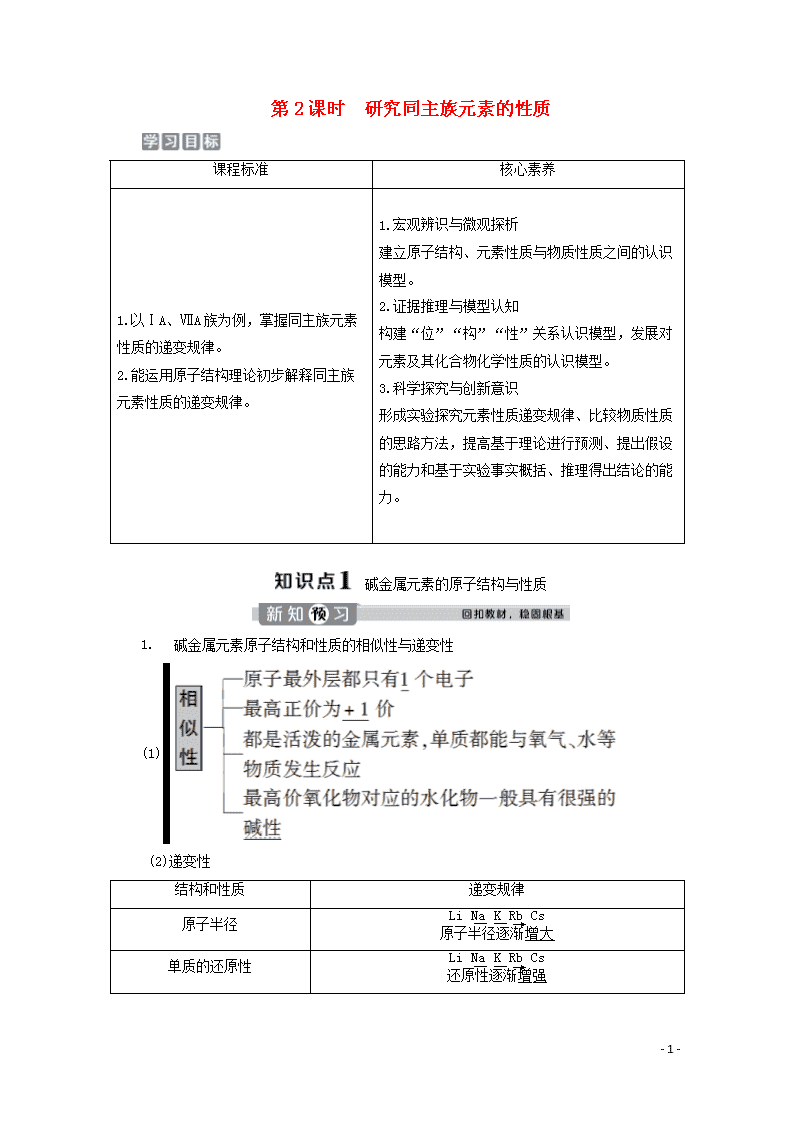
碱金属元素的原子结构与性质
碱金属元素原子结构和性质的相似性与递变性
(1)
(2)递变性
结构和性质
递变规律
原子半径
单质的还原性
- 13 -
与H2O或O2反
应的剧烈程度
最高价氧化物对
应水化物的碱性
同主族(从上到下)元素性质的递变规律
3.碱金属元素单质的物理性质
(1)除铯(略带金色光泽固体)外,其余碱金属单质都是银白色固体;都比较软、有延展性、密度较小、导热性和导电性较好。
(2)从锂到铯单质的熔、沸点逐渐降低。
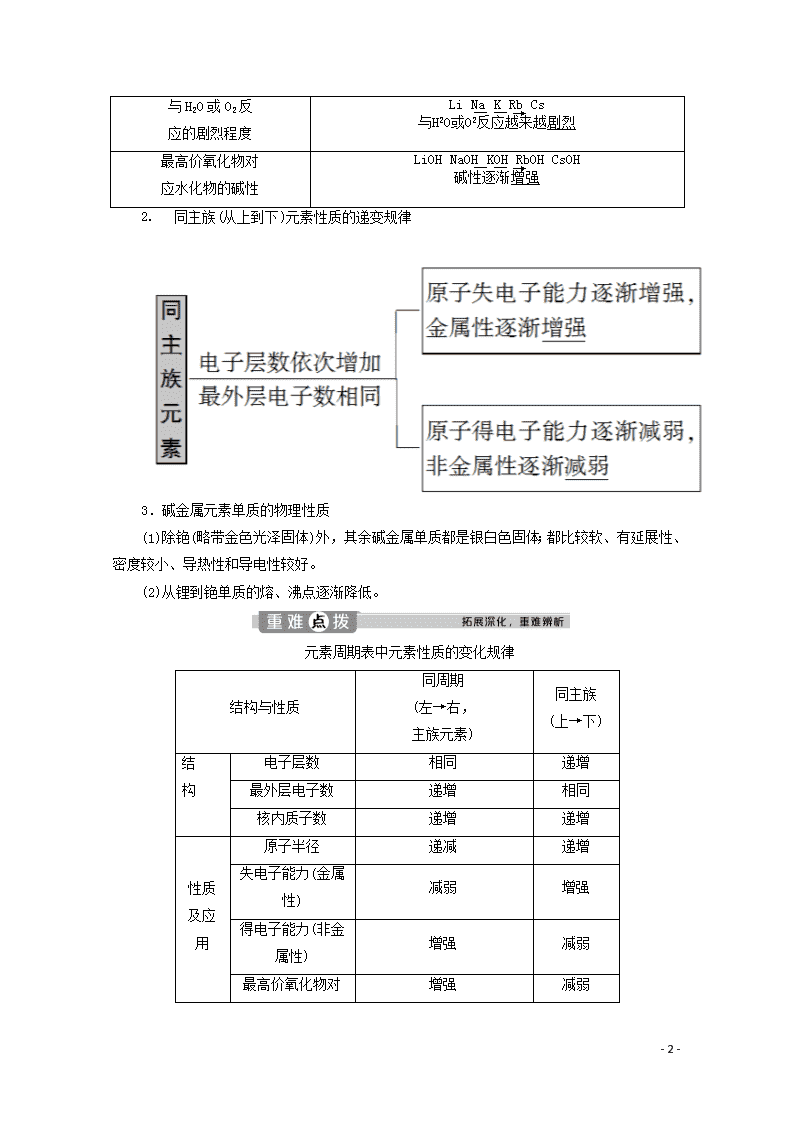
元素周期表中元素性质的变化规律
结构与性质
同周期
(左→右,
主族元素)
同主族
(上→下)
结
构
电子层数
相同
递增
最外层电子数
递增
相同
核内质子数
递增
递增
性质及应用
原子半径
递减
递增
失电子能力(金属性)
减弱
增强
得电子能力(非金属性)
增强
减弱
增强
减弱
- 13 -
最高价氧化物对应
水化物的酸性
最高价氧化物对应
水化物的碱性
减弱
增强
气态氢化物的热稳定性
增强
减弱
气态氢化物的还原性
减弱
增强
铯(钫是放射性元素,不予考虑)是最活泼的金属元素;ⅠA族中碱金属元素不包括氢。
1.判断正误
(1)金属性:Li>Na>K>Rb。( )
(2)碱性:LiOH>NaOH>KOH>RbOH。( )
(3)稳定性:NH3>PH3,还原性:SiH4>CH4。( )
(4)酸性:HNO3
F->Cl->S2-。( )
答案:(1)× (2)× (3)√ (4)× (5)×
2.下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显+1价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④ B.①③⑤
C.②④⑤ D.①②③④⑤
解析:选D。碱金属元素原子的最外层都有1个电子,都易失去1个电子,具有强还原性,显+1价,①③④正确;从Li到Cs,原子半径逐渐增大,原子核对核外电子的束缚力逐渐减弱,失电子能力逐渐增强,②⑤正确。
3.第4周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大
B.氯化物难溶于水
- 13 -
C.原子半径比镁的原子半径小
D.碳酸盐难溶于水
解析:选D。由最外电子层上有2个电子可知该元素为第4周期ⅡA族元素,即钙元素。结合元素周期律、元素性质的递变规律和元素化合物的性质,即可得到答案。
卤族元素的原子结构与性质
1.结构和性质的相似性
2.结构和性质的递变性
结构和性质
递变规律
原子半径
单质的氧化性
阴离子的
还原性
与H2化合的
难易程度
氢化物的
稳定性
最高价氧化物对
应水化物的酸性
(F除外)
卤素单质的物理性质
- 13 -
单质
颜色
状态
水溶液
颜色
有机溶剂中的颜色
熔、沸点
F2
淡黄绿色
气体
—
—
从氟到碘,熔、沸点逐渐升高
Cl2
黄绿色
气体
浅黄绿色
黄绿色
Br2
深红棕色
液体
橙黄色
橙色→橙红色
I2
紫黑色
固体
深黄色→褐色
深紫色→紫红色
卤素单质的化学性质
(1)都能与H2反应。
(2)都能与大多数金属反应,如2Fe+3Br2===2FeBr3;Fe+I2FeI2。
(3)
(4)能与冷的稀碱溶液反应:X2+2NaOH===NaX+NaXO+H2O(F2、I2除外)。
(5)卤素单质间的置换反应
将氯水滴入溴化钠溶液:2NaBr+Cl2===2NaCl+Br2。
将溴水滴入碘化钾溶液:2KI+Br2===2KBr+I2。
卤族元素的特殊性
氟
(1)氟元素无正价,非金属性最强,F-的还原性最弱;
(2)2F2+2H2O===4HF+O2,暗处即爆炸;
(3)HF是弱酸,能腐蚀玻璃,故应保存在铅制器皿或塑料瓶中;
(4)HF有毒;
(5)在HX中HF沸点最高(HF分子间存在氢键,将在今后学到)
溴
(1)Br2是深红棕色液体,易挥发;
(2)Br2易溶于有机溶剂;
(3)保存液溴的试剂瓶中加水,进行水封,不能用橡胶塞
碘
(1)淀粉遇I2变蓝色;
(2)I2加热时易升华;
- 13 -
(3)I2易溶于有机溶剂;
(4)食用盐中加入KIO3可防治甲状腺肿大
随着卤族元素原子半径的增大,下列递变规律正确的是( )
A.单质的熔点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物的稳定性逐渐增强
D.单质的氧化性逐渐增强
解析:选B。随着卤族元素原子半径的增大,卤素单质的熔、沸点逐渐升高,故A错误;卤素离子的还原性逐渐增强,故B正确;气态氢化物的稳定性逐渐减弱,故C错误;单质的氧化性逐渐减弱,故D错误。
下列关于卤素(用X表示)的叙述正确的是( )
A.卤素单质的最外层电子数都是7
B.从上到下,卤素原子的电子层数依次增多,原子半径依次减小
C.其单质都有颜色,都有毒
D.其最高价含氧酸的通式都为HXO4
解析:选C。卤素原子的最外层电子数都是7,A错误;从上到下,卤素原子的电子层数依次增多,原子半径依次增大,B错误;其单质都有颜色,都有毒,C正确;F元素无正价,不存在含氧酸,D错误。
3.X、Y是元素周期表第ⅦA族中的两种元素,X的非金属性比Y强。则下列叙述中正确的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.X的气态氢化物的酸性一定比Y的气态氢化物的酸性强
解析:选C。同一主族,自上而下,元素非金属性逐渐减弱。不要混淆最高价含氧酸的酸性与气态氢化物的酸性,如酸性:HClHBrO4。
课堂小结
合格考训练
1.下列碱金属元素的性质从上到下递变规律正确的是( )
A.金属性逐渐增强
B.化合价逐渐升高
- 13 -
C.失电子能力逐渐减弱
D.最高价氧化物对应水化物的碱性逐渐减弱
解析:选A。元素周期表中,从上到下碱金属元素的金属性逐渐增强,A正确;化合价均是+1价,B错误;从上到下碱金属元素的失电子能力逐渐增强,金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐增强,C、D错误。
2.下列递变情况中正确的是( )
A.F2、Cl2、Br2、I2的熔、沸点依次降低
B.HF、HCl、HBr、HI的还原性依次减弱
C.HF、HCl、HBr、HI的稳定性依次增强
D.HF、HCl、HBr、HI的酸性依次增强
解析:选D。F2、Cl2、Br2、I2的熔、沸点依次升高,A错误;同主族元素自上而下非金属性逐渐减弱,对应氢化物的还原性逐渐增强,则HF、HCl、HBr、HI的还原性依次增强,B错误;同主族元素自上而下非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,则HF、HCl、HBr、HI的稳定性依次减弱,C错误;HF、HCl、HBr、HI的酸性依次增强,D正确。
3.第5周期某主族元素的原子,它的最外电子层只有1个电子,下列描述正确的是( )
A.其单质在常温下跟水反应不如钠剧烈
B.其原子半径比钾原子半径小
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解
解析:选C。由题意可知该元素在元素周期表的第5周期ⅠA族,是Rb。据同主族元素性质的递变性,Rb比Na活泼,与水反应更剧烈,A错误;同主族自上而下原子半径逐渐增大,Rb的半径比K大,B错误;因Na2CO3、K2CO3易溶于水,推断出Rb2CO3易溶于水,C正确;RbOH碱性比NaOH强,RbOH能使Al(OH)3溶解,D错误。
4.下列关于ⅤA族元素(用R代表)的叙述正确的是( )
A.最高化合价是+5
B.气态氢化物的通式为RH5
C.非金属性由上到下逐渐增强
D.其含氧酸均为一元强酸
解析:选A。氮族元素即第ⅤA族元素,最高化合价为+5 价,气态氢化物的通式为RH3,故A对、B错;同主族元素非金属性由上到下逐渐减弱,故C错;HNO2等为弱酸,故D错。
5.(2019·巴中中学高一期中)下列说法中正确的是( )
A.第ⅦA族元素的最高化合价都是+7价
B.第ⅤA族元素的最高化合价一定是+6价
C.第ⅣA族元素的最高化合价都是+4价
- 13 -
D.第ⅠA族元素都是活泼的金属元素
解析:选C。第ⅦA族元素的最高化合价不一定都是+7 价,如F没有正价,A错误;第ⅤA族元素的最高化合价一定是+5价,B错误;第ⅣA族元素的最高化合价都是+4价,C正确;第ⅠA族元素并非都是活泼的金属元素,H是非金属元素,D错误。
6.(2019·北京高一期末)有四种短周期元素,相关信息如下表。
元素代号
相关信息
A
气态氢化物极易溶于水,可用作制冷剂
B
单质的焰色反应为黄色
C
单质是黄绿色气体,可用于自来水消毒
D
-2价阴离子的电子层结构与Ar原子相同
请根据表中信息回答:
(1)A在周期表中位于第________周期________族。
(2)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是________(填化学式)。
(3)已知硒(Se)与D同主族,且位于D的下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是________。
a.其单质在常温下呈固态
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应水化物的化学式为H2SeO3
d.非金属性比元素C的强
解析:A的气态氢化物极易溶于水,可用作制冷剂,则该气体为NH3,A为N元素;B单质的焰色反应为黄色,说明B是Na元素;C元素的单质是黄绿色气体,可用于自来水消毒,则C是Cl元素;元素的原子获得2个电子形成-2价阴离子,元素D的-2价阴离子的电子层结构与Ar原子相同,则D是S元素。
(1)A是N元素,位于第2周期ⅤA族。
(2)元素的非金属性Cl>S,元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以在元素C与D的最高价氧化物对应的水化物中,酸性较强的是HClO4。
(3)a.氧族元素从上到下单质的熔、沸点逐渐升高,S在常温下为固体,则Se在常温下呈固态,a正确;b.由于Se原子最外层有6个电子,最高化合价为+6价,最低化合价为-2价,而在SeO2中Se元素的化合价为+4价,处于中间价态,因此既有氧化性又有还原性,b正确;c.Se原子最外层有6个电子,最高化合价为+6价,所以最高价氧化物对应水化物的化学式为H2SeO4,c错误;d.同主族元素,随原子序数的增大,元素的非金属性逐渐减弱,所以元素的非金属性S>Se,由于非金属性Cl>S,所以元素的非金属性Se比Cl元素的弱,d错误。
答案:(1)2 ⅤA (2)HClO4 (3)ab
等级性测试
- 13 -
1.下列关于同主族元素的说法中错误的是( )
A.同主族元素原子序数递增,元素原子失电子能力逐渐增强
B.同主族元素原子序数递增,单质氧化性逐渐增强
C.同主族元素原子的最外层电子数都相同
D.同主族元素的原子半径,随原子序数增大而逐渐增大
解析:选B。同主族元素原子序数递增,单质氧化性逐渐减弱。
2.砹(At)原子序数为85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是( )
A.砹是有色固体
B.非金属性:At<I
C.HAt非常稳定
D.I2能从砹的可溶性盐溶液中置换出At2
解析:选C。同主族从上到下,元素的单质状态变化为气态→液态→固态,且颜色加深,则砹是有色固体,故A正确;同一主族元素,其非金属性随着原子序数增大而减小,所以非金属性At<I,故B正确;同一主族元素,其非金属性随着原子序数增大而减小,则其相应氢化物的稳定性逐渐减弱,所以HAt很不稳定,故C错误;同一主族元素,其单质的氧化性随着原子序数增大而减弱,所以I2可以把砹从砹的可溶性盐溶液中置换出来,故D正确。
3.以下有关原子结构及元素周期律的叙述正确的是( )
A.ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同主族元素从上到下,原子半径逐渐增大
C.ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
解析:选B。同位素原子的质子数相同;同主族元素从上到下,原子半径逐渐增大,非金属性逐渐减弱,氢化物的稳定性逐渐减弱,金属单质的熔点逐渐降低而非金属单质的熔点一般逐渐升高。
4.如图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )
A.N元素为第1周期元素
B.PH3的稳定性比H2S强
C.该纵列元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱
- 13 -
解析:选D。N元素位于第2周期,A错;非金属性S>P,则PH3的稳定性弱于H2S,B错;N元素最高价氧化物对应水化物的化学式为HNO3,C错;非金属性P>As,故H3AsO4的酸性比H3PO4弱,D对。
5.砷为第4周期ⅤA族元素,根据它在周期表中的位置推测,砷不可能具有的性质是( )
A.AsH3比NH3稳定性强
B.可以存在-3、+3、+5等多种化合价
C.H3AsO4的酸性比HNO3弱
D.砷的非金属性比磷弱
解析:选A。N、P、As均为ⅤA族元素,分别位于第2、3、4周期,根据元素周期律判断,As比N、P的非金属性弱,NH3比AsH3稳定性强,H3AsO4(As2O5对应的水化物)的酸性比HNO3弱。As与N、P同在ⅤA族,N和P都有-3、+3、+5等多种化合价,则As也有-3、+3、+5等多种化合价。
6.元素R的原子序数是15,下列关于元素R的说法中,错误的是( )
A.R的最高正化合价是+5
B.R是第2周期第ⅤA族的元素
C.R的氢化物分子式是RH3
D.R的最高价氧化物对应的水化物的水溶液呈酸性
解析:选B。元素R的原子序数为15,则为磷元素,原子结构示意图为,故为第3周期第ⅤA族元素。
7.下列有关物质性质的比较正确的是( )
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物的酸性越强
⑤还原性:S2->Se2-
⑥酸性:HNO3>H3PO4
A.①③ B.②④
C.③⑥ D.⑤⑥
解析:选C。碱金属元素的单质从上到下熔点逐渐降低,而卤族元素的单质从上到下熔点逐渐升高,①错误;元素的非金属性越强,气态氢化物的热稳定性越强,②错误;元素的非金属性越强,对应单质与水反应越剧烈,则单质与水反应的剧烈程度:F2>Cl2>Br2>I2,③正确;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,但不能比较气态氢化物的酸性,
- 13 -
④错误;非金属性:S>Se,对应离子的还原性:S2-P,最高价氧化物对应水化物的酸性:HNO3>H3PO4,⑥正确。
8.已知钾在空气中燃烧生成KO2。自然界中仅存在极少的金属钫(Fr),它的已知同位素都有放射性,它是碱金属元素中密度最大的元素。根据它在周期表中的位置预测其性质,其中不正确的是( )
A.在已知元素中(稀有气体元素除外),它具有最大的原子半径
B.在空气中燃烧时,生成氧化钫Fr2O
C.最高价氧化物对应的水化物是极强的碱
D.单质的失电子能力比钠强
解析:选B。根据同主族和同周期元素性质递变规律可知,原子半径最大的元素位于周期表的左下角,即为钫,A正确;由于Na在氧气中燃烧生成Na2O2,K在氧气中燃烧生成KO2,据此可知,Fr在空气中燃烧应生成比Fr2O更复杂的氧化物,B错误;根据同主族元素性质递变规律可知,碱金属元素最高价氧化物对应水化物的碱性从上到下逐渐增强,C正确;碱金属元素从上到下,失电子能力逐渐增强,D正确。
9.已知常温下氯酸钾与浓盐酸反应放出氯气,现进行如图氯气的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
选项
①
②
③
④
A
黄绿色
橙色
蓝色
无色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
白色
D
黄绿色
无色
紫色
白色
解析:选C。常温下氯酸钾与浓盐酸反应放出Cl2,Cl2的颜色是黄绿色,①处充满黄绿色的Cl2;Cl2进入玻璃管后与②处NaBr溶液发生置换反应生成Br2,溴的水溶液颜色为橙色,所以②处的白色棉球变为橙色;Cl2和③处KI溶液反应置换出I2,淀粉遇I2变蓝,所以③处的棉球变为蓝色;④处Cl2与NaOH溶液反应生成NaCl、NaClO,用来进行Cl2的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色。
10.(2019·天津高一月考)用化学用语填空。
- 13 -
(1)短周期元素中,金属性最强的是________,非金属性最强的是________;最高价氧化物对应的水化物中酸性最强的是__________,碱性最强的是__________。
(2)第3周期主族元素中,原子半径最小的是________,离子半径最小的是________。
(3)碱金属元素中(除Fr外),单质密度最小的是______,熔点最低的是__________。
(4)卤素中得电子能力最强的元素在周期表中的位置为________________。
解析:(1)同周期元素自左而右金属性逐渐减弱、非金属性逐渐增强,同主族元素自上而下金属性逐渐增强、非金属性逐渐减弱,所以短周期元素中,金属性最强的元素是Na,非金属性最强的元素是F;元素的非金属性越强,则最高价氧化物对应的水化物的酸性越强,又F无正价,所以最高价氧化物对应的水化物中酸性最强的是HClO4;元素的金属性越强,则最高价氧化物对应的水化物的碱性越强,所以最高价氧化物对应的水化物中碱性最强的是NaOH。
(2)同周期自左而右主族元素的原子半径逐渐减小,所以第3周期主族元素中,原子半径最小的元素是Cl;电子层数越少,核电荷数越大,则简单离子的半径越小,所以离子半径最小的是Al3+。
(3)碱金属元素中(除Fr外),随核外电子层数递增,单质的密度呈增大的趋势,但K的密度比Na小,单质的熔点逐渐降低,所以碱金属中密度最小的是Li,熔点最低的是Cs。
(4)卤素中得电子能力最强的元素是F,在周期表中的位置为第2周期ⅦA族。
答案:(1)Na F HClO4 NaOH (2)Cl Al3+
(3)Li Cs (4)第2周期ⅦA族
11.下表是元素周期表中的一部分。
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
A
2
E
F
H
J
3
B
C
D
G
I
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是______,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
解析:由元素在周期表中的位置可知,A为H,B为Na,C为Mg,D为Al,E为C,F为N,G为S,H为F,I为Cl,J为Ne。(1)题给元素中稀有气体元素Ne最外层电子数为8,化学性质最稳定;同周期元素自左而右金属性逐渐减弱、非金属性逐渐增强,而同
- 13 -
主族元素自上而下金属性逐渐增强、非金属性逐渐减弱,题给元素中F的非金属性最强,故F2的氧化性最强,Na的金属性最强,其单质还原性最强。(2)题给元素中,Na的金属性最强,则其最高价氧化物对应的水化物NaOH的碱性最强,F元素没有含氧酸,高氯酸的酸性最强,题给元素中的最高价氧化物对应的水化物中只有Al(OH)3呈两性。(3)非金属性越强,简单气态氢化物越稳定,C、N、S、F、Cl中F的非金属性最强,故HF最稳定。(4)原子半径:Na>Mg>Al>S>Cl。
答案:(1)Ne F2 Na (2)NaOH HClO4
Al(OH)3 (3)HF (4)Na
12.(2019·衡水高一月考)元素在周期表中的位置反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
(1)根据元素周期律,请你预测H2SO4、H2SeO4的酸性强弱:H2SeO4________H2SO4(填“>”“<”或“=”)。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在元素周期表中的______族。
(3)元素甲是第3周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为________________________________________________________________
________________________________________________________________________。
(4)元素周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用。已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为________。
解析:(1)同主族元素从上到下非金属性逐渐减弱,则最高价氧化物对应水化物的酸性逐渐减弱,则酸性:H2SeO4<H2SO4。(2)根据最高正价与最低负价的绝对值相等,可把氢元素放在元素周期表中的ⅣA族。(3)第3周期金属元素中原子半径最小的元素为Al,铝离子与过量氨水反应生成氢氧化铝沉淀与铵根离子,反应的离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH。(4)R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则最外层电子数为6,处于第4周期ⅥA族,为Se元素。
答案:(1)< (2)ⅣA
(3)Al3++3NH3·H2O===Al(OH)3↓+3NH
(4)硒
- 13 -