- 2021-07-06 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学人教版选修3学案:1-1-2 电子云和原子轨道 Word版含解析
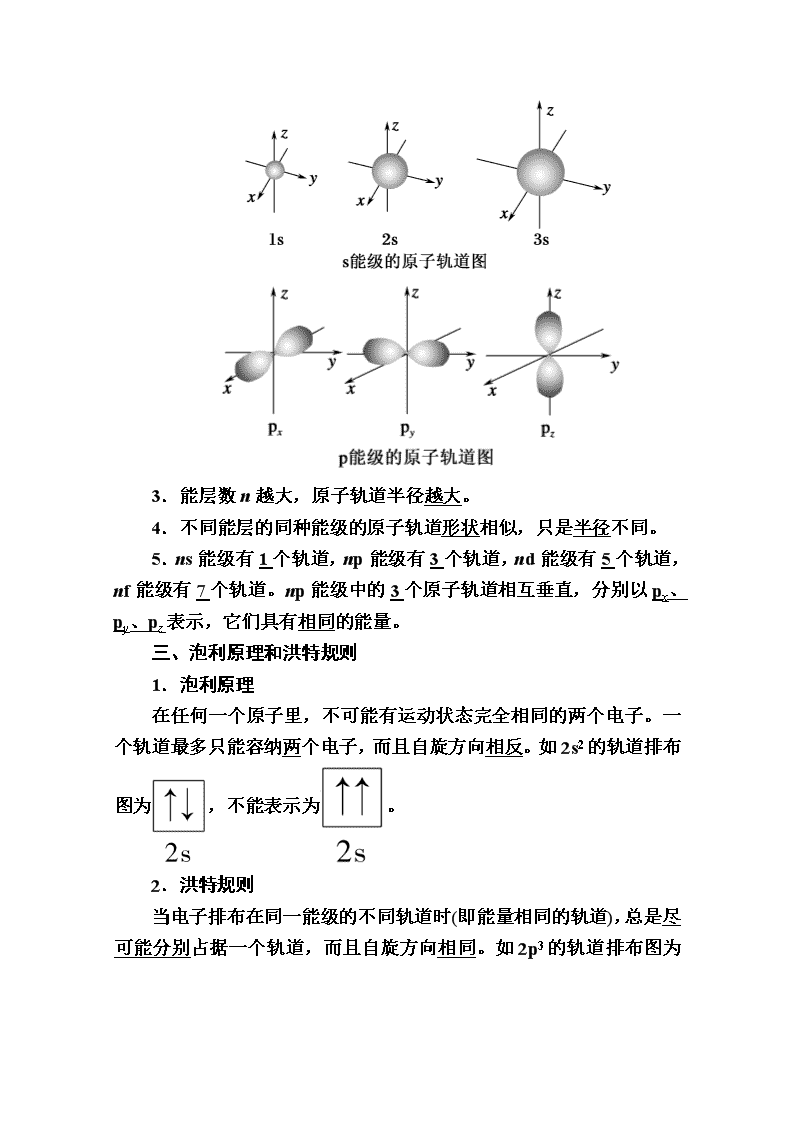
www.ks5u.com 第二课时 电子云和原子轨道 [学习目标] 1.知道电子在原子核外的运动状态。 2.知道核外电子排布应同时遵循泡利原理和洪特规则。 3.通过日常生活现象理解核外电子运动、电子云轮廓图和原子核外电子运动的状态。 一、电子云 1.概念 一定时间间隔内电子在原子核外出现概率的分布图。 2.电子云轮廓图的制作 3.电子云图中黑点不代表一个电子,每个黑点表示电子出现过一次。 4.黑点疏密的程度表示了电子在原子核外出现的概率的大小。点疏的地方表示电子在那里出现的概率小,点密集的地方表示电子在那里出现的概率大。 5.离核越近,电子云出现的概率越大,电子云越密集。如2s电子云比1s电子云更扩散。 6.s能级的电子云为球形,只有一种空间伸展方向。p电子云有三种空间伸展方向。 二、原子轨道 1.定义:原子轨道即电子云的轮廓图。 2.原子轨道的形状 s能级原子轨道是球形的,p能级原子轨道是纺锤形的。 3.能层数n越大,原子轨道半径越大。 4.不同能层的同种能级的原子轨道形状相似,只是半径不同。 5.ns能级有1个轨道,np能级有3个轨道,nd能级有5个轨道,nf能级有7个轨道。np能级中的3个原子轨道相互垂直,分别以px、py、pz表示,它们具有相同的能量。 三、泡利原理和洪特规则 1.泡利原理 在任何一个原子里,不可能有运动状态完全相同的两个电子。一个轨道最多只能容纳两个电子,而且自旋方向相反。如2s2的轨道排布图为,不能表示为。 2.洪特规则 当电子排布在同一能级的不同轨道时(即能量相同的轨道),总是尽可能分别占据一个轨道,而且自旋方向相同。如2p3的轨道排布图为 ,不能表示为。 知识点一 电子云和原子轨道 一、电子云 1.电子运动的特点 (1)质量非常小(电子质量仅为9.1×10-31kg)。 (2)运动速度很快(如在1 000 V电压下加速的电子的速度可高达1.9×107 m/s)。 (3)不能同时准确测定它的位置和速度。 2.电子云 (1)定义 电子在原子核外的运动可以用电子在核外空间出现概率的大小来描述。通常用小黑点的疏密程度来表示电子在原子核外出现概率的大小。由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云。 (2)电子云的意义 ①电子云中的小黑点并不代表一个电子而是代表电子在该处出现过一次。小黑点的疏密程度表示电子在原子核外出现的概率大小。小黑点稀疏的地方,表示电子在该处出现的概率小;小黑点密集的地方,表示电子在该处出现的概率大。 ②离核越近,电子出现的概率越大,小黑点越密集。如2s电子云比1s电子云更扩散。 (3)电子云图和电子云轮廓图 这种形象地描述电子在空间出现的概率大小的图形称为电子云图。如右图所示是在一定时间间隔内1s电子在原子核外出现的概率密度的形象描述。电子云图很难绘制,使用不便,可用电子云轮廓图来描绘电子云轮廓的形状,电子云轮廓图的绘制过程如图所示。 (4)电子云的形状 ①s电子的电子云轮廓图为球形,只有一种空间伸展方向。所有原子的任一能层的s电子的电子云轮廓图都是一个球形,只是球的半径大小不同(如下图所示)。 ②p电子云是哑铃状的,有x、y、z三种空间伸展方向,无论2p、3p、4p……哪一个p能级都有三个相互垂直的电子云,分别为px、py、pz,px、py、pz表示的是p电子云在坐标里的取向,如下图所示。 二、原子轨道 1.原子轨道的空间伸展方向 s电子的原子轨道为球形对称,ns能级只有1个轨道,可表示为:;p电子的原子轨道是哑铃状的,在空间中有x、y、z三个伸展方向,所以np能级有px、py、pz 3个轨道,可表示为:;nd能级有5个轨道,可表示为:;nf能级有7个轨道,可表示为:。 2.各原子轨道的能量高低 多电子原子中,电子填充原子轨道时,原子轨道能量的高低存在以下规律: ①相同能层上原子轨道能量的高低顺序为:ns查看更多
相关文章
- 当前文档收益归属上传用户