- 2021-07-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省南安市侨光中学高一下学期第四次阶段考试化学试题
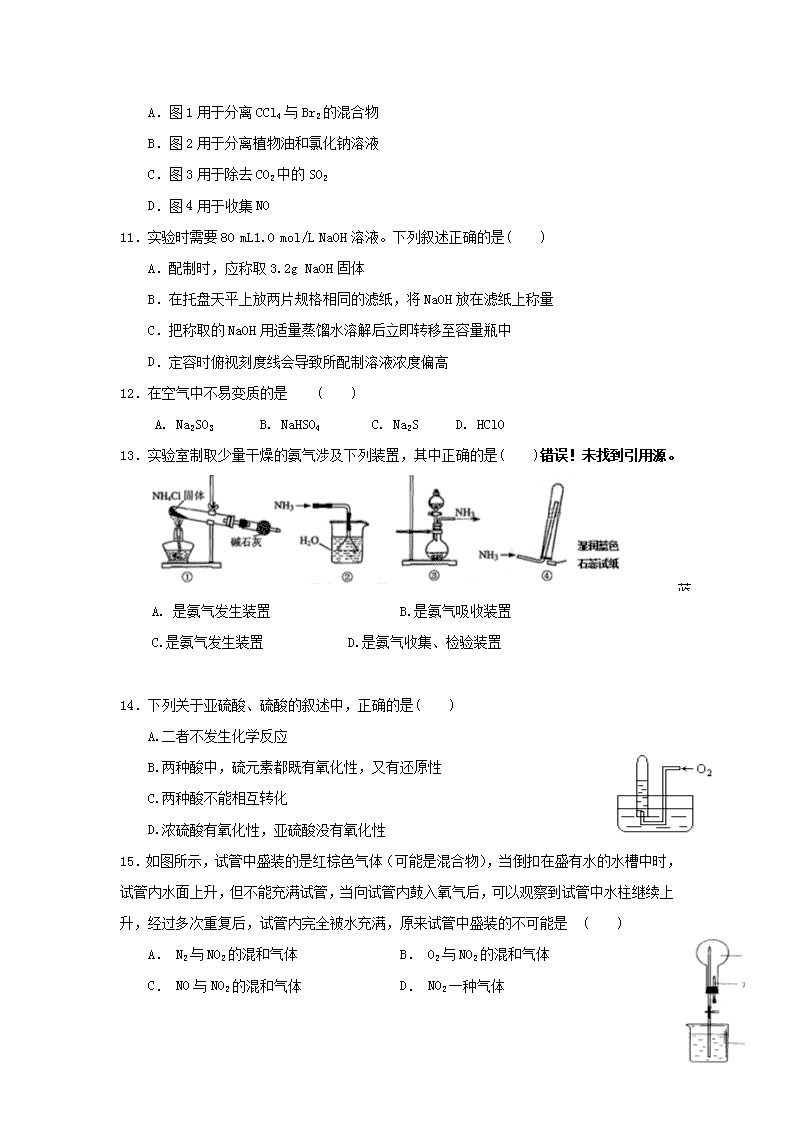
2018-2019学年福建省南安市侨光中学高一下学期第四次阶段考试化学试题 可能用到的相对原子质量:H:1 O:16 Ne :20 Na :23 Cu :64 第I卷(共54分) 1.我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( ) A. 烧碱溶液 B. 醋酸 C. 硝酸 D. 氢氟酸 2.下列说法不正确的是( ) A.液氨常用于制冷剂 B.“84”消毒液的主要成分是NaClO C.Na2O2可用于潜水艇中的供氧剂 D.常温下,浓硫酸与Fe反应放出SO2 3.下列化学物质在实际生产、生活和科技等方面的叙述正确的是( ) A.在食品袋中放有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质 B. SO2、漂白粉、活性炭、Na2O2都能使品红溶液褪色,其原理相同 C.二氧化硅是太阳能电池的主要材料 D. 某雨水样品放置一段时间后,酸性增强,是因为溶解了CO2 4.下列物质的存放方法正确的是( ) A. 氢氧化钠可保存在带磨口玻璃塞的试剂瓶中 B. 液溴存放在加有少量水的棕色试剂瓶中 C. 氢氟酸密封保存在细口玻璃瓶中 D. 浓硝酸保存在无色试剂瓶中 5.关于工业制硫酸的说法正确的是( ) A. 沸腾炉中,含硫矿物燃烧生成SO3 B. 吸收塔中,用水吸收SO3生成H2SO4 C. 接触室中,使用催化剂 D. 硫酸工业中,不会产生污染性尾气 6.设NA为阿伏加德罗常数,下列叙述中正确的是( ) A. 标准状况下,22.4 L CCl4含有的分子数为NA B. 1mol氯气与足量铁粉充分反应,转移的电子数为3NA C. 16 g O2和O3的混合气体中含氧原子数目为NA D. 1mol/L Na2CO3溶液中含有Na+数目为2NA 7.以下各组物质中与34gOH-所含电子数相同的是( ) A.常温下,20g氖气 B. 标准状况下,44.8L甲烷 C. 2mol/L NaOH溶液中的Na+ D. 2L 1mol/L氢氟酸中的F- 8.下列各组离子,在酸性溶液中能大量共存的是( ) A. K+、OH-、Cl- 、SO42- B. Na+、Fe2+、NO3-、Cl- C. Na+、SO32-、Al3+、Cl- D. Na+、Mg2+、NO3-、SO42- 9.下列实验操作正确且能达到相应实验目的的是( ) 选项 实验目的 实验操作 A 制取SO2 常温下,将浓硫酸与Cu混合 B 检验SO2中混有CO2 将混合气体通入澄清石灰水中 C 检验溶液中是否含有NH4+ 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 D 制备Fe(OH)2 直接往 FeSO4溶液中滴加NaOH溶液 10.下列实验装置能够实现相应实验目的的是( ) A.图1用于分离CCl4与Br2的混合物 B.图2用于分离植物油和氯化钠溶液 C.图3用于除去CO2中的SO2 D.图4用于收集NO 11.实验时需要80 mL1.0 mol/L NaOH溶液。下列叙述正确的是( ) A.配制时,应称取3.2g NaOH固体 B.在托盘天平上放两片规格相同的滤纸,将NaOH放在滤纸上称量 C.把称取的NaOH用适量蒸馏水溶解后立即转移至容量瓶中 D.定容时俯视刻度线会导致所配制溶液浓度偏高 12.在空气中不易变质的是 ( ) A. Na2SO3 B. NaHSO4 C. Na2S D. HClO 蓝色 13.实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )错误!未找到引用源。 蓝色 A. 是氨气发生装置 B.是氨气吸收装置 C.是氨气发生装置 D.是氨气收集、检验装置 14.下列关于亚硫酸、硫酸的叙述中,正确的是( ) A.二者不发生化学反应 B.两种酸中,硫元素都既有氧化性,又有还原性 C.两种酸不能相互转化 D.浓硫酸有氧化性,亚硫酸没有氧化性 15.如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是 ( ) A. N2与NO2的混和气体 B. O2与NO2的混和气体 C. NO与NO2的混和气体 D. NO2一种气体 a 16.如图:烧瓶中充满干燥气体a,将滴管中的液体b 挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是 ( ) b A. a为HCl,b为H2O B. a为CO2,b为浓NaOH溶液 b C. a为Cl2,b为饱和NaCl溶液 D. a为NH3,b为浓NH4Cl溶液 17.48.0g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22. 4L气体(标准状况下),则反应中消耗HNO3的物质的量是( ) A. 2mol B. 2.5 mol C. 3 mol D.3.5 mol 18.把含硫酸铵和硝酸铵的混合液a L分成两等份。一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3- 的浓度(mol/L)为( ) A. B. C. D. 2019年春南安市侨光中学高一年第4次阶段考试 化 学 科 第II卷(共46分) 19. (12分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。 请回答: (1)写出步骤Ⅰ反应的离子方程式:_________________________________________________________________。 (2)试剂X是____________,溶液D是____________。 (3)在步骤Ⅱ时,用如图装置制取CO2 并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是________________________________________。 (4) 工业上常用溶液E制得净水剂Na2FeO4,流程如下: ①测得溶液E中c(Fe2+)为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25%的H2O2溶液______________kg。②写出由Fe(OH)3制取Na2FeO4的离子方程式:(已知NaClO还原为NaCl)_____________________________________________________________。 20.(10分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。 (1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离.该组学生设计此步操作的目的为____________________________________________________。 (2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为______________________________________。 (3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是_______________________ __________________________________________________________________。 (4)一段时间后,C中白色沉淀溶解,其原因是__________________________________________________________________。 (5)装置D的作用是______________________________________________。 21.(14分) 某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: (1)若A为浓氨水,B为烧碱,C中盛有AlCl3溶液, 旋开活塞E,足够长时间后,观察到C中的现象为_________________________________________________。 (2)若A为30%的H2O2溶液,B为二氧化锰,C中盛有 酸化过的FeCl2溶液,旋开活塞E后, C中发生反应 的离子方程式为__________________________________________。 (3)利用上述装置还可以验证物质的性质,如设计证明氧化性: KMnO4 >Cl2 >Br2,则A中加浓盐酸,B中加 ,C中加 溶液,观察到C中的现象是________________________________________________。 (4)利用上述装置还可以验证SO2的化学性质, A为硫酸,B为亚硫酸钠,那么C中盛有_____________溶液,可验证其还原性; 而C中盛有______________ 溶液,可验证其漂白性。 22.(10分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。 (1)若A与NaOH反应,既可只生成B, 又可只生成C,还可生成B+C。 写出符合上述反应关系的A的2种不同类物质的化学式_______、__________。 (2) 若A与NaOH无论以何种物质的量比反应, 其产物必为B+C,则A的化学式可能是__________(只写一种),R在A、 B 、C中的化合价必须满足的条件是________________,该反应的离子方程式为__________________________。 1-18:CDABC CBDCB DBCAA CBB 19. (1). 2Al+2H2O+2OH-===2AlO2-+3H2↑ Al2O3+2OH-===2AlO2-+H2O (2). 稀硫酸(或稀H2SO4) , NaHCO3溶液 (3).在a和b间加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl (4) 13.6 2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O 20. (1)产生二氧化碳,排出装置中的空气; (2)3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O; (3)二氧化碳密度大于空气,未能排尽烧瓶中的空气,少量NO与空气中的氧气反应生成少量的红棕色的NO2;鼓入空气后,NO与氧气反应,生成大量的红棕色气体二氧化氮; (4)二氧化氮与水反应生成硝酸,硝酸使白色沉淀碳酸钙溶解; (5)吸收尾气,防止污染大气. 21、共14分 (每空各2分) (1)产生白色沉淀 (2)O2+4Fe2++4H+=4Fe3++2H2O (3)KMnO4, NaBr 无色溶液变成橙色或黄色 (4)氯水或溴水或酸性高锰酸钾 品红 22. (1)CO2,SO2 (2) Cl2 ,R在A中的化合价处于B、C中化合价之间,Cl2 +2OH- =Cl- +ClO- +H2O 查看更多