- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河北省永年县一中高二上学期开学考试化学试题
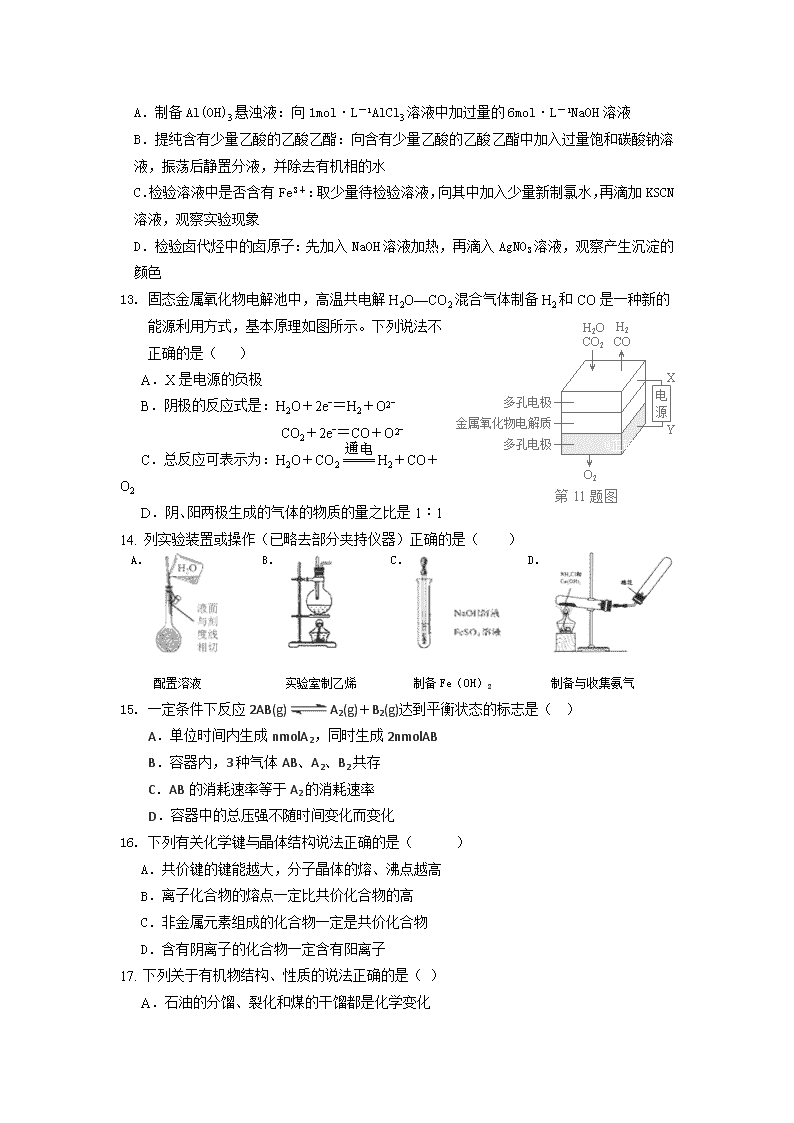
2017-2018学年河北省永年县一中高二上学期开学考试化学试题 命题人:逯丽霞 注意: 1.本试卷分I卷II卷,时间90分钟,满分100分 2.可能用到的相对原子质量:H—1,C—12, N—14,O—16,Al—27,Cu—64,Ca--40 第I卷(选择题,共40分) 一.选择题(每题只有一个正确选项,本题包含20 题,每题2分,共40分) 1. 2016年10月5日,法国、美国和荷兰三位科学家因在“分子机器设计合成”做出贡献而荣获该年度诺贝尔化学奖。他们利用原子、分子的组合,制作出了最小的分子马达和分子车。下列相关说法不正确的是( ) A.化学家可以在微观层面上操纵分子和原子,组装分子材料 B.化学是一门具有创造性的科学,化学的特征就是认识分子和制造分子 C.化学是在原子、分子的水平上研究物质的一门自然科学 D.化学变化中分子和原子都可以重新组合成新的分子和原子 2. 20世纪80年代后,人们发现和证实了一种新的含碳物质,它们是由一系列偶数个碳原子组成的分子,其中C60最具代表性。图中所示为n个C60连接而成的物质X 。下列有关说法不正确的是( ) A.X难溶于水,可以与氧气反应生成C02 B.该物质是一种新型的化合物 C.X是碳的一种同素异形体 D.X的摩尔质量为720ng·mol-1 3. 取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,标准状况下均产生5.6L气体,则两份铝片的质量之比为( ) A.一定为1:1 B.可能为2:3 C.一定为3:2 D.可能为1:6 4. 下列叙述中正确的是( ) A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 B.除短周期外,其他周期均有18种元素 C.副族元素中没有非金属元素 D.碱金属元素是指IA族的所有元素 5. 下列有关化学用语的说法中正确的是( ) A.次氯酸的结构式为:H—Cl—O B.-OH 表示羟基 C.N2的电子式: D.聚乙烯可以发生加成反应 6.能够用健能解释的是( ) A.氮气的化学性质比氧气稳定 B.常温常压下,溴呈液体,碘呈固体 C.稀有气体一般很难发生化学反应 D.硝酸易挥发,硫酸难挥发 a b c 7. 短周期中三元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( ) A.a是一种活泼的非金属元素 B.c的最高价氧化物的水化物是一种弱酸 C.b的氢化物很稳定 D.b元素的最高化合物为+7价。 8. 在无色透明的酸性溶液中,能大量共存的离子组是( ) A.Na+、K+、HCO3-、NO3- B.NH4+、A13+、SO42-、NO3- C.K+、SO32-、NH4+、NO3- D.NH4+、Na+、NO3-、SiO32- 9. 设NA表示阿伏伽德罗常数的值,下列说法正确的是 A.在标准状况下,以任意比例混合的CH4与CO2 的混合物22.4L,所含有的分子数为NA B.在标准状况下,NA 个H2O 分子所占体积为22.4L C.常温常压下, 1mol Cl2与氢氧化钠溶液反应,发生转移的电子数为2NA D.常温常压下,28g氮气含有的核外电子数为10 NA 10. 下列离子方程式的书写正确的是( ) A.大理石溶于醋酸中: CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O B.H2SO4溶液与Ba(OH)2溶液反应: Ba2++OH-+H++SO42-=BaSO4↓+H2O C.将Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu↓ D.将Cl2通入水中:Cl2+H2O=2H-+Cl-+ClO- 11. 把L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗molBaCl2,则原溶液中(NO)为( ) A.mol·L-1 B.mol·1-1 C.mol·L-1 D.mol·L-1 12. 下列设计的实验方案能达到实验目的的是( ) A.制备Al(OH)3悬浊液:向1mol·L-1AlCl3溶液中加过量的6mol·L-1NaOH溶液 B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 C.检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 D.检验卤代烃中的卤原子:先加入NaOH溶液加热,再滴入AgNO3溶液,观察产生沉淀的颜色 13. 固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( ) A.X是电源的负极 B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ CO2+2eˉ=CO+O2ˉ C.总反应可表示为:H2O+CO2H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是1︰1 14. 列实验装置或操作(已略去部分夹持仪器)正确的是( ) A. 配置溶液 B. 实验室制乙烯 C. 制备Fe(OH)2 D. 制备与收集氨气 15. 一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是( ) A.单位时间内生成nmolA2,同时生成2nmolAB B.容器内,3种气体AB、A2、B2共存 C.AB的消耗速率等于A2的消耗速率 D.容器中的总压强不随时间变化而变化 16. 下列有关化学键与晶体结构说法正确的是( ) A.共价键的键能越大,分子晶体的熔、沸点越高 B.离子化合物的熔点一定比共价化合物的高 C.非金属元素组成的化合物一定是共价化合物 D.含有阴离子的化合物一定含有阳离子 17. 下列关于有机物结构、性质的说法正确的是( ) A.石油的分馏、裂化和煤的干馏都是化学变化 B.乙烯分子与苯分子都能与H2发生加成反应,说明二者所含碳碳键相同 C.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 D.淀粉、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 18.下列离子检验的方法正确的是 A.向某无色溶液中加入BaCl2溶液,产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- B.向某无色溶液中加入盐酸,有无色、无味的气体产生,则说明原溶液中一定有CO32- C.向某无色溶液中加入氢氧化钠溶液并加热,产生无色气体,该气体可使蓝色石蕊试纸变红,则说明原溶液中一定有NH4+ D.向某溶液中滴加硫氰化钾溶液,溶液不变红,再滴加氯水,溶液变红,说明原溶液一定有Fe2+ 19. 一定条件下,对于可逆反应:X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( ) A.c1∶c2=1∶3 B.平衡时Y和Z的生成速率之比为2∶3 C.X、Y的转化率之比为1:3 D.c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1 20. 将Cl2通入200mL0.5mol·L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1︰2,则通入的Cl2在标准状况下的体积为 A.0.56L B.1.68L C.2.24L D.1.12L 第II卷(非选择题,共60分) 21.(9分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和,并含有3.5%(质量分数). (1)与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与形成的化合物E的沸点 .(填“高”或“低”) (2)配平用钙线氧脱鳞的化学方程式: P+ FeO+ CaO + Fe (3)将钙线试样溶于稀盐酸后,加入过量溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色.则金属M为___ ___(填元素符号);检测溶液中含有的方法是 . (4)取1.6g钙线试样,与水充分反映,生成224ml.(标准状况),在此溶液中通入适量的,最多能得到 g. 22.(7分)X、Y、Z、W有如图所示的转化关系: (1)若X单质的一种同素异形体是一种黑色的非金属单质,则Y转化为Z的化学方程式__ ___,Z的晶体类型 晶体。 (2)若X为一种金属的氯化物,Y是一种常见的两性氢氧化物,W为化工常用的强碱,写出Y与W反应的离子方程式______ _______。 (3)若X是一种活泼的金属单质,Z是一种淡黄色的化合物,Z的化学式 ,则Z转化为W的化学方程式__ 。 23. (11分)工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水。现模拟该过程用图示装置进行实验: (1)仪器a的名称为________,装置A的圆底烧瓶中发生反应的化学方程式为__ ______,为保持装置C为无水环境,装置B中加入的试剂是________。 (2)实验步骤:如图连接装置后,先____ ____(填实验操作),再点燃 处的酒精灯。(填A或C) (3)装置D的作用是_____ ,_____ __。 (4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有________(填试剂名称)的洗气装置除去;乙同学认为不需要除去HCl,理由为___ __。 24. (11分) 现有A、B、C、D、E、F六种短周期元素,原子序数依次增大.已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等. 请回答下列问题: (1)元素B在周期表中的位置是_ _,元素D的原子结构示意图为___ _ __. (2)A2C比A2E沸点高的原因是___ ___. (3)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为__ ____,负极的电极反应式为____ __,该电池在放电过程中,电解质溶液的pH将______(填“增大”、“减小”或“不变”). (4)化合物B2A4和B2C4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染.1mol B2A4与B2C4完全反应生成两种气体时放出热量516.8kJ,则该反应的热化学方程式为___ ___. 25. (10分)从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题: (1)A的电子式_____ __,B的结构简式____ __。 (2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_____ __,反应类型:________。 (3)在碘水中加入B振荡静置后的现象_____ ___________。 (4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:______ ___,反应类型:________。 (5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A查看更多