- 2021-07-06 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习鲁科版选修3第3节晶体结构与性质学案
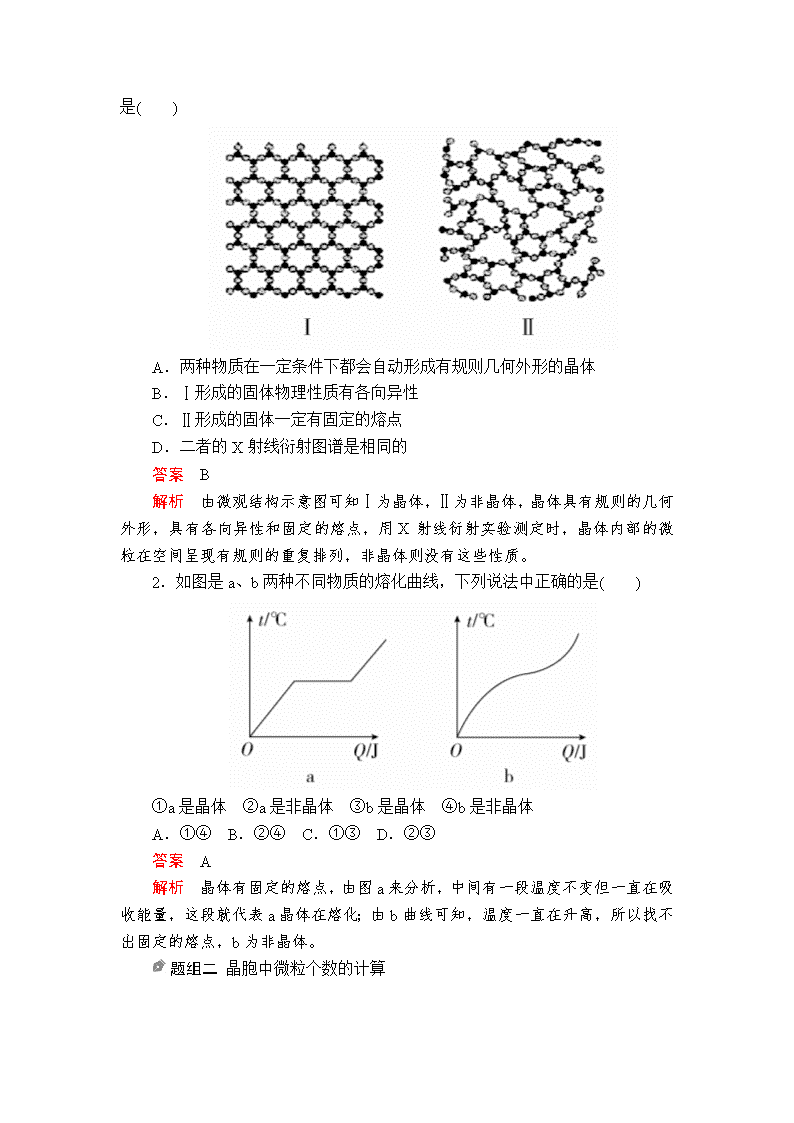
第3节 晶体结构与性质 [考试说明] 1.了解晶体的类型,了解不同类型晶体中组成微粒、微粒间作用力的区别。2.了解晶格能的概念,了解晶格能对离子晶体性质的影响。3.了解分子晶体结构与性质的关系。4.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。5.理解金属键的含义,能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。6.了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。 [命题规律] 本节是选修3的重要组成部分,在高考中占有极其重要的地位。高考主要考查晶体类型的判断;晶体熔、沸点高低的比较;晶胞组成的计算;有关晶体密度的计算,而晶体密度的计算具有一定难度。 考点1 晶体和晶胞 知识梳理 1.晶体与非晶体 2.获得晶体的三条途径 (1)熔融态物质凝固。 (2)气态物质冷却不经液态直接凝固(凝华)。 (3)溶质从溶液中析出。 3.晶胞 (1)概念 描述晶体结构的基本单元。 (2)晶体中晶胞的排列——无隙并置 ①无隙 相邻晶胞之间没有任何间隙。 ②并置 所有晶胞平行排列、取向相同。 ③形状 一般而言晶胞都是平行六面体。 (1)具有规则几何外形的固体不一定是晶体,如玻璃。 (2)晶体与非晶体的本质区别:是否有自范性。 (3)晶胞是从晶体中“截取”出来具有代表性的“平行六面体”,但不一定是最小的“平行六面体”。 判断正误,正确的画“√”,错误的画“×”,错误的指明错因。 (1)具有规则几何外形的固体一定是晶体。(×) 错因:非晶体也可能具有规则的外形,如玻璃有规则的几何外形,所以具有规则外形的固体不一定是晶体。 (2)晶体内部的微粒按一定规律周期性地排列。(√) 错因:__________________________________________________________ (3)区分晶体和非晶体最可靠的方法是测定其有无固定熔、沸点。(×) 错因:区分晶体与非晶体最可靠的方法是对固体进行X-射线衍射实验。 (4)通过X射线衍射实验的方法可以区分晶体和非晶体。(√) 错因:__________________________________________________________ (5)立方晶胞中,顶点上的原子被4个晶胞共用。(×) 错因:立方晶胞中,顶点上的原子被8个晶胞共用。 (6)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的晶体。(√) 错因:__________________________________________________________ 题组训练 题组一 晶体与非晶体的区别 1.如图是物质的微观结构示意图,请认真观察两图,判断下列说法正确的是( ) A.两种物质在一定条件下都会自动形成有规则几何外形的晶体 B.Ⅰ形成的固体物理性质有各向异性 C.Ⅱ形成的固体一定有固定的熔点 D.二者的X射线衍射图谱是相同的 答案 B 解析 由微观结构示意图可知Ⅰ为晶体,Ⅱ为非晶体,晶体具有规则的几何外形,具有各向异性和固定的熔点,用X射线衍射实验测定时,晶体内部的微粒在空间呈现有规则的重复排列,非晶体则没有这些性质。 2.如图是a、b两种不同物质的熔化曲线,下列说法中正确的是( ) ①a是晶体 ②a是非晶体 ③b是晶体 ④b是非晶体 A.①④ B.②④ C.①③ D.②③ 答案 A 解析 晶体有固定的熔点,由图a来分析,中间有一段温度不变但一直在吸收能量,这段就代表a晶体在熔化;由b曲线可知,温度一直在升高,所以找不出固定的熔点,b为非晶体。 题组二 晶胞中微粒个数的计算 3.某物质的晶体中含有A、B、C三种元素,其排列方式如图所示(其中前后两面面心中的B元素的原子未能画出)。则晶体中A、B、C的原子个数比为( ) A.1∶3∶1 B.2∶3∶1 C.2∶2∶1 D.1∶3∶3 答案 A 解析 利用均摊法计算。据图知,该正方体中A原子个数=8×=1,B原子个数=6×=3,C原子个数=1,所以晶体中A、B、C的原子个数比为1∶3∶1。 4.(1)Ti的氧化物和CaO相互作用形成钛酸盐,其晶胞结构如图所示。该晶胞中Ca2+的配位数是________。 (2)M原子的外围电子排布式为3s23p5,与铜形成化合物的晶胞如图所示(黑点代表铜原子),该晶体的化学式为________。 答案 (1)12 (2)CuCl 解析 (1)根据晶胞图可知,距离Ca2+最近且距离相等的O2-有12个,故Ca2+的配位数为12。 (2)根据M的外围电子排布式为3s23p5,确定M为Cl元素,该晶胞中Cl原子数目=8×+6×=4,Cu原子数目=4,故化学式为CuCl。 晶胞中粒子数目的计算方法——均摊法 (1)晶胞任意位置上的一个粒子如果是被n个晶胞所共有,那么,每个晶胞对这个粒子分得的份额就是。 (2)方法 ①长方体(包括立方体)晶胞中不同位置的粒子数的计算 ②非长方体晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占。 考点2 四类晶体的组成和性质 知识梳理 1.四种类型晶体的比较 2.离子晶体的晶格能 (1)定义:气态离子形成1摩尔离子晶体释放的能量,通常取正值,单位:kJ·mol-1。 (2)影响因素 ①离子所带电荷数:离子所带电荷数越多,晶格能越大。 ②离子的半径:离子的半径越小,晶格能越大。 (3)与离子晶体性质的关系 晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。 (1)原子晶体一定含有共价键,而分子晶体可能不含共价键。 (2)含阴离子的晶体中一定含有阳离子,但含阳离子的晶体中不一定含阴离子,如金属晶体。 (3)原子晶体的熔点不一定比离子晶体高,如石英的熔点为1710 ℃,MgO的熔点为2852 ℃。 (4)金属晶体的熔点不一定比分子晶体的熔点高,如Na的熔点为97 ℃,尿素的熔点为132.7 ℃。 (5)由原子形成的晶体不一定是原子晶体,如由稀有气体形成的晶体是分子晶体。 (6)依据导电性判断晶体类型 ①离子晶体溶于水及熔融状态时能导电。 ②原子晶体一般为非导体。 ③分子晶体为非导体,而某些分子晶体(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。 ④金属晶体是电的良导体。 判断正误,正确的画“√”,错误的画“×”,错误的指明错因。 (1)由金属元素和非金属元素组成的晶体一定是离子晶体。(×) 错因:由金属与非金属元素组成的晶体不一定是离子晶体,如AlCl3属于分子晶体。 (2)在晶体中只要有阴离子就一定有阳离子。(√) 错因:__________________________________________________________ (3)在晶体中只要有阳离子就一定有阴离子。(×) 错因:金属晶体由自由电子与阳离子构成,则在晶体中有阳离子,不一定有阴离子。 (4)原子晶体的熔点一定比金属晶体的高。(×) 错因:原子晶体的熔点可能比金属晶体的低,如钨的熔点比硅的熔点高。 (5)分子晶体的熔点一定比金属晶体的低。(×) 错因:金属晶体的熔点不一定比分子晶体的高,如金属汞在常温下为液体,硫为固体。 (6)碳有三种同素异形体:金刚石、石墨和C60,其熔点由高到低的顺序为:C60>金刚石>石墨。(×) 错因:石墨的熔点比金刚石高,C60为分子晶体,熔点最低,故熔点由高到低的顺序为:石墨>金刚石>C60。 题组训练 题组一 晶体类型的判断 1.NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2NF3+3NH4F。上述化学方程式中的5种物质没有涉及的晶体类型为( ) A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体 答案 C 解析 NH3、F2、NF3属于分子晶体,Cu属于金属晶体,NH4F属于离子晶体。 2.现有几组物质的熔点(℃)数据: A组 B组 C组 D组 金刚石:3550 Li:181 HF:-83 NaCl 硅晶体:1410 Na:98 HCl:-115 KCl 硼晶体:2300 K:64 HBr:-89 RbCl 二氧化硅:1723 Rb:39 HI:-51 MgO:2800 ℃ 据此回答下列问题: (1)由表格可知,A组熔点普遍偏高,据此回答: ①A组属于________晶体,其熔化时克服的粒子间的作用力是________。 ②二氧化硅的熔点高于硅,是由于__________________________________。 ③硼晶体的硬度与硅晶体相对比:________。 (2)B组晶体中存在的作用力是________,其共同的物理性质是________(填序号),可以用________理论解释。 ①有金属光泽 ②导电性 ③导热性 ④延展性 (3)C组中HF熔点反常是由于____________________。 (4)D组晶体可能具有的性质是________(填序号)。 ①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电 (5)D组晶体中NaCl、KCl、RbCl的熔点由高到低的顺序为________________,MgO晶体的熔点高于三者,其原因解释为______________________________ ___________________________________________________________________。 答案 (1)①原子 共价键 ②O的原子半径小于Si的原子半径,Si—O的键长小于Si—Si的键长,Si—O的键能大于Si—Si的键能 ③硼晶体大于硅晶体 (2)金属键 ①②③④ 电子气 (3)HF分子间能形成氢键 (4)②④ (5)NaCl>KCl>RbCl MgO晶体为离子晶体,离子晶体中离子所带电荷数越多,半径越小,晶格能越大,熔点越高 解析 (1)A组由非金属元素组成,熔点很高,属于原子晶体,熔化时需破坏共价键。由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔点高,硬度大。 (2)B组都是金属,存在金属键,具有金属晶体的性质,可以用电子气理论解释相关物理性质。 (3)C组卤化氢晶体属于分子晶体,HF熔点高是由于分子之间形成了氢键。 (4)D组是离子化合物,熔点高,具有离子晶体的性质。 (5)晶格能与离子电荷数和离子半径有关,电荷数越多,半径越小,晶格能越大,晶体熔点越高。 题组二 晶体熔点的比较 3.下面的排序不正确的是( ) A.熔点由高到低:Na>Mg>Al B.硬度由大到小:金刚石>碳化硅>晶体硅 C.晶体熔点由低到高:CF4查看更多
相关文章
- 当前文档收益归属上传用户