- 2021-07-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
西藏日喀则市 2016-2017 学年高一化学上学期期末考试试题
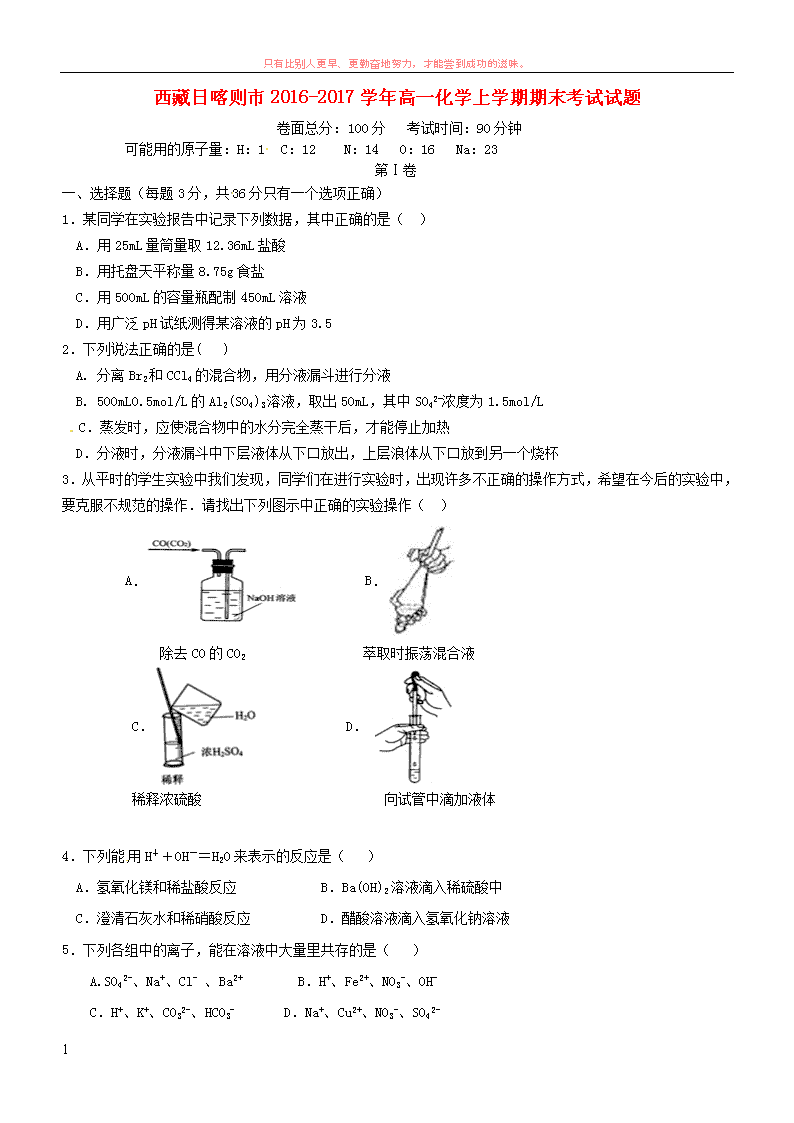
只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 1 西藏日喀则市 2016-2017 学年高一化学上学期期末考试试题 卷面总分:100 分 考试时间:90 分钟 可能用的原子量:H:1 C:12 N:14 O:16 Na:23 第Ⅰ卷 一、选择题(每题 3 分,共36 分只有一个选项正确) 1.某同学在实验报告中记录下列数据,其中正确的是( ) A.用 25mL 量筒量取 12.36mL 盐酸 B.用托盘天平称量 8.75g 食盐 C.用 500mL 的容量瓶配制 450mL 溶液 D.用广泛 pH 试纸测得某溶液的 pH 为 3.5 2.下列说法正确的是( ) A. 分离 Br2 和 CCl4 的混合物,用分液漏斗进行分液 B. 500mL0.5mol/L 的 Al2(SO4)3 溶液,取出 50mL,其中 SO4 2-浓度为 1.5mol/L C.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热 D.分液时,分液漏斗中下层液体从下口放出,上层浪体从下口放到另一个烧杯 3.从平时的学生实验中我们发现,同学们在进行实验时,出现许多不正确的操作方式,希望在今后的实验中, 要克服不规范的操作.请找出下列图示中正确的实验操作( ) A. B. 除去 CO 的 CO2 萃取时振荡混合液 C. D. 稀释浓硫酸 向试管中滴加液体 4.下列能用 H++OH-=H2O 来表示的反应是( ) A.氢氧化镁和稀盐酸反应 B.Ba(OH)2 溶液滴入稀硫酸中 C.澄清石灰水和稀硝酸反应 D.醋酸溶液滴入氢氧化钠溶液 5.下列各组中的离子,能在溶液中大量里共存的是( ) A.SO4 2-、Na+、Cl- 、Ba2+ B.H+、Fe2+、NO3 -、OH- C.H+、K+、CO3 2-、HCO3 - D.Na+、Cu2+、NO3 -、SO4 2- 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 2 6 .下列离子方程式正确的是 A.铁与浓盐酸反应:2Fe+6H+=2Fe3++3H2↑ B.铜片插入硝酸银溶液中:2Cu+Ag+=Ag+2Cu2+ C.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+= Ca2++2H2O D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O 7.关于 Fe(OH)3 胶体的说法正确的是( ) A.向 NaOH 溶液中.滴加饱和的 FeCl3 溶液,可制得 Fe(OH)3 胶体 B. FeCl3 溶液和 Fe(OH)3 胶体都能产生丁达尔效应 C.分散质的粒子.不能透过半透膜,也不能通过滤纸 D.逐滴加入稀硫酸,先产生沉淀后沉淀溶解 8.下列说法正确的是( ) A.固态 NaCl 不导电,所以 NaCl 是非电解质 B.NH3、Cl2 的水溶液均能导电,所以 NH3、Cl2 均是电解质 C.氯化氢水溶液能导电,所以氯化氢是电解质 D.BaSO4 难溶于水,所以 BaSO4 是非电解质 9、下列各反应中,水作为还原剂的是 A、2H2 +O2 2H2O B、SO3+ H2O===H2SO4 C、2F2+2H2O===4HF+O2 ↑ D、2Na+2H2O===2NaOH+H2 ↑ 10.工业上制取 ClO2:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是( ) A.SO2 在反应中作还原剂 B.NaClO3 在反应中被氧化 C.H2SO4 在反应中作氧化剂 D.1mol 氧化剂在反应中失去 1mol电子 11、下列反应不属于四种基本类型,但属于氧化还原反应的是( ) A.Fe+2HCl=H2↑+FeCl2 B.Fe2O3+3CO 2Fe +3CO2 C.2FeCl2+Cl2=2FeCl3 D.2Fe(OH)3 Fe2O3+3H2O 12.下列叙述正确的是( ) A.氧气的摩尔质量为 32g B.常温常压下,14 g 由 N2 与 CO 组成的混合气体含有的原子数目为 NA C.1 mol·L-1 NaCl 溶液中所含有的 Na+ 离子数目为 NA D.标准状况下,22.4L H2O 含有的分子数为 NA 第Ⅱ卷 13. (20 分)(1)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次) 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 3 从海水中提取水__________;从 KCl 溶液中获取 KCl 晶体___________ 分离 CaCO3 和水__________;分离植物油和水__________。 (2)有下列四种物质:A.碘酒 B.SO2 C.Cu D.HNO3 其中属于氧化物的是 (填序号,下同),属于混合物的是 ,属于电解质的是 . (3) Fe(OH)3 胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象 叫_________。 ⑵ 强光通过 Fe(OH)3 胶体,可看到光带,这种现象叫___________。 ⑶ 淀粉与食盐的混合液放在肠衣中,并把它悬挂在盛有蒸馏水的烧瓶里,从而使淀粉与食盐分离,这种方法 ________。 14. (12 分)按要求完成下列小题 (1)用澄清的石灰水检验 CO2 气体的离子方程式:_________________________________。 (2)硫酸铁在水中的电离方程式:________________________________________。 (3)醋酸和氨水反应的离子方程式:________________________________________。 (4)Cu2++Fe=Fe2++Cu 相应的化学方程式:___________________________________。 15.(10 分).某河道两旁有甲、乙两厂,它们排放的工业废水中,共含 K+ 、Ag+ 、Fe3+ 、Cl - 、OH - 、NO3 - 六种离子。 (1)甲厂的废水明显呈碱性,则甲厂废水中所含的三种离子是 。 (2)乙厂的废水中含有另外三种离子。如果加一定的(从活性炭、硫酸亚铁、铁粉中选一种试剂) , 可以回收金属 (填化学式)。 (3)另一种设想是将甲乙两厂的废水按适当的比例混合,可使废水中的 离子转化为沉淀,经过滤 后的废水主要含 有 ,可以用来浇灌农田。 16.(12 分)实验室中用二氧化锰和浓盐酸反应制取氯气的化学方程式为 MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O,请回答下列问题: (1)上述反应中 元素的化合价降低,被 (填“氧化”或“还原”). (2)若消耗 0.1molMnO2 则被氧化的还原剂的物质的量是 mol,反应过程中转移电子的物质的量为 mol. (3)上述反应中浓盐酸表现出的化学性质是 . 17.(10 分)配制 480mL 0.5mol•L﹣1 的 NaOH 溶液,试回答下列问题: (1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到 0.1g)、药匙、烧杯、玻璃棒、 、 等. (2)计算、称量:需称量 NaOH 固体的质量为 . 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 4 (3)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是 ,(填字母 序号) A、容量瓶洗净后未烘干; B、在溶解过程中有少量液体溅出烧杯外 C、定容时俯视刻度线; D、将称量好的 NaOH 固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 E、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线. 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 5 第一学期期末考试高一化学参考答案 1-5 CBBCD 6-10 DDCCA 11-12 BB 13.(20 分每空 2 分) (1)③ ② ① ④ (2):B;A;D; (3) 电泳 丁达尔效应 渗析 14. (12 分每空 3 分) (1)Ca2++2OH-+CO2=CaCO3↓+H2O (2)Fe2(SO4)3=2Fe3++3SO4 2- (3)CH3COOH+NH3·H2O=CH3COO-+NH4 ++H2O (4)CuSO4+Fe=FeSO4+Cu 15.(10 分,每空 2 分) (1)K+ 、Cl - 、OH – (2) 铁粉 ,Ag (3)Ag+ 、Fe3+ 、Cl - 、OH - ,KNO3 16. (12 分,每空 2 分计算 3 分) (1):Mn;还原;(2):0.2;0.2;(3):还原性、酸性. 17. (10 分,每空 2 分最后两空 3 分) (1)胶头滴管 500 mL 容量瓶; (2):10.0 g;(3):CD;查看更多