- 2021-07-06 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届(鲁科版)高考化学一轮复习金属材料学案
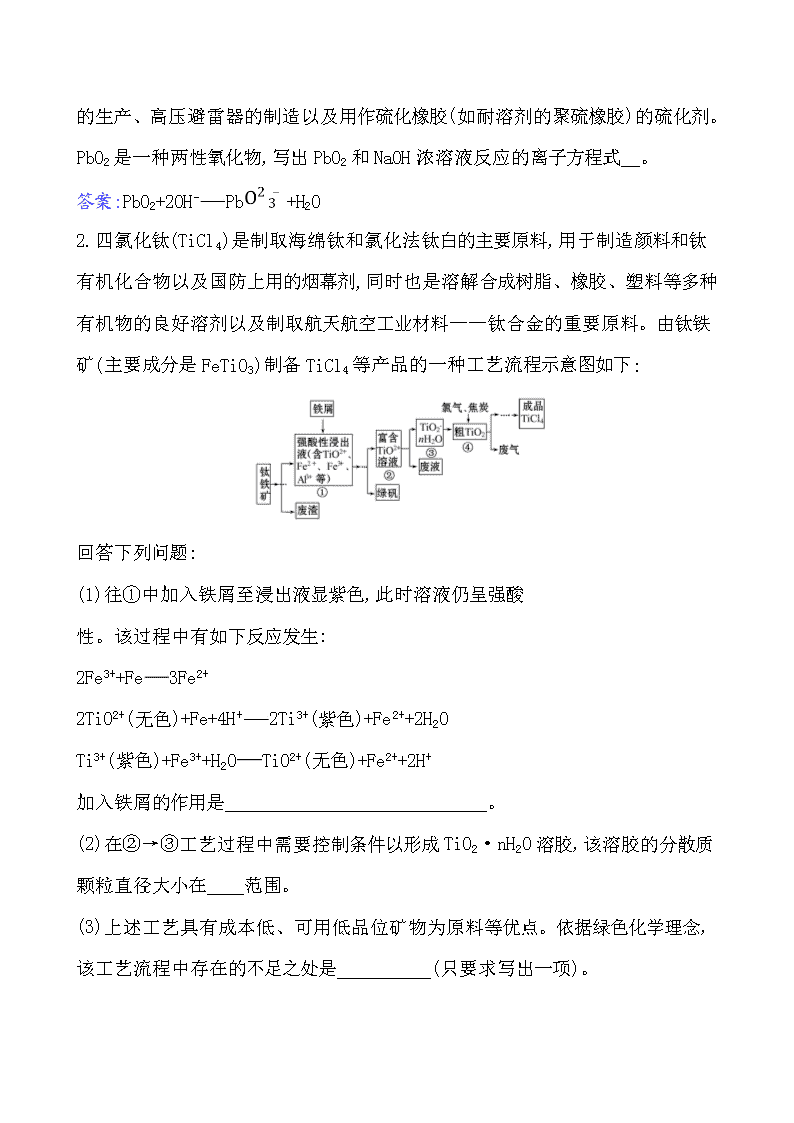
金属材料 武德合金是用50%铋(Bi)、25%铅(Pb)、12.5%锡(Sn)和12.5%镉(Cd)制成的。它的熔点是70 ℃,比所有标准条件下为固态的金属熔点都低。把武德合金制成的保险丝安装在电闸盒中,如果电路中发生短路或超载,电流过大,导线便会发热,当温度升高到70 ℃时,保险丝熔断,保护电器设备,防止火灾发生。为了纪念西班牙人武德,人们将这种特殊的合金命名为武德合金。钢中加入微量铋,可改善钢的加工性能,可锻铸铁加入微量铋,能使可锻铸铁具备类似不锈钢的性能。 问题1.铋的还原熔炼:原理是Bi2O3与还原剂煤粉在高温下发生反应,写出发生反应的化学方程式。(素养角度——宏观辨识与微观探析) 提示:2Bi2O3+3C4Bi+3CO2↑ 问题2.铋的置换熔炼:原理是Bi2S3加置换剂铁屑在高温下置换,写出发生反应的化学方程式。(素养角度——证据推理与模型认知) 提示:Bi2S3+3Fe2Bi+3FeS 问题3.含+4价的铅元素的化合物有强氧化性,PbO2的氧化性比Cl2的氧化性还强,在实验室中也可用PbO2和浓盐酸反应制取Cl2,发生反应的化学方程式为 。 (素养角度——证据推理与模型认知) 提示:PbO2+4HClPbCl2+ Cl2↑+2H2O 1.二氧化铅是一种棕黑色的结晶或粉末,不溶于水和醇,溶于乙酸和氢氧化钠,经过加热会分解。常用于染料、火柴、焰火及合成橡胶的制造和高氯酸钾(KClO4) 的生产、高压避雷器的制造以及用作硫化橡胶(如耐溶剂的聚硫橡胶)的硫化剂。PbO2是一种两性氧化物,写出PbO2和NaOH浓溶液反应的离子方程式 。 答案:PbO2+2OH-Pb+H2O 2.四氯化钛(TiCl4)是制取海绵钛和氯化法钛白的主要原料,用于制造颜料和钛有机化合物以及国防上用的烟幕剂,同时也是溶解合成树脂、橡胶、塑料等多种有机物的良好溶剂以及制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下: 回答下列问题: (1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸 性。该过程中有如下反应发生: 2Fe3++Fe3Fe2+ 2TiO2+(无色)+Fe+4H+2Ti3+(紫色)+Fe2++2H2O Ti3+(紫色)+Fe3++H2OTiO2+(无色)+Fe2++2H+ 加入铁屑的作用是 __________________________。 (2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。 (3)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。 (4)依据表格信息,要精制含少量SiCl4杂质的TiCl4,可采用 的方法。 TiCl4 SiCl4 熔点/℃ -25.0 -68.8 沸点/℃ 136.4 57.6 【解析】(1)从图中可以看出,对①进行处理的目的是得到富含TiO2+的溶液和绿矾(FeSO4·7H2O),所以加入铁粉的目的是将Fe3+还原为Fe2+,同时将部分TiO2+还原成Ti3+,以防止Fe2+被氧化成Fe3+。 (2)胶体的分散质微粒直径大小在1~ 100 nm之间。 (3)该反应产生废渣、废液和废气,不符合绿色化学的零排放要求。 (4)TiCl4和SiCl4的沸点相差较大,可以用蒸馏的方法将二者分离。 答案:(1)使Fe3+还原为Fe2+,生成Ti3+保护Fe2+不被氧化 (2)1~ 100 nm (3)产生三废 (4)蒸馏或精馏 关闭Word文档返回原板块查看更多