- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新疆博尔塔拉蒙古自治州第五师高级中学2020届高三上学期月考化学试题
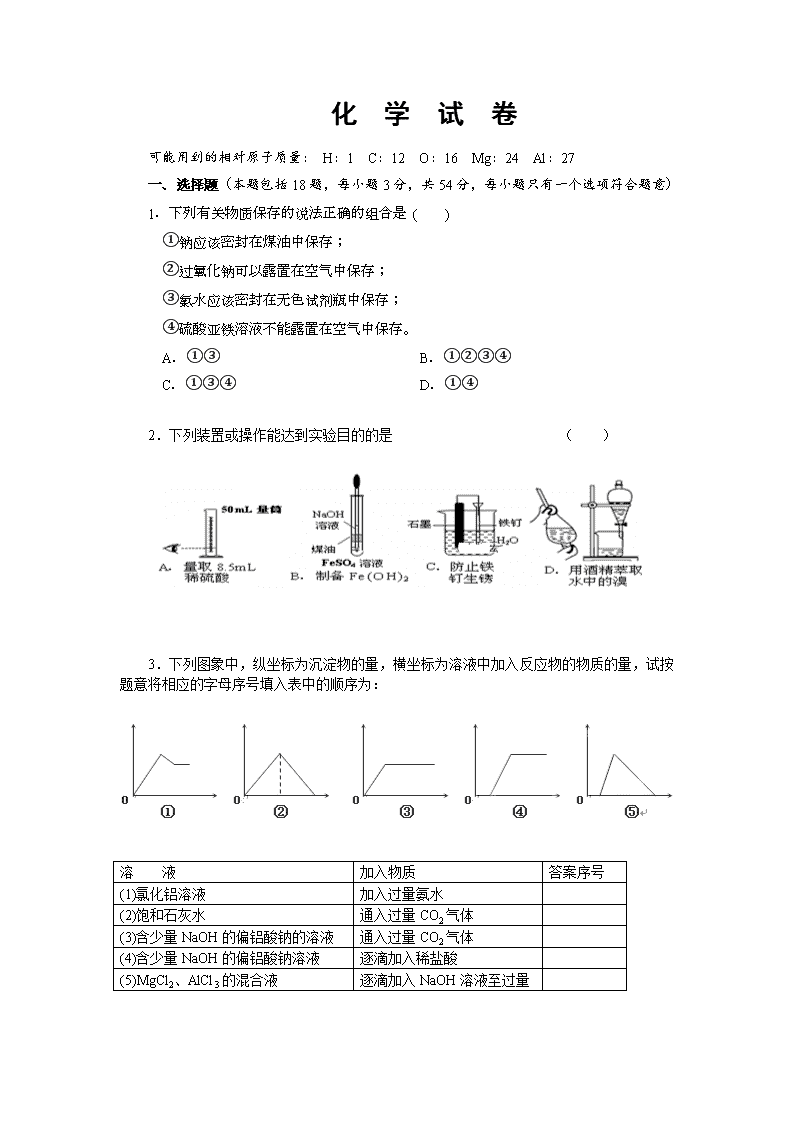
化 学 试 卷 可能用到的相对原子质量: H:1 C:12 O:16 Mg:24 Al:27 一、选择题(本题包括 18 题,每小题 3 分,共 54 分,每小题只有一个选项符合题意) 1.下列有关物质保存的说法正确的组合是 ( ) ①钠应该密封在煤油中保存; ②过氧化钠可以露置在空气中保存; ③氯水应该密封在无色试剂瓶中保存; ④硫酸亚铁溶液不能露置在空气中保存。 A.①③ B.①②③④ C.①③④ D.①④ 2.下列装置或操作能达到实验目的的是 ( ) 3.下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按 题意将相应的字母序号填入表中的顺序为: 溶 液 加入物质 答案序号 (1)氯化铝溶液 加入过量氨水 (2)饱和石灰水 通入过量 CO2 气体 (3)含少量 NaOH 的偏铝酸钠的溶液 通入过量 CO2 气体 (4)含少量 NaOH 的偏铝酸钠溶液 逐滴加入稀盐酸 (5)MgCl2、AlCl3 的混合液 逐滴加入 NaOH 溶液至过量 A.①③②④⑤ B. ③⑤④②① C. ①②③④⑤ D. ③②④⑤① 4.下列物质中,既能与盐酸反应又能与 NaOH 溶液反应的是 ( ) ①NaHCO3 ②Al2O3 ③Al(OH)3 ④(NH4)2CO3 ⑤NaHSO4 A.①②③ B.②③⑤ C.②③ D.①②③④ 5.下列解释相关问题或实验的离子方程式不正确的是 A.NaClO 溶液呈碱性:ClO—+H2O HClO+OH- B.向沸水中滴加饱和 FeCl3 溶液制胶体:Fe3++3 H2O = Fe(OH)3(胶体)+3 H+ C.粗盐提纯中除去 Mg2+:Mg2++2OH—=Mg(OH)2↓ D.工业上精炼粗铜的阴极反应:Cu—2e—=Cu2+ 6.下列说法不正确的是 A.铅蓄电池在放电过程中,正负极质量均增加 B.常温下,反应 C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> O C.25℃时,Mg(OH)2 固体在 20 mL 0.01 mol·L-1 氨水中的 Ksp 比在 20 mL 0.01 mol·L-1 NH4Cl 溶液中的 Ksp 小 D.将浓度为 0.1mol·L-1 的 HF 溶液加水不断稀释, 的值始终保持增大 7.在下列各溶液中通入足量 CO2 气体,最终有浑浊产生的是 ①饱和 Na2CO3 溶液 ②澄清石灰水 ③Ca(ClO)2 溶液 ④CaCl2 溶液 ⑤Na2SiO3 溶液 ⑥NaAlO2 溶液 A.全部 B.除①④外 C.除①②③外 D.①⑤⑥ 8.设 NA 为阿伏加德罗常数的值,下列叙述正确的是 A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA B.常温常压下,5.6g 乙烯和环丙烷的混合气体中含有的碳原子数为 0.3NA C.标准状况下,22.4 L CH4 与 22.4 LCl2 混合光照后所得气体中分子总数为 2 NA D.1 mol Na2O 和 Na2O2 混合物中含有的阴、阳离子总数是 3 NA 9.常温下,下列各组粒子在指定溶液中能大量共存的是 A.含大量 Fe3+的溶液中:NH4+、Mg2+、Cl-、HS- B.加入 Al 有 H2 生成的溶液中 Cu2+、NH4+、Cl-、NO3- C.使酚酞变红的溶液中:K+、Na+、AlO2-、CO32- D 小苏打溶液中:K+、Al3+、Cl-、SO42- 10.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过 实践的检验才能确定其正确与否。下列几种类推结论中,正确的是 ( ) A、由 2Cu + O2 == 2CuO 可推出同族的硫也有 Cu + S == CuS B、Fe3O4 可表示为 FeO·Fe2O3,则 Pb3O4 可表示为 PbO·Pb2O3 C、Mg 能在 CO2 中燃烧,所以 Na 也能在 CO2 中燃烧 D、CO2 与 Na2O2 反应只生成 Na2CO3 和 O2,故 SO2 与 Na2O2 反应只生成 Na2SO3 和 O2 11.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是 NaAl(OH)2CO3。关于该物质 的说法正确的是( ) A.该物质属于两性氢氧化物 B.该物质是 Al(OH)3 和 Na2CO3 的混合物 C.1 mol NaAl(OH)2CO3 最多可消耗 3 mol H+ D.该药剂不适合于胃溃疡患者服用 12.镁铝合金 5.1 g 溶于 300 mL 2 mol/L 的盐酸,在标准状况下放出气体的体积为 5.6 L。向 反应后的溶液中加入足量氨水,产生沉淀的质量为( ) A.5.1 g B.10.2 g C.13.6 g D.15.3 g 13.对于达到平衡的可逆反应:X + Y W + Z,其他条件不变时,增大压强,正、逆反 应速率(v)的变化如图所示。下列对 X、Y、W、Z 四种物质状态的描述正确的是 A.W、Z 均为气体,X、Y 中只有一种为气体 B.X、Y 均为气体,W、Z 中只能有一种为气体 C.X、Y 或 W、Z 中均只有一种为气体 D. X、Y、Z、W 均为气体 14.下列说法正确的是( ) A.某物质的溶液中由水电离出的 c(H+)=1×10-a mol/L,若 a>7 时,则该溶液的 pH 一定 为 14-a B.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、 ④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④ C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) D.AgCl 悬浊液中存在平衡: AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量 NaCl 粉 末,平衡会向左移动,溶液中离子的总浓度会减小 15.pH=2 的两种一元酸 x 和 y,体积均为 100 mL,稀释过程中 pH 与溶液体积的关系如下 图所示。分别滴加 NaOH 溶液(c=0.1 mol/L)至 pH=7,消耗 NaOH 溶液的体积为 V x、 Vy,则( ) A.x 为弱酸,Vx<Vy B.x 为强酸,Vx>Vy C.y 为弱酸,Vx<Vy D.y 为强酸,Vx>Vy 16.下列表达式正确的是 A.热化学反应方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ·mol -1 B.用碳电极电解 CuSO4 溶液离子反应方程式:2Cu2++2H2O 2Cu↓+O2↑+4H+ C.用电子式表示 H2O 中化学键形成过程:H2+O→H:O:H D.过量的 CO 2 通入 NaAlO2 溶液的化学方程式:2NaAlO 2+CO2+3H2O=Al(OH) 3↓+Na2CO3 17.下列说法正确的是( ) A.增大反应物浓度,可增大单位体积内活化分子的百分数,使有效碰撞次数增大 B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子 的百分数,从而使反应速率增大 C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分 数 D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,增大反应速率 18.在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断 不正确的是 A.在含 Ba(OH)2、KOH 的混合溶液中缓慢通入 CO2: Ba(OH)2、KOH、K2CO3、BaCO3 B.在含 NH4+、Al3+、H+的溶液中逐滴加入 KOH 溶液:H+、Al3+、NH4+、Al(OH)3 C.在含 AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- D.在含等物质的量的 Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ 二、填空题(本题包括 4 题,共 46 分) 19.(11 分)A---J 分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示 (部分反应物、生成物没有列出),且已知 G 为主族元素的固态氧化物,A、B、C、D、E、 F 六种物质中均含同一种元素。请填写下列空白: (1)A、B、C、D、E、F 六种物质中所含同一种元素 在周期表中位置 , (2)写出检验 D 溶液中阳离子的方法 。 (3)写出反应④的离子方程式 。 (4)若向气体 K 的水溶液中加入盐酸,使其恰好完全反应,所得溶液的 pH 7(1 分)(填“>”、“<”或“=”), 用离子方程式表示其原因: ; (5)若向气体 K 的 0.1mol/L 水溶液中加入 pH=1 的硫酸,且氨水与硫酸的体积比为 1:1,则所得溶液中各离子物质的量浓度由大到小的关系是 。 20.(16 分)A、B、C、D 均为中学化学中常见的物质,它们之间转化关系如下图(部分产 物已略去): 试回答: (1)若 D 是具有氧化性的单质,则属于主族的金属 A 为___________(1 分)(填元素符号) (2)若 D 是金属,C 溶液在储存时应加人少量金属 D,其理由是(用必要的文字和离子方程 式表示)_______________________. (3)若 A、B、C 为含同一种金属元素的无机化合物,且三种物质中有一种是白色不溶 物 . 在 溶 液 中 A 和 C 反 应 生 成 B 。 请 写 出 B 转 化 为 C 的 所 有 可 能 的 离 子 力 程 式 _______________________、______________________ (4)某一离子反应体系有反应物和产物共以下六种:MnO 4—、H+、O2、H2O、H 2O2、 Mn2+。 ①写出该氧化还原反应的离子方程式_______________________ ②溶液随着酸性的增强氧化性不断增强,应选择__________(1 分)(选填“稀硫酸”或“浓盐 酸”)进行 KMnO4 溶液的酸化。 ③如反应转移了 0.6mo1 电子,则产生的气体在标准状况下体积为__________ (5)一份溶液中可能含有 K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、 ClO-、AlO2- 等离子中的若干种。为了确定溶液的组成,进行了如下操作: 往该溶液中逐滴加入 NaOH 溶液并适当加热,产生沉淀和气体的物质的量(n)与加入 NaOH 溶液的体积关系如图所示;则该溶液中一定存在的离子是 ,一定不存 在的离子是 。 21.(12 分)甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。 (1)以下是工业上合成甲醇的两个反应: 反应 I: CO(g)+2H2(g) CH3OH(g) ΔH1 反应 II:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2 ① 上述反应符合“原子经济”原则的是 (1 分)(填“I”或“II”)。 ② 下表所列数据是反应 I 在不同温度下的化学平衡常数(K)。 温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012 由表中数据判断反应 I 为______________热反应(填“吸”或“放”) (1 分)。 ③ 某温度下,将 2 mol CO 和 6 mol H2 充入 2L 的密闭容器中,充分发生反应,达到平衡后, 测得 c(CO)= 0.2 mol/L,则 CO 的转化率为 ,此时的温度为 (从 表中选择)。 (2) 已知在常温常压下: ①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol ②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol ③H2O(g)=H2O(l) ΔH3 kJ/mol 则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol (3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有 Cr2O72‾)时,实验室利 用下图装置模拟该法: ① N 电极的电极反应式为 。 ② 请完成电解池中 Cr2O72‾转化为 Cr3+的离子反应方程式: Cr2O7 2‾+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ] H+ H+ 质子交换膜 M电极 N电极 b a 扩散层 扩散层 c d H2O Fe Fe 隔膜 含Cr2O7 废水2-含Cr2O7 废水 2- 22.( 7 分 )将 1.00mol•L -1 NaOH 溶 液 滴 入 20.00mL 1.00mol•L-1 的 一 元 酸 HA 溶 液 中 , 测 得 混 合 溶 液 的 pH 和 温 度 随 加 入 NaOH 溶 液 体 积 变 化 曲 线 如 图 1 所 示 . ( 1) 计 算 室 温 时 20.00mL 1.00mol•L -1 的 一 元 酸 HA 的 电 离 度 α= ( 2) 图 中 B 点 所 示 的 溶 液 中 所 含 各 离 子 浓 度 由 大 到 小 的 顺 序 是 ( 3) 下 列 说 法 正 确 的 是 ( 填 相 应 序 号 ). A. 由 图 中 可 知 NaOH 和 HA 反 应 的 △H> 0 B. 图 中 C 点 所 加 NaOH 溶 液 的 体 积 V=20.00Ml C . 图 中 C 点 时 溶 液 的 KW 略 大 于 1×10-14mol•L-1 , 溶 液 中 c ( H+ ) =1×10-7mol•L-1 D. 图 中 D 点 后 , 溶 液 温 度 略 下 降 的 主 要 原 因 是 生 成 的 NaA 水 解 吸 热 ( 4 ) 常 温 下 在 20mL 0.1mol•L-1 Na2CO3 溶 液 中 逐 滴 加 入 0.1mol•L-1 HCl 溶 液 40mL, 溶 液 中 含 碳 元 素 的 各 种 微 粒 ( CO 2 因 逸 出 未 画 出 )物 质 的 量 分 数 ( 纵 轴 ) 随 溶 液 pH 变 化 的 部 分 情 况 如 图 2 所 示 . 回 答 下 列 问 题 : ①在 同 一 溶 液 中 , H 2CO3、 HCO3-、 CO32- ( 填 “能 ”或 “不 能 ”) 大 量 共 存 ; ②当 pH=7 时 , 溶 液 中 含 碳 元 素 的 主 要 微 粒 为 , 溶 液 中 各 种 离 子 的 物 质 的 量 浓 度 的 大 小 关 系 为 ; ③已 知 在 25℃时 , CO 32-水 解 反 应 的 平 衡 常 数 即 水 解 常 数 Kh=2×10-4mol•L-1, 当 溶 液 中 c( HCO 3-) : c( CO 32-) =2: 1 时 , 溶 液 的 pH= . 化 学 试 卷 一、选择题(本题包括 18 题,每小题 3 分,共 54 分,每小题只有一个选项符合题意) 1 2 3 4 5 6 7 8 9 D B D D D C D D C 10 11 12 13 14 15 16 17 18 C D C B B C B C C 二、填空题(本题包括 4 题,共 46 分) 19.(11 分)(1)第四周期第Ⅷ族 (2)取少量 D 溶液,加 KSCN 溶液,出现红色 (3)2Al+2OH-+2H2O==2AlO2 -+3H2↑ (4)< NH4++ H2O NH3·H2O+OH- (5)c(NH4+)> c(SO42-)> c(H+)>c(OH-) 20.(16 分)(1)Na (2)2Fe3++ Fe==3Fe2+ (3)Al(OH)3+3H+==Al3++3H2O Al(OH)3+ OH-== AlO2 -+2H2O (4)2MnO4-+6H++5H2O2==2Mn2++5O2↑+8 H2O 稀硫酸 6.72 L (5)Al3+、H+、NH4+、Cl- Mg2+、Fe2+、HCO3-、ClO-、AlO2- 21.(12 分)(1)①Ⅰ ②放 ③80% 250℃ (2)1/2ΔH1-1/2ΔH2+ΔH3 (3)O2+4e-+4H+=2H2O Cr2O7 2‾+ 6 Fe2+ + 14 [ H+ ] ═ 2 Cr3++ 6 Fe3++ 7 [ H2O ] 22.( 7 分 )( 1) 0.1% ( 2) c(A-)> c(Na+)> c(H+)>c(OH-) (3)C (4)①不能 ②HCO3 -、H2CO3 c(Na+)> c(Cl-)> c(HCO3 -)> c(H+)=c(OH-) ③10查看更多