- 2021-07-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版晶体结构与性质作业(8)
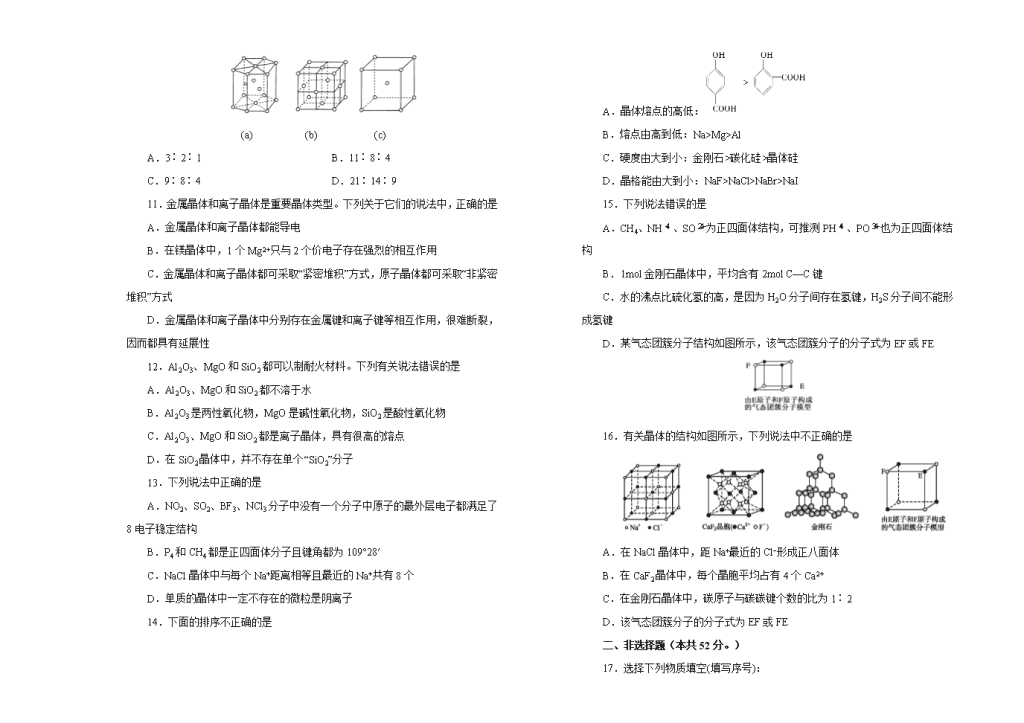
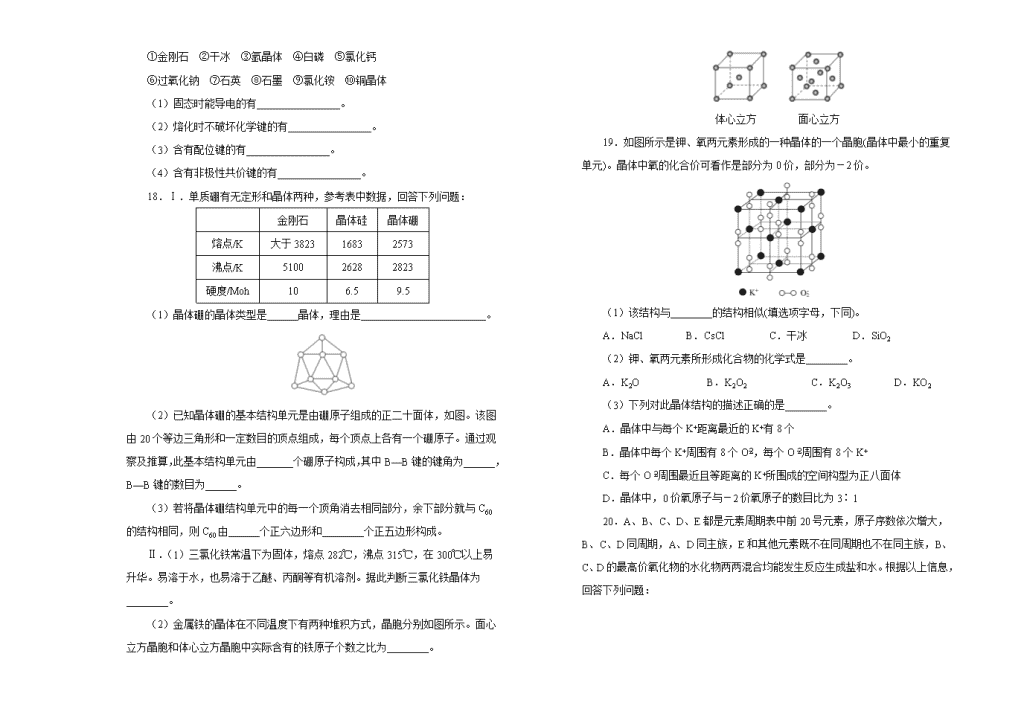
晶体结构与性质 一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。) 1.下列化学式既能表示物质的组成,又能表示物质的分子式的是 A.NH4NO3 B.SiO2 C.CCl4 D.Cu 2.海底有大量的天然气水合物,可满足人类1000年的能源需求。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4或1个游离水分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离水分子填充,则天然气水合物的平均组成可表示为 A.CH4·14H2O B.CH4·8H2O C.CH4·7H2O D.CH4·6H2O 3.在单质形成的晶体中,一定不存在的相互作用是 A.共价键 B.范德华力 C.金属键 D.氢键 4.下列说法正确的是 A.晶体在受热熔化过程中一定存在化学键的断裂 B.原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 C.区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 D.非金属元素的原子间只形成共价键,金属元素的原子非金属元素的原子间只形成离子键 5.下列物质性质的变化规律与分子间作用力有关的是 A.HF、HCl、HBr、HI的热稳定性依次减弱 B.金刚石的硬度大于硅,其熔、沸点也高于硅 C.NaF、NaCl、NaBr、NaI的熔点依次降低 D.F2、Cl2、Br2、I2的沸点依次升高 6.氯化硼的熔点为10.7℃,沸点为12.5℃。在氯化硼分子中,氯—硼—氯键角为120°,它可以水解,水解产物之一是氯化氢。下列对氯化硼的叙述中正确的是 A.氯化硼是原子晶体 B.熔化时,氯化硼能导电 C.氯化硼分子是一种极性分子 D.水解方程式:BCl3+3H2OH3BO3+3HCl 7.常温下硫单质主要以S8形式存在,加热时S8会转化为S6、S4、S2等,当蒸气温度达到750℃时主要以S2形式存在,下列说法正确的是 A.S8转化为S6、S4、S2属于物理变化 B.常温条件下单质硫为原子晶体 C.不论哪种硫分子,完全燃烧时都生成SO2 D.把硫单质在空气中加热到750℃即得S2 8.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是 A.该晶体类型是原子晶体 B.该晶体中碳原子和氧原子的个数比为1∶2 C.晶体中碳原子数与C—O化学键数之比为1∶2 D.晶体的空间最小环共由12个原子构成 9.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 A.S和Si B.CCl4和KCl C.NaCl和HCl D.CO2和H2O 10.金属晶体中金属原子有三种常见的堆积方式,六方堆积、面心立方堆积和体心立方堆积,如图(a)(b)(c)分别代表这三种晶胞的结构,其晶胞内金属原子个数比为 (a) (b) (c) A.3∶2∶1 B.11∶8∶4 C.9∶8∶4 D.21∶14∶9 11.金属晶体和离子晶体是重要晶体类型。下列关于它们的说法中,正确的是 A.金属晶体和离子晶体都能导电 B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用 C.金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 D.金属晶体和离子晶体中分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性 12.Al2O3、MgO和SiO2都可以制耐火材料。下列有关说法错误的是 A.Al2O3、MgO和SiO2都不溶于水 B.Al2O3是两性氧化物,MgO是碱性氧化物,SiO2是酸性氧化物 C.Al2O3、MgO和SiO2都是离子晶体,具有很高的熔点 D.在SiO2晶体中,并不存在单个“SiO2”分子 13.下列说法中正确的是 A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 B.P4和CH4都是正四面体分子且键角都为109°28′ C.NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 D.单质的晶体中一定不存在的微粒是阴离子 14.下面的排序不正确的是 A.晶体熔点的高低: B.熔点由高到低:Na>Mg>Al C.硬度由大到小:金刚石>碳化硅>晶体硅 D.晶格能由大到小:NaF>NaCl>NaBr>NaI 15.下列说法错误的是 A.CH4、NH、SO为正四面体结构,可推测PH、PO也为正四面体结构 B.1mol金刚石晶体中,平均含有2mol C—C键 C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE 16.有关晶体的结构如图所示,下列说法中不正确的是 A.在NaCl晶体中,距Na+最近的Cl−形成正八面体 B.在CaF2晶体中,每个晶胞平均占有4个Ca2+ C.在金刚石晶体中,碳原子与碳碳键个数的比为1∶2 D.该气态团簇分子的分子式为EF或FE 二、非选择题(本共52分。) 17.选择下列物质填空(填写序号): ①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠 ⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体 (1)固态时能导电的有________________。 (2)熔化时不破坏化学键的有________________。 (3)含有配位键的有________________。 (4)含有非极性共价键的有________________。 18.Ⅰ.单质硼有无定形和晶体两种,参考表中数据,回答下列问题: 金刚石 晶体硅 晶体硼 熔点/K 大于3823 1683 2573 沸点/K 5100 2628 2823 硬度/Moh 10 6.5 9.5 (1)晶体硼的晶体类型是______晶体,理由是________________________。 (2)已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图。该图由20个等边三角形和一定数目的顶点组成,每个顶点上各有一个硼原子。通过观察及推算,此基本结构单元由_______个硼原子构成,其中B—B键的键角为______,B—B键的数目为______。 (3)若将晶体硼结构单元中的每一个顶角消去相同部分,余下部分就与C60的结构相同,则C60由______个正六边形和________个正五边形构成。 Ⅱ.(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。 (2)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________。 体心立方 面心立方 19.如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)。晶体中氧的化合价可看作是部分为0价,部分为-2价。 (1)该结构与________的结构相似(填选项字母,下同)。 A.NaCl B.CsCl C.干冰 D.SiO2 (2)钾、氧两元素所形成化合物的化学式是________。 A.K2O B.K2O2 C.K2O3 D.KO2 (3)下列对此晶体结构的描述正确的是________。 A.晶体中与每个K+距离最近的K+有8个 B.晶体中每个K+周围有8个O,每个O周围有8个K+ C.每个O周围最近且等距离的K+所围成的空间构型为正八面体 D.晶体中,0价氧原子与-2价氧原子的数目比为3∶1 20.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题: (1)A和D的氢化物中,沸点较低的是________(填“A”或“D”);A和B的离子中,半径较小的是________(填离子符号)。 (2)C在元素周期表中的位置是________。 (3)A和E可形成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“•”表示)位于该正方体的顶点或面心,阴离子(用“”表示)均位于小正方体的中心。该化合物的电子式是________。 21.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题: (1)Ni原子的核外电子排布式为 ; (2)NiO、FeO、MgO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: ; (3)NiO晶胞中Ni和O的配位数分别为 、 ; (4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如上图所示。该合金的化学式为 。 答案解析 1. 【解析】在四种类型的晶体中,除分子晶体中含有单独存在的分子外,其余的晶体中都不存在单个的分子,化学式仅代表物质中原子的最简组成,而不能表示其真正的分子。 【答案】C 2. 【解析】由题知,8个笼共有48个水分子,6个甲烷分子,故选B。 【答案】B 3. 【解析】氢键一定存在于化合物中,即电负性较强的N、O、F与H形成的化合物中。 【答案】D 4. 【解析】A中,分子晶体受热熔化时是破坏分子间作用力;B中,大部分分子晶体中都存在共价键(稀有气体的晶体例外);D中,非金属元素原子间也可形成离子键(如NH4Cl),金属元素原子与非金属元素原子间也可形成共价键(如AlCl3)。 【答案】C 5. 【解析】A中,卤化氢的热稳定性与分子内H—X键键能大小有关;B中,因键长金刚石小于硅,故键能金刚石大,故熔沸点高;C中,离子晶体的熔沸点与离子键键能有关。 【答案】D 6. 【解析】首先根据性质推导该晶体是分子晶体还是原子晶体,再根据具体晶体的性质判断选项。因为BCl3的熔沸点较低,故应为分子晶体,分子晶体熔化时不导电,故A、B错;又因氯—硼—氯键角为120°,则可确定BCl3为非极性分子,C错。 【答案】D 7. 【解析】S8、S6、S4、S2属于不同的分子,它们间的转化为化学变化;常温条件下单质硫为分子晶体;硫单质在空气中加热到750℃时被氧化,生成硫的氧化物,得不到S2。 【答案】C 8. 【解析】根据题目中提供的信息,该晶体为原子晶体,其结构应类似于二氧化硅晶体,所以,晶体中碳原子数与C—O化学键数之比为1∶4,故C项错误。 【答案】C 9. 【解析】A中,S中含非极性共价键,是分子晶体;Si中含非极性共价键,是原子晶体。B中,分别含极性共价键、离子键,分别为分子晶体、离子晶体。C中,前者含离子键的离子晶体,后者含极性共价键的分子晶体。 【答案】D 10. 【解析】用均摊法计算。晶胞a中所含原子=12×+2×+3=6,晶胞b中所含原子=8×+6×=4,晶胞c中所含原子=8×+1=2。 【答案】A 11. 【解析】金属晶体中的离子不是自由移动的离子,不能导电,A项不正确;镁晶体中的自由电子被整个晶体所共有,不属于某个Mg2+,B项不正确;离子晶体不具有延展性,D项错误。 【答案】C 12. 【解析】从无机化学知识可知:Al2O3、MgO和SiO2分别属于两性氧化物、碱性氧化物和酸性氧化物,三者均不溶于水。Al2O3和MgO属于离子晶体,SiO2属于原子晶体,故D正确,C错误。 【答案】C 13. 【解析】A中,NCl3分子的电子式为,最外层电子都满足8电子稳定结构;B中,P4分子中P—P键键角为60°;C中,NaCl晶体中每个Na+等距最近的Na+有12个。 【答案】D 14. 【解析】A中,由于 可以形成分子内氢键,使得晶体熔点降低。B中,Na、Mg、Al均为金属晶体,金属键Na查看更多