- 2021-07-06 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省南昌市八一中学、洪都中学等七校2018-2019学年高二上学期期末考试化学试题
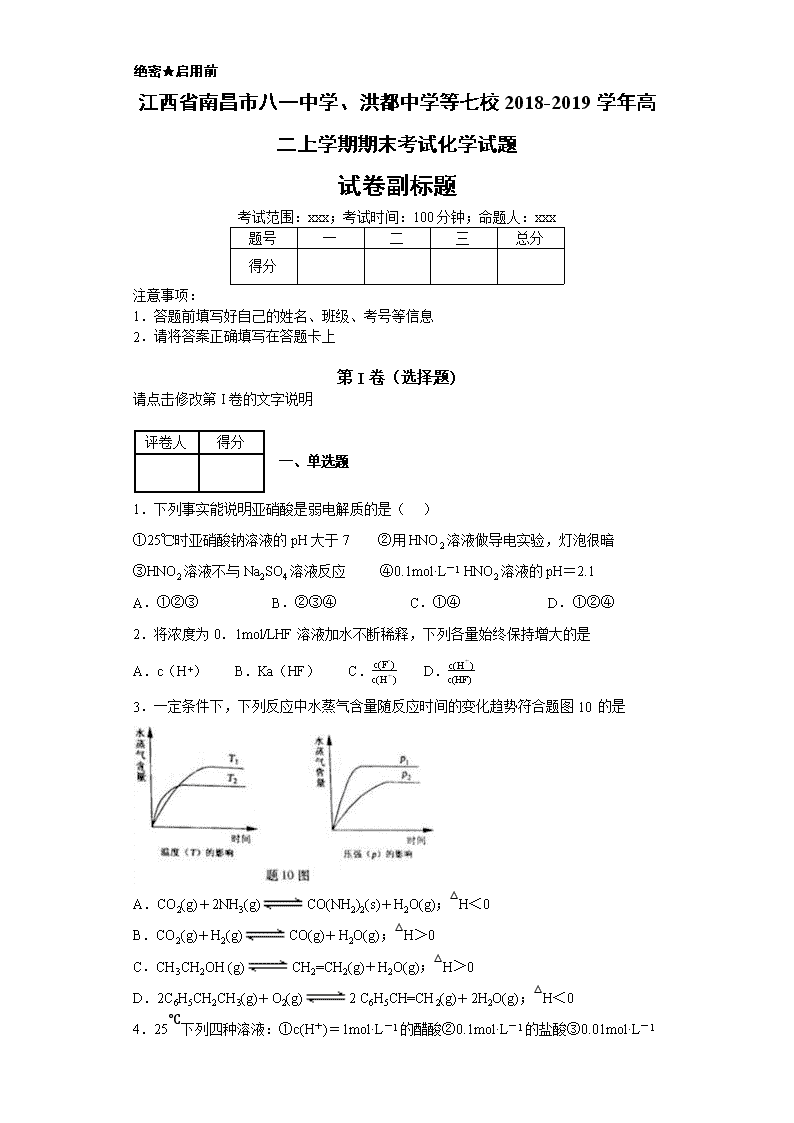
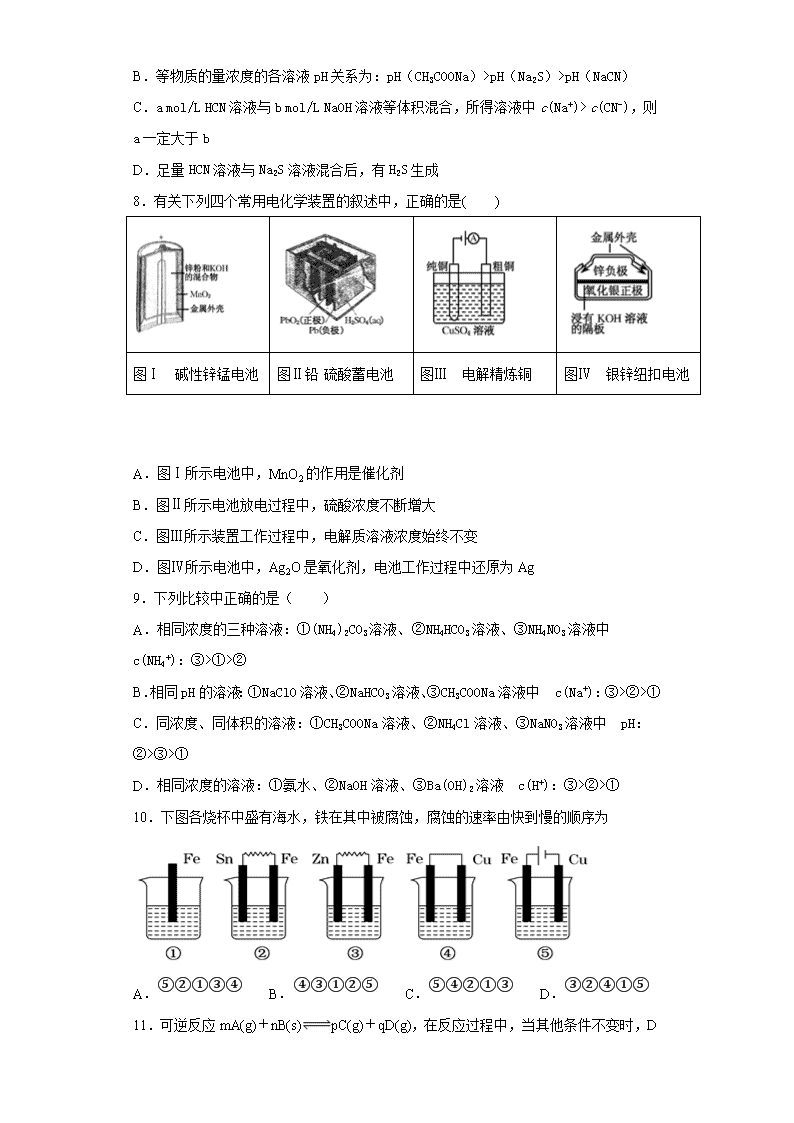
绝密★启用前 江西省南昌市八一中学、洪都中学等七校2018-2019学年高二上学期期末考试化学试题 试卷副标题 考试范围:xxx;考试时间:100分钟;命题人:xxx 题号 一 二 三 总分 得分 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 第I卷(选择题) 请点击修改第I卷的文字说明 评卷人 得分 一、单选题 1.下列事实能说明亚硝酸是弱电解质的是( ) ①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1 HNO2溶液的pH=2.1 A.①②③ B.②③④ C.①④ D.①②④ 2.将浓度为0.1mol/LHF溶液加水不断稀释,下列各量始终保持增大的是 A.c(H+) B.Ka(HF) C.c(F-)c(H+) D.c(H+)c(HF) 3.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是 A.CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g);△H<0 B.CO2(g)+H2(g)CO(g)+H2O(g);△H>0 C.CH3CH2OH (g)CH2=CH2(g)+H2O(g);△H>0 D.2C6H5CH2CH3(g)+O2(g)2 C6H5CH=CH2(g)+2H2O(g);△H<0 4.25℃下列四种溶液:①c(H+)=1mol·L-1的醋酸②0.1mol·L-1的盐酸③0.01mol·L-1 的NaOH溶液 ④c(OH-)=10-3mol·L-1氨水溶液。由水电离出的氢离子浓度之比为 A.1∶10∶100∶1000 B.0∶1∶12∶11 C.14∶13∶12∶11 D.14∶13∶2∶3 5.室温下,某无色透明溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26,一定能大量共存的离子组是( ) A.Cl—、HCO3—、Na+、K+ B.Fe3+、NO3—、K+、H+ C.NO3—、Ba2+、K+、Cl— D.Al3+、SO42—、NH4+、Cl— 6.下列实验不能达到预期实验目的是( ) 序号 实验内容 实验目的 A 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱 B 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 说明一种沉淀能转化为另一种溶解度更小的沉淀 C 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 除去MgCl2中少量FeCl3 D 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响 A.A B.B C.C D.D 7.25℃时,几种弱酸的电离常数如下: 弱酸化学式 CH3COOH HCN H2S 电离常数(25℃) 1.8×10-5 4.9×10-10 K1= 1.3×10-7 K2= 7.1×10-15 25℃时,下列说法正确的是 A.NaHS和Na2S混合溶液中,一定存在c(Na+)+ c(H+)== c(OH-)+ c(HS-)+2c(S2-) B.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) C.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)> c(CN-),则a一定大于b D.足量HCN溶液与Na2S溶液混合后,有H2S生成 8.有关下列四个常用电化学装置的叙述中,正确的是( ) 图Ⅰ 碱性锌锰电池 图Ⅱ铅硫酸蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池 A.图Ⅰ所示电池中,MnO2的作用是催化剂 B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大 C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变 D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag 9.下列比较中正确的是( ) A.相同浓度的三种溶液:①(NH4)2CO3溶液、②NH4HCO3溶液、③NH4NO3溶液中 c(NH4+):③>①>② B.相同pH的溶液:①NaClO溶液、②NaHCO3溶液、③CH3COONa溶液中 c(Na+):③>②>① C.同浓度、同体积的溶液:①CH3COONa溶液、②NH4Cl溶液、③NaNO3溶液中 pH:②>③>① D.相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液 c(H+):③>②>① 10.下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为 A.⑤②①③④ B.④③①②⑤ C.⑤④②①③ D.③②④①⑤ 11.可逆反应mA(g)+nB(s)pC(g)+qD(g),在反应过程中,当其他条件不变时,D 的百分含量与温度(T)和压强(P)的关系如图所示,判断下列叙述中不正确的是: A.达到平衡后,升高温度,平衡向逆反应方向移动 B.达到平衡后,若使用催化剂,D的物质的量分数不变 C.化学方程式中一定有m<p+q D.平衡后增大B的量,有利于平衡向正反应方向移动 12.下列说法中,与盐类水解有关的是( ) ①明矾可以做净水剂; ②实验室配制FeCl3溶液时,将FeCl3溶于少量的浓盐酸再加水稀释; ③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂; ④在NH4Cl溶液中加入金属镁会产生氢气; ⑤草木灰与铵态氮肥不能混合施用; ⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性. A.①④⑥ B.②③⑤ C.③④⑤ D.①②③④⑤⑥ 13.已知A(g)+C(g)===D(g);ΔH=-Q1kJ/mol,B(g)+C(g)===E(g);ΔH=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2,若A与B组成的混合气体 1mol与足量的C反应,放热为Q3kJ,则原混合气体中A与B物质的量之比为( ) A. Q3-Q2Q1-Q3 B. Q1-Q3Q3-Q2 C. Q3-Q2Q1-Q2 D. Q1-Q3Q1-Q2 14.用石墨作电极电解AlCl3溶液时,如下图所示的电解变化曲线合理的是 A.①④ B.②④ C.①③ D.②③ 15.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是 A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O B.充电过程是化学能转化为电能的过程 C.放电时负极附近溶液的碱性不变 D.放电时电解质溶液中的OH-向正极移动 16.常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是 A.点①和点②所示溶液中:c(CH3COO-)<c(CN-) B.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) C.点④所示溶液液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) 第II卷(非选择题) 请点击修改第II卷的文字说明 评卷人 得分 二、综合题 17.弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。 (1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。 (2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则PH=13的MOH溶液的浓度_______0.1mol/L(填<、>或=)。 (3)0.1mol/L的NaHA溶液,测得溶液显碱性。则 ① 该溶液中 c(H2A)_______________c(A2-)(填<、>或=)。 ② 作出上述判断的依据是_____________(用文字解释)。 (4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理: 绿矾为FeSO4• 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=_______。{Ksp[Cr(OH)3]=6.0×10-31} 18.某课外活动小组用如图装置进行实验,试回答下列问题: (1)若开始时开关K与a连接,则A极的电极反应式为____________________B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”) (2)若开始时开关K与b连接,下列说法正确的是________(填序号) ①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子 且此时装置内总反应的离子方程式为_____________________________________________________ (3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。 ①该电解槽的阳极反应式为_________________________________________,此时通过阴离子交换膜的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。 ②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。 用惰性电极电解体积为1L的CuSO4溶液,当阴阳极都产生3.36L(标况)气体时,请问硫酸铜的浓度为______,若要此溶液恢复到原状态需要加入________(填选项) A.CuSO4 B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3 19.已知25℃时草酸(H2C2O4)的电离常数为K1=5.0×10-2,K2=5.4×10-5,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。不同温度下水的离子积常数见下表: t/℃ 0 10 20 25 40 50 90 100 Kw/10-14 0.134 0.292 0.681 1.00 2.92 5.57 38.0 55.0 (1)常温下将0.2 mol/L的KOH溶液20 mL与0.2 mol/L的草酸溶液20 mL混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为__________________________________; (2)已知草酸能使酸性高锰酸钾溶液(稀硫酸酸化)褪色,若在锥形瓶中放入20.00mL未知浓度的草酸,用0.1mol/L高锰酸钾溶液滴定,当到达滴定终点时,若共消耗VmL高锰酸钾溶液,则草酸的物质的量浓度为__________mol/L。 (3)90℃时,将0.005 mol/L的氢氧化钙溶液20 mL与0.0012 mol/L的草酸溶液20 mL混合,混合后溶液的pH=___________; (4)25℃时若向20 mL草酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的碳酸钾溶液10 mL,能否产生沉淀,___________(填“能”或“否”)。 20.滴定实验是化学学科中重要的定量实验。 请回答下列问题: (1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH 溶液,下列操作造成测定结果偏高的是________ (填选项字母) A.滴定终点读数时,俯视滴定管刻度,其他操作正确。 B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗 D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失 (2)氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据: 滴定次数 待测液体积 (mL) 标准KMnO4溶液体积(mL) 滴定前读数 滴定后读数 第一次 25.00 0.50 20.40 第二次 25.00 3.00 23.00 第三次 25.00 4.00 24.10 ①滴定时发生的离子反应方程式___________,KMnO4溶液应装在______________ (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________________。 ②该草酸溶液的物质的量浓度为_____________。 (3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。 难溶物 AgCl AgBr AgCN Ag2CrO4 AgSCN 颜色 白 浅黄 白 砖红 白 Ksp 1.77×10-10 5.35×10-13 1.21×10-16 1.12×10-12 1.0×10-12 A.NaCl B.NaBr C.NaCN D.Na2CrO4 评卷人 得分 三、填空题 21.已知某气体反应的平衡常数可表示为K=c(CH3OCH3)•c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题: (1)写出上述反应的化学方程式: _____________________________________________。 (2)该反应的△H__________0。 (3)已知在密闭容器中,测得某时刻各组分的浓度如下: 物质 CH3OH(g) CH3OCH3(g) H2O(g) 浓度/(mol•L-1) 0.54 0.68 0.68 ①此时温度400℃,则某时刻υ正_______(填<、>或=,下同)υ逆。 ②如上图,若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中________点,比较图中B、D两点所对应的正反应速率υB_________υD,理由是____________________________________________________。 (4)一定条件下要提高反应物的转化率,可以采用的措施是_______。 a.升高温度 b.加入催化剂 c.压缩容器的体积 d.增加水蒸气的浓度 e.及时分离出产物 参考答案 1.C 2.D 3.A 4.A 5.C 6.A 7.A 8.D 9.B 10.C 11.D 12.D 13.A 14.A 15.A 16.B 17.Al3++3H2OAl(OH)3+3H+ > > NaHA溶液显碱性,说明HA-水解程度大于电离程度 1:6 6 18.O2+2H2O+4e-===4OH- 吸氧 ②④ 2Cl-+2H2O2OH-+H2↑+Cl2↑ 4OH--4e-===2H2O+O2↑(或4H2O-4e-=== O2↑+4H+) 小于 D 0.15mol/L C 19.c(K+)> c (HC2O4—)> c (H+)> c (C2O42—)> c (OH—) V/80 10 能 20.C,D 5H2C2O4 + 2MnO4- + 6H+= 10CO2↑ + 2Mn2+ + 8H2O 酸 锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色 0.2 mol·L-1 D 21.2CH3OHCH3OCH3+H2O > > A < 温度升高,化学反应速率加快 ae 查看更多