2019届高考化学二轮复习专题九溶液中的离子反应备考备查清单学案
备考备查清单
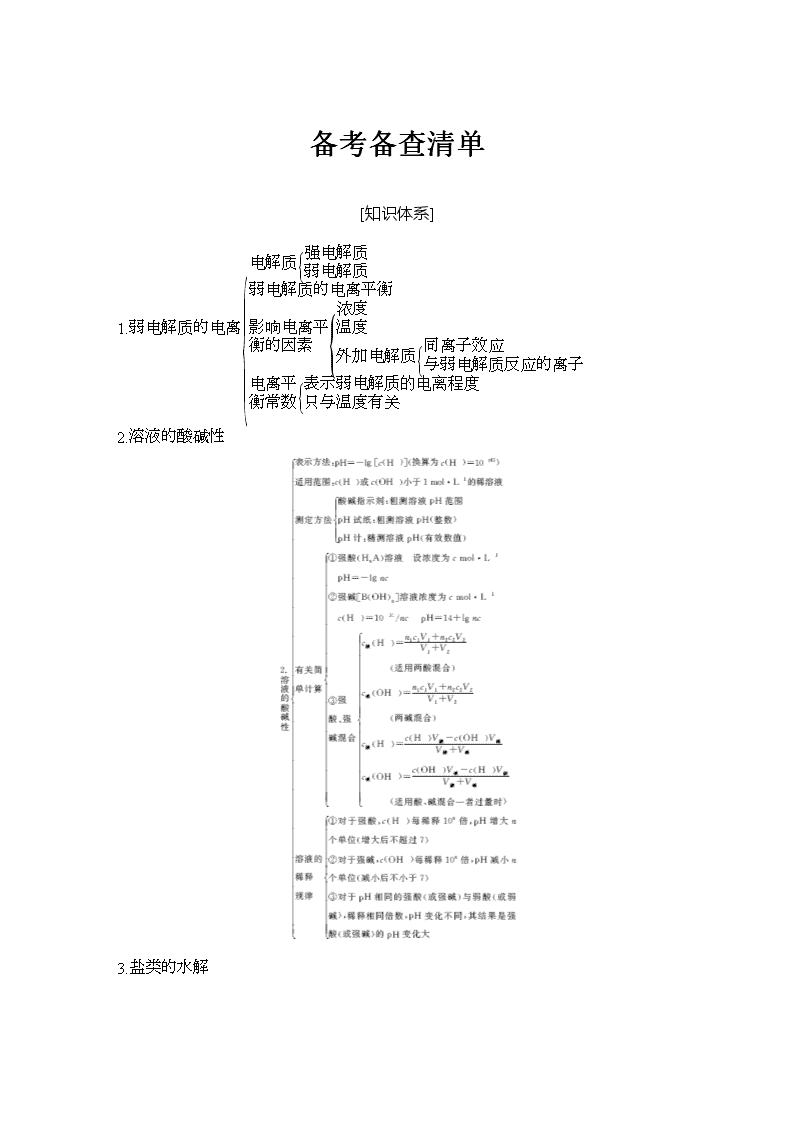
[知识体系]
[规律方法]
1.有关Kw的两点理解
(1)Kw不仅适用于纯水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有c(H+)=c(OH-)
如酸性溶液中:[c(H+)酸+c(H+)]·c(OH-)=Kw
碱性溶液中:[c(OH-)碱+c(OH-)]·c(H+)=Kw
(2)水的离子积常数表示在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
2.常温下水电离产生c(H+)和c(OH-)计算的4种类型
(1)中性溶液:c(OH-)=c(H+)=10-7 mol·L-1。
(2)溶质为酸的溶液
OH-全部来自水的电离,水电离产生的c(H+)=c(OH-)。
(3)溶质为碱的溶液
H+全部来自水的电离,水电离产生的c(OH-)=c(H+)。
(4)水解呈酸性或碱性的盐溶液
①pH=5的NH4Cl溶液中H+全部来自水的电离,由水电离的c(H+)=10-5 mol·L-1,c(OH-)=10-9 mol·L-1,是因为部分OH-与部分NH结合;
②pH=12的Na2CO3溶液中OH-全部来自水的电离,由水电离出的c(OH-)=10-2 mol·L-1。
3.求溶液pH的方法
可总结口诀如下:酸按酸(H+),碱按碱(OH-);同强相混弱0.3;异强相混看过量;无限稀释“7”为限。
4.混合溶液酸碱性的判断规律
(1)等浓度等体积一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”
中和反应
反应后所得溶液的酸碱性
强酸与强碱
中性
强酸与弱碱
酸性
弱酸与强碱
碱性
(2)室温下,已知酸和碱pH之和的溶液等体积混合
①两强混合
a.若pH之和等于14,则混合后溶液显中性,pH=7。
b.若pH之和大于14,则混合后溶液显碱性,pH>7。
c.若pH之和小于14,则混合后溶液显酸性,pH<7。
②一强一弱混合——“谁弱显谁性”
pH之和等于14时,一元强酸和一元弱碱等体积混合呈碱性;一元弱酸和一元强碱等体积混合呈酸性。
5.判断强、弱电解质的方法
(1)6个实验:
“三个对比”实验:
①等浓度强酸、弱酸的导电性实验。
②测定等浓度强酸、弱酸与活泼金属反应速率的快慢。
③测定等体积、等pH强酸、弱酸与活泼金属生成H2量的多少。
“三个独立”实验:
①含酚酞的NaA溶液的水解平衡移动实验。
②测定NaA溶液的pH的实验。
③一定pH的HA溶液稀释一定倍数后pH的变化实验。
(2)2种典型方法。
①测钠盐NaA溶液的pH,若pH>7,则说明HA为弱酸。
②测一定物质的量浓度的HA溶液的pH,如0.01 mol·L-1HA溶液的pH>2,则说明HA为弱酸。
6.水解平衡常数Kh与Kw、Ka、Kb之间的关系
(1)一元弱酸一元强碱盐,Kh=Kw/Ka;
(2)一元强酸一元弱碱盐,Kh=Kw/Kb;
(3)一元弱酸一元弱碱盐,如醋酸铵:Kh=Kw/(Ka×Kb)
7.熟记下列因水解相互促进不能大量共存的离子组合
(1)Al3+与HCO、CO、AlO、SiO、HS-、S2-、ClO-。
(2)Fe3+与HCO、CO、AlO、SiO、ClO-。
(3)NH与SiO、AlO。
(4)NH与CH3COO-、HCO虽能发生水解相互促进的反应,但能大量共存。
8.解答离子浓度比较题目的流程:
9.指示剂选择的基本原则
变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。
(1)不能用石蕊作指示剂。
(2)滴定终点为碱性时,用酚酞作指示剂,例如用NaOH溶液滴定醋酸。
(3)滴定终点为酸性时,用甲基橙作指示剂,例如用盐酸滴定氨水。
(4)强酸滴定强碱一般用甲基橙,但用酚酞也可以。
(5)并不是所有的滴定都须使用指示剂,如用标准的Na2SO3溶液滴定KMnO4溶液时,KMnO4颜色褪去时即为滴定终点。
一、选择题
1.(2017·温州十校)NH3溶于水,在氨的水溶液中存在这样的平衡关系:NH3+H2ONH3·H2ONH+OH-,下列有关500 mL 0.2 mol·L-1氨水的叙述,正确的是( )
A.含有0.1 mol NH3·H2O分子
B.溶液中NH3的物质的量浓度为0.2 mol·L-1
C.NH3和NH3·H2O的物质的量之和为0.2 mol·L-1
D.NH3、NH3·H2O和NH的物质的量总和为0.1 mol
解析 氨水中存在:NH3+H2ONH3·H2ONH+OH-
,溶液中存在NH3、NH3·H2O、NH,则NH3、NH3·H2O、NH之和为:500 mL×10-3L/mL×0.2 mol·L-1=0.1 mol,故选D。
答案 D
2.(2018·浙江暨阳联谊)下列说法不正确的是( )
A.1 L浓度为0.1 mol/L的NH4Cl溶液阳离子数目多于氯离子数目
B.比较浓度均为0.1 mol·L-1的HI和醋酸溶液的导电能力可判断HI为强酸
C.常温下,pH=3的醋酸溶液加水稀释1 000倍后溶液的pH<6
D.常温下,同体积的pH=9的NaClO溶液和pH=5的NH4Cl溶液水电离的OH-数相同
解析 A.铵根离子水解生成NH3·H2O和氢离子,溶液显酸性,c(H+)>c(OH-),根据电荷守恒,c(H+)+c(NH)=c(OH-)+c(Cl-),因此c(H+)+c(NH)>c(Cl-),故A正确;B.HI和醋酸均为一元酸,比较浓度均为0.1 mol·L-1的HI和醋酸溶液的导电能力可判断HI和醋酸的强弱,但不能判断HI为强酸,故B错误;C.醋酸为弱酸,加水稀释促进醋酸的电离,常温下,pH=3的醋酸溶液加水稀释1 000倍后溶液中c(H+)>10-6 mol·L-1,溶液的pH<6,故C正确;D.能够水解的盐均促进水的电离,常温下,同体积的pH=9的NaClO溶液和pH=5的NH4Cl溶液中的c(OH-)=c(H+),对水的电离的促进程度相同,水电离的OH-数相同,故D正确;故选B。
答案 B
3.(2017·浙江温州十校联合体)下列物质的水溶液因水解而呈酸性的是( )
A.NH4Cl B.Na2SO4
C.NaHCO3 D.Ba(NO3)2
解析 A.氯化铵是强酸弱碱盐,水解显酸性,故A正确;B.硫酸钠是强酸强碱盐,不能水解,溶液显中性,故B错误;C.碳酸氢钠是强碱弱酸的酸式盐,碳酸氢根既能水解又能电离,且水解程度大于电离程度,故溶液显碱性,故C错误;D.硝酸钡是强酸强碱盐,不能水解,溶液显中性,故D错误。
答案 A
4.(2018·浙江十校联盟)25 ℃时,体积均为20 mL、浓度均为0.1
mol/L的两种酸HX、HY分别与0.1 mol/L的NaOH 溶液反应,所加NaOH 溶液体积与反应后溶液的pH关系如图所示。下列叙述正确的是( )
A.加入10 mL NaOH溶液时,a点c(X-)
b点c(Y-),故A、B错误;根据物料守恒,加入40 mL NaOH溶液时,c(Na+)=2c(Y-)+2c(HY),故C错误;b点溶液中含有等浓度的HY和NaY,根据电荷守恒c(Na+)+c(H+)=c(Y-)+c(OH-),根据物料守恒2c(Na+)=c(Y-)+c(HY),所以c(Y-)+2c(OH-)=c(HY)+2c(H+),故D正确。
答案 D
5.(2017·浙江暨阳联合)25 ℃时,甲、乙两烧杯分别盛有5 mL pH=1的盐酸和硫酸,下列描述中不正确的是( )
A.物质的量浓度:c甲=2c乙
B.水电离出的OH-浓度:c(OH-)甲=c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙
D.将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1
解析 盐酸是一元强酸,硫酸是二元强酸,其pH相等说明氢离子浓度相等,A.盐酸和硫酸溶液中氢离子浓度相等时,盐酸浓度为硫酸浓度的2倍,即c甲=2c乙,故A正确;B.pH相等说明氢离子浓度相等,则氢氧根离子浓度也相等,故B正确;C.pH相等说明氢离子浓度相等,若分别用等浓度的NaOH溶液完全中和,所得溶液的pH都为7,故C正确;D.甲、乙烧杯中溶液混合时,若不考虑体积变化,氢离子浓度不变,故D错误。
答案 D
6.(2018·嘉兴高三二模)常温下,浓度均为0.1 mol/L的NaOH溶液和氨水,下列说法正确的是( )
A.氨水的pH大于NaOH溶液的pH
B.加水稀释,氨水中所有离子的浓度均减小
C.c(NH3·H2O)+c(NH)=c(Na+)
D.中和等体积该NaOH溶液和氨水所需盐酸的量不同
解析 A.一水合氨为弱碱,NaOH为强碱,浓度均为0.1 mol/L的NaOH溶液和氨水,NaOH溶液的碱性强于氨水的碱性,因此NaOH溶液的pH大于氨水的pH,A错误;B.加水稀释,氨水中c(H+)增大,B错误;C.NaOH溶液和氨水的浓度相同,根据物料守恒可知c(NH3·H2O)+c(NH)=c(Na+),C正确;D.NaOH和一水合氨都是一元碱,浓度相同时,中和等体积的NaOH溶液和氨水所需盐酸的量相同,D错误。答案选C。
答案 C
7.(2018·浙江金华十校联盟)下列说法正确的是( )
A.含有OH-的溶液一定呈碱性
B.pH为3的盐酸的c(H+)是pH为1的盐酸的100倍
C.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同
D.pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
解析 A.含有OH-的溶液不一定为碱性,如水中含有OH-,但水显中性,故A错误;B.pH=3的盐酸溶液中c(H+)=10-3mol·L-1,pH=1的盐酸溶液c(H+)=10-1mol·L-1,因此pH=3的盐酸的c(H+)是pH=1的盐酸中的1/100倍,故B错误;C.两种溶液含有微粒为Na+、SO、HSO、H2SO3、H+、OH-,故C正确;D.NH3·H2O是弱碱,NaOH为强碱,相同pH时,c(NH3·H2O)>c(NaOH),因此中和同浓度同体积的盐酸时,消耗氨水的体积小于NaOH的体积,故D错误。
答案 C
8.(2017·桐乡高级中学创新班)缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO),维持血液的pH保持稳定。已知在人体正常体温时,反应H2CO3HCO+H+的Ka=10-6.1,正常人的血液中c(HCO)∶c(H2CO3)≈20∶1,lg 2=0.3。则下列判断正确的是( )
A.正常人血液内Kw=10-14
B.由题给数据可算得正常人血液的pH约为7.4
C.正常人血液中存在:c(HCO)+c(OH-)+2c(CO)=c(H+)+c(H2CO3)
D.当过量的碱进入血液中时,只发生HCO+OH-===CO+H2O的反应
解析 A.常温下Kw=10-14,而正常人的体温为36.5 ℃,温度升高,水的离子积增大,则正常人血液内Kw>10-14,故A错误;B.Ka=,Ka=10-6.1,正常血液中c(HCO)∶c(H2CO3)≈20∶1,则c(H+)=10-7.4mol·L-1,则pH=7.4,故B正确;C.根据电荷守恒可知:c(HCO)+c(OH-)+2c(CO)=c(H+),故C错误;D.碱能与碳酸反应,则当过量的碱进入血液中时,发生的反应有:HCO+OH-===CO+H2O、H2CO3+2OH-===CO+2H2O,故D错误。
答案 B
9.(2018·嘉兴一中高三)25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是( )
A.在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大
B.将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C.NaHA溶液中,HA-的水解能力大于HA-的电离能力
D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
解析 A.在含H2A、HA和A2-的溶液中,当α(HA-)较大时,加入少量NaOH固体,因HA-与OH-反应生成A2-和H2O,会使α(HA-)减小,故A错误;B.由图可知,将等物质的量的NaHA和Na2A混合物溶于水,所得溶液的pH小于7,则HA-的电离程度大于HA-和A2-的水解程度,所以α(HA-)<α(A2-),故B错误;C.由图可知,当HA-浓度远大于其他溶质时,溶液的pH小于7,呈酸性,说明HA-电离出的氢离子浓度远大于其水解出的氢氧根离子浓度,所以HA-的水解能力小于其电离能力,故C错误;D.在只含H2A、HA-和A2-的溶液中,根据电荷守恒有:c(HA-)+2c(A2-)+c(OH-)=c(H+),若c(H2A)+2c(A2-)+c(OH-)=c(H+),则c(H2A)和c(HA-)相等,α(H2A)与α(HA-)也相等,但是溶液中可能还有其他阳离子,所以α(H2A)与α(HA-)不一定相等,故D正确;答案选D。
答案 D
10.(2016·浙江师大附中高二期末)下列电离或水解方程式正确的是( )
A.Na2SO3的水解:SO+2H2OH2SO3+2OH-
B.NaHCO3的电离:NaHCO3Na++H++CO
C.KHS溶液中HS-的电离:HS-+H2OH3O++S2-
D.NaClO溶液与FeCl2溶液混合:2ClO-+Fe2++2H2O===2HClO+Fe(OH)2↓
解析 A.Na2SO3的水解的离子反应为:SO+H2OHSO+OH-,故A错误;B.NaHCO3的电离方程式为:NaHCO3===Na++HCO,故B错误;C.KHS溶液中HS-的电离方程式为:HS-+H2OH3O++S2-,故C正确;D.NaClO溶液与FeCl2溶液混合的离子反应为:H2O+ClO-+2Fe2++4OH-===Cl-+2Fe(OH)3↓,故D错误。
答案 C
11.(2018·浙江省嘉兴高三二模)25 ℃时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、HSO和SO,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是( )
A.a表示SO物质的量分数随溶液pH变化的曲线
B.pH=8的溶液中:c(HSO)>c(SO)
C.pH=7的溶液中:c(Na+)=c(HSO)+2c(SO)
D.1 mol/L的NaHSO3溶液中存在: c(H2SO3)=c(H+)+c(OH-)+c(SO)
解析 A.由图像可知,a表示HSO物质的量分数随溶液pH变化的曲线,A错误;B.a表示HSO物质的量分数随溶液pH变化的曲线,b表示SO物质的量分数随溶液pH变化的曲线,由图像可知,pH=8时的溶液中,c(HSO)a>c;(2)酸中和NaOH的能力与酸最终电离出氢离子物质的量成正比,同体积、同物质的量浓度的三种酸,其物质的量相等,硫酸中氢离子的物质的量最大,盐酸和醋酸最终电离出氢离子的物质的量相等,所以中和NaOH的能力大小顺序为b>a=c;(3)若三者c(H+)相同时,假设都是1 mol/L,硫酸浓度为0.5 mol/L、盐酸浓度为1 mol/L、醋酸浓度大于1 mol/L,所以物质的量浓度由大到小的顺序是c>a>b(或c>a=2b); (4)酸与足量的锌反应时,相同状况下产生气体的体积与酸最终电离出氢离子的物质的量成正比,当三者c(H+)相同且体积也相同时,硫酸和稀盐酸最终电离出氢离子的物质的量相等,醋酸电离出氢离子的物质的量最大,所以这三种酸分别与足量锌反应时生成相同条件下气体体积大小顺序是c>a=b。
答案 (1)b>a>c (2)b>a=c (3)c>a>b(或c>a=2b) (4)c>a=b