- 2021-07-06 发布 |
- 37.5 KB |
- 31页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考二轮复习人教版高频考点精讲电解原理及其应用课件(31张)
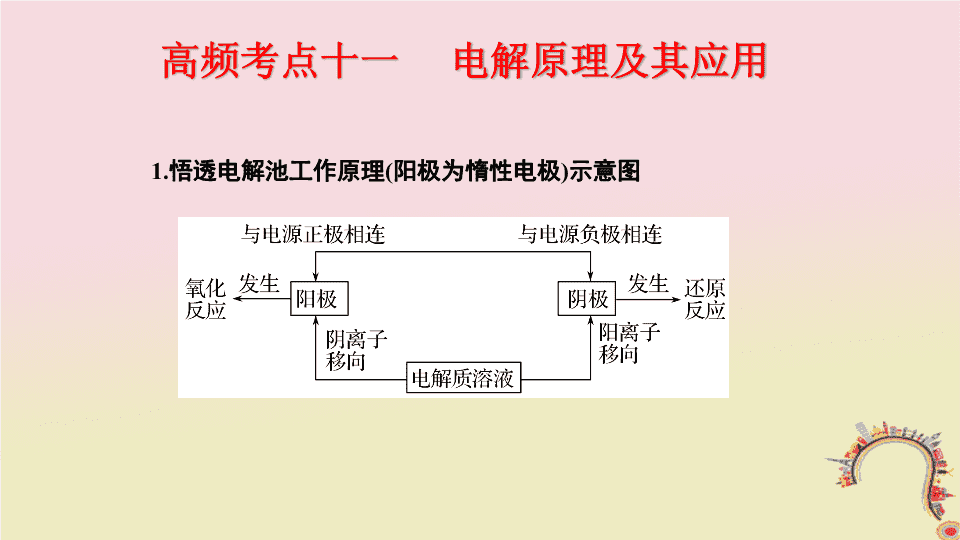
高频考点十一 电解原理及其应用 1 . 悟透电解池工作原理 ( 阳极为惰性电极 ) 示意图 2. 准确判断放电顺序,锁定放电离子 [ 考法指导 ] 【考法训练 1 】 用石墨电极电解 CuCl 2 溶液 ( 如图所示 ) 。下列分析正确的是 ( ) A.a 端是直流电源的负极 B. 通电使 CuCl 2 发生电离 C. 阳极上发生的反应: Cu 2 + + 2e - ===Cu D. 通电一段时间后,在阴极附近观察到黄绿色气体 电解原理分析 ( 难度系数 ☆☆ ) 解析 通过图中离子的运动状态可判断连接 a 的电极为阴极,连接 b 的电极为阳极,故 a 端为直流电源的负极, b 端为直流电源的正极, A 项正确; CuCl 2 在水溶液中就能发生电离,而不是通电的结果, B 项错误;阳极发生氧化反应,即 2Cl - - 2e - ===Cl 2 ↑ ,在阳极附近可观察到黄绿色气体, C 项错误, D 项错误。 答案 A 【考法训练 2 】 用石墨电极完成下列电解实验。 实验一 实验二 装置 现象 a 、 d 处试纸变蓝; b 处变红,局部褪色; c 处无明显变化 两个石墨电极附近有气泡产生; n 处有气泡产生 …… 下列对实验现象的解释或推测不合理的是 ( ) A.a 、 d 处: 2H 2 O + 2e - ===H 2 ↑ + 2OH - B.b 处: 2Cl - - 2e - ===Cl 2 ↑ C.c 处发生了反应: Fe - 2e - ===Fe 2 + D. 根据实验一的原理,实验二中 m 处能析出铜 答案 B 电极判断方法 【当堂指导】 判断依据 电极 材料 电极 反应 电子 流向 离子 移向 电极现象 原电池 负极 活泼金属 氧化反应 流出 阴离子移向 电极质量减小 正极 不活泼金属或非金属 还原反应 流入 阳离子移向 电极增重或质量不变 电 解池 阳极 与电源正极相连 氧化反应 流出 阴离子移向 电极溶解或 pH 减小 阴极 与电源负极相连 还原反应 流入 阳离子移向 电极增重或 pH 增大 【典例演示】 (2017· 河南南阳、周口、驻马店等六市一模 ) 将烧碱吸收 H 2 S 后的溶液加入到如图所示的电解池的阳极区进行电解,以实现 H 2 S 转化为 S 的目的。下列判断错误的是 ( ) 电解原理的应用 ( 难度系数 ☆☆ ) 答案 C 下列说法正确的是 ( ) A. 钛电极发生氧化反应 B. 阳极附近溶液的 pH 逐渐增大 C. 离子交换膜应采用阳离子交换膜 D. 阳极反应为 2Cu + 2OH - - 2e - ===Cu 2 O + H 2 O 解析 钛电极为阴极,发生还原反应, A 项错误;铜作阳极,阳极上铜发生失电子的氧化反应,阳极反应为 2Cu + 2OH - - 2e - ===Cu 2 O + H 2 O , OH - 由阴极区迁移到阳极区参与反应,离子交换膜应为阴离子交换膜, C 项错误、 D 项正确;由阴极区迁移过来的 OH - 在阳极全部参与反应,阳极附近溶液的 pH 不变, B 项错误。 答案 D A. 阳极室溶液由无色逐渐变成棕黄色 B. 阴极的电极反应式为 4OH - - 4e - ===2H 2 O + O 2 ↑ C. 电解一段时间后阴极室溶液的 pH 升高 D. 电解一段时间后,阴极室溶液 C 中的溶质一定是 (NH 4 ) 3 PO 4 答案 C “ 电解装置 ” 解题流程 【当堂指导】 高频考点三 金属的腐蚀与防护 1 . 金属电化学保护的两种方法 [ 考点精要 ] 2 . 金属腐蚀快慢程度的判断方法 [ 考法指导 ] 【考法训练 1 】 (2017· 滕州模拟 ) 用下列装置能达到预期目的的是 ( ) 结合生产、生活考查金属的腐蚀与防护 ( 难度系数 ☆☆ ) A. 甲图装置可用于电解精炼铝 B. 乙图装置可得到持续、稳定的电流 C. 丙图装置可达到保护钢闸门的目的 D. 丁图装置可达到保护钢闸门的目的 解析 电解精炼铝时,粗铝作阳极,纯铝作阴极,但电解质溶液不能是 AlCl 3 溶液,否则阴极上会析出 H 2 ,可以用熔融的 Al 2 O 3 作电解质, A 项错误;装置可以产生电流,但不能提供持续、稳定的电流, B 项错误;丙中形成原电池,钢闸门是负极,易被腐蚀,不能达到保护钢闸门的目的, C 项错误;丁中形成电解池,钢闸门是阴极,不易被腐蚀,可达到保护钢闸门的目的, D 项正确。 答案 D 【考法训练 2 】 某同学利用下图所示装置探究金属的腐蚀与防护条件。 ( 已知 Fe 2 + 遇 K 3 [Fe(CN) 6 ] 溶液呈蓝色 ) 。 下列说法不合理的是 ( ) A. ① 区 Cu 电极上产生气泡, Fe 电极附近滴加 K 3 [Fe(CN) 6 ] 溶液后出现蓝色, Fe 被腐蚀 B. ② 区 Cu 电极附近滴加酚酞后变成红色, Fe 电极附近滳加 K 3 [Fe(CN) 6 ] 溶液出现蓝色, Fe 被腐蚀 C. ③ 区 Zn 电极的电极反应式为 Zn - 2e - ===Zn 2 + , Fe 电极附近滴加 K 3 [Fe(CN) 6 ] 溶液未出现蓝色, Fe 被保护 D. ④ 区 Zn 电极的电极反应式为 2H 2 O + 2e - ===H 2 ↑ + 2OH - , Fe 电极附近滴加 K 3 [Fe(CN) 6 ] 溶液出现蓝色, Fe 被腐蚀 解析 ① 区发生吸氧腐蚀, Cu 为正极,电极反应式为 O 2 + 2H 2 O + 4e - ===4OH - , Cu 电极上不产生气泡, A 项错误; ② 区 Cu 为阴极,电极反应式为 2H 2 O + 2e - ===H 2 ↑ + 2OH - , Cu 电极附近溶液碱性增强,滴加酚酞后变成红色, Fe 为阳极,被腐蚀,电极反应式为 Fe - 2e - ===Fe 2 + , Fe 电极附近滴加 K 3 [Fe(CN) 6 ] 溶液出现蓝色, B 项正确; ③ 区 Zn 为负极,电极反应式为 Zn - 2e - ===Zn 2 + , Fe 为正极,得到保护, C 项正确; ④ 区 Zn 为阴极,电极反应式为 2H 2 O + 2e - ===H 2 ↑ + 2OH - , Fe 作阳极,被腐蚀,电极反应式为 Fe - 2e - ===Fe 2 + , Fe 电极附近滴加 K 3 [Fe(CN) 6 ] 溶液出现蓝色, D 项正确。 答案 A [ 模型示例 ] [ 分析建模 ] [ 模型解题 ] 答案 C [ 当堂应用 ] A.a 是电池的负极 B. 放电时, A - 向 b 极移动 C. 放电时,负极的电极反应式是 n C - e - + A - === C n A D. 充电时,电解质中的离子总数保持不变 解析 充电时 A - 吸附在 a 极形成 C n A ,则 a 极为阳极,发生氧化反应,而放电时 a 极发生还原反应,故 a 为电池的正极, A 项错误;放电时 a 为正极, b 为负极,而放电时阴离子向负极移动, B 项正确;放电时负极上发生氧化反应: LiC n - e - === n C + Li + , C 项错误;充电时 Li + 、 A - 分别吸附在两极上形成 LiC n 和 C n A ,故电解质中的离子总数逐渐减小, D 项错误。 答案 B 【应用 2 】 镍氢电池 (NiMH) 目前已经成为混合动力汽车的一种主要电池类型。 NiMH 中的 M 表示储氢金属或合金。该电池在充电过程中的总反应方程式是: 下列说法正确的是 ( ) A.NiMH 电池放电过程中,正极的电极反应式为: NiOOH + H 2 O + e - ===Ni(OH) 2 + OH - B. 充电过程中 OH - 离子从阳极向阴极迁移 C. 充电过程中阴极的电极反应式: H 2 O + M + e - ===MH + OH - , H 2 O 中的 H 被 M 还原 D.NiMH 电池中可以用 KOH 溶液、氨水等作为电解质溶液 解析 NiMH 电池在充电过程中的总反应方程式是 Ni(OH) 2 + M=== NiOOH + MH ,说明该电池放电时负极为 MH 放电,电极反应式为 MH - e - + OH - ===M + H 2 O ;正极活性物质为 NiOOH ,放电时的电极反应式为 NiOOH + H 2 O + e - ===Ni(OH) 2 + OH - , A 项正确;充电过程中,电子从阴极 ( 放电时为负极 ) 进入,溶液中的阴离子则从阴极向阳极移动, B 项错误; MH 极为负极,充电过程中该电极为阴极,对应的电极反应式为 M + H 2 O + e - ===MH + OH - , H 2 O 中的 H 是由于电解而被还原,不是 M 还原所得, C 项错误;若用氨水作为电解质溶液,则 NH 3 与 NiOOH 会反应, D 项错误。 答案 A查看更多