- 2021-07-06 发布 |
- 37.5 KB |
- 14页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河北省定州中学高二(承智班)下学期期中考试化学试题 Word版
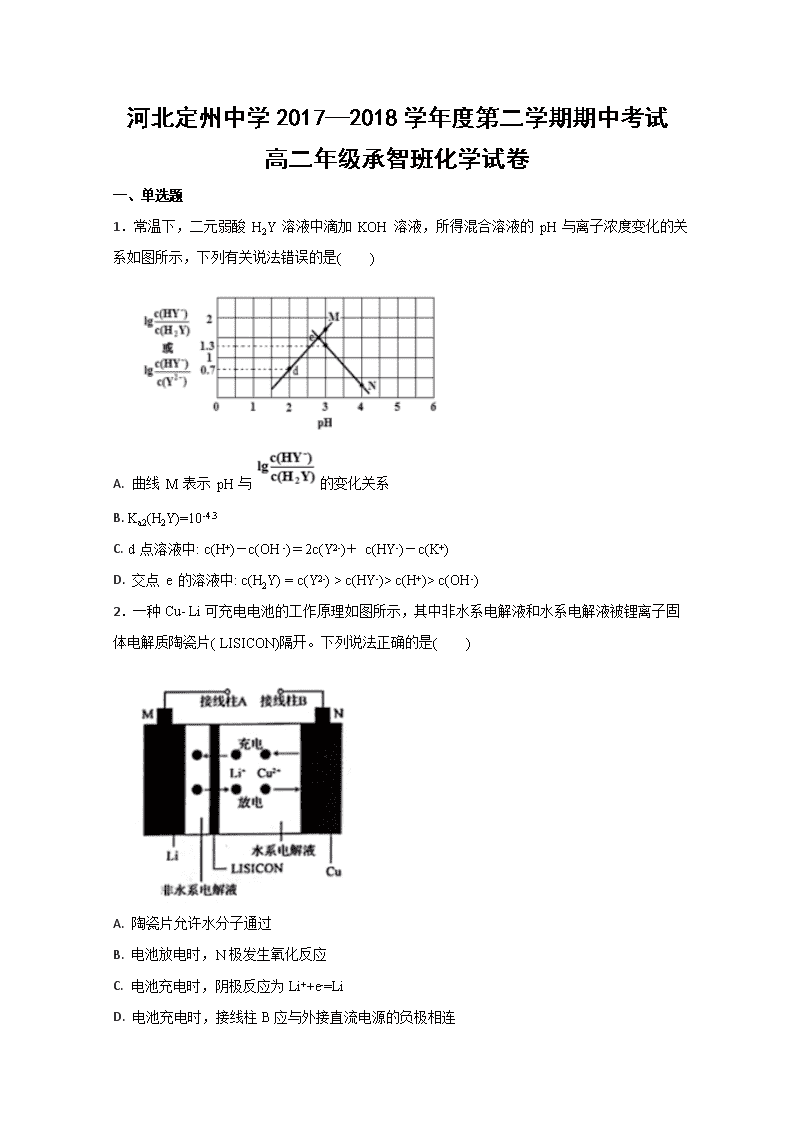
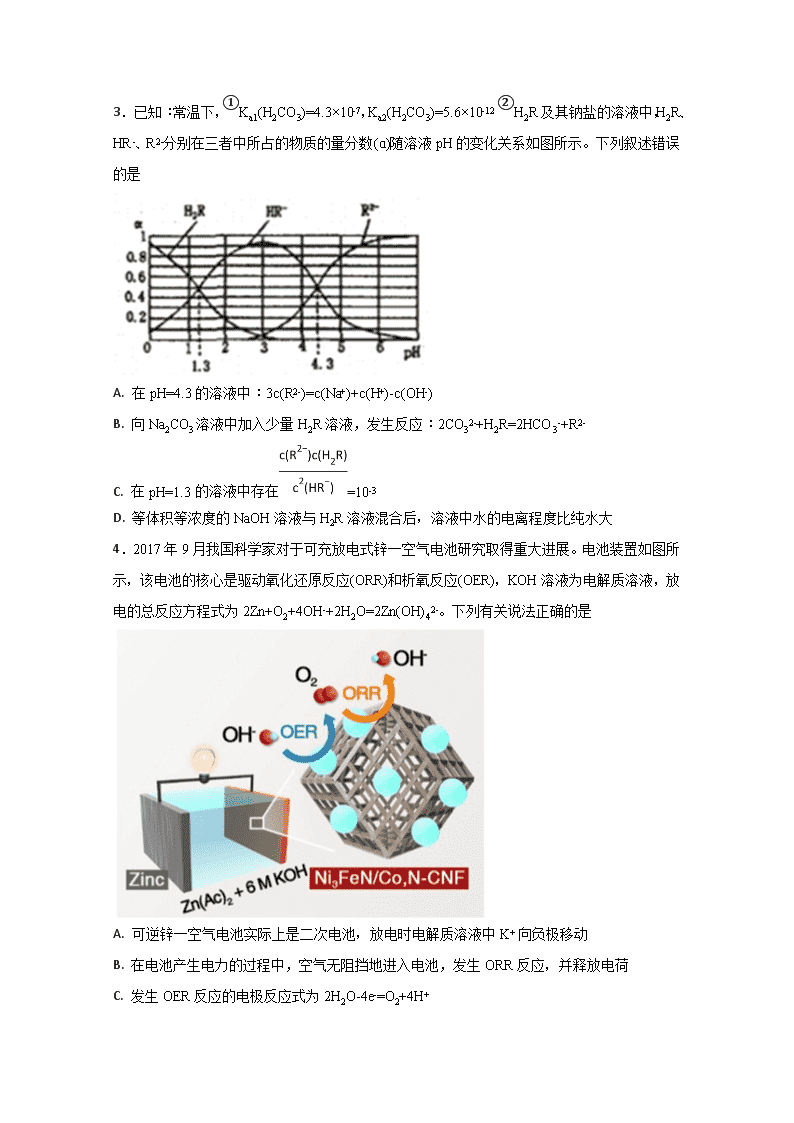
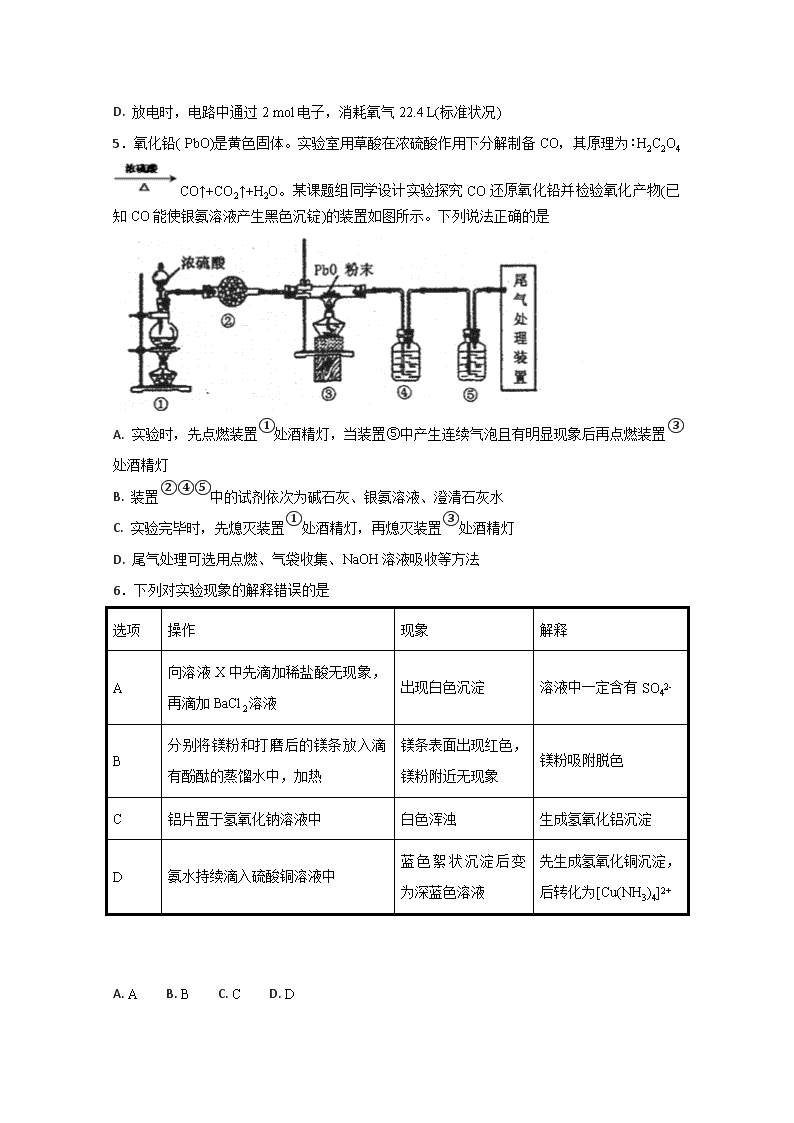
河北定州中学2017—2018学年度第二学期期中考试 高二年级承智班化学试卷 一、单选题 1.常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( ) A. 曲线 M 表示 pH与的变化关系 B. Ka2(H2Y)=10-4.3 C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+) D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -) 2.一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是( ) A. 陶瓷片允许水分子通过 B. 电池放电时,N极发生氧化反应 C. 电池充电时,阴极反应为Li++e-=Li D. 电池充电时,接线柱B应与外接直流电源的负极相连 3.已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-12 ②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(ɑ)随溶液pH的变化关系如图所示。下列叙述错误的是 A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) B. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2- C. 在pH=1.3 的溶液中存在=10-3 D. 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大 4.2017 年9 月我国科学家对于可充放电式锌一空气电池研究取得重大进展。电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电的总反应方程式为2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列有关说法正确的是 A. 可逆锌一空气电池实际上是二次电池,放电时电解质溶液中K+ 向负极移动 B. 在电池产生电力的过程中,空气无阻挡地进入电池,发生ORR 反应,并释放电荷 C. 发生OER 反应的电极反应式为2H2O-4e-=O2+4H+ D. 放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况) 5.氧化铅( PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为:H2C2O4CO↑+CO2↑+H2O。某课题组同学设计实验探究CO 还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉锭)的装置如图所示。下列说法正确的是 A. 实验时,先点燃装置①处酒精灯,当装置⑤中产生连续气泡且有明显现象后再点燃装置③处酒精灯 B. 装置②④⑤中的试剂依次为碱石灰、银氨溶液、澄清石灰水 C. 实验完毕时,先熄灭装置①处酒精灯,再熄灭装置③处酒精灯 D. 尾气处理可选用点燃、气袋收集、NaOH 溶液吸收等方法 6.下列对实验现象的解释错误的是 选项 操作 现象 解释 A 向溶液X中先滴加稀盐酸无现象,再滴加BaCl2溶液 出现白色沉淀 溶液中一定含有SO42- B 分别将镁粉和打磨后的镁条放入滴有酚酞的蒸馏水中,加热 镁条表面出现红色,镁粉附近无现象 镁粉吸附脱色 C 铝片置于氢氧化钠溶液中 白色浑浊 生成氢氧化铝沉淀 D 氨水持续滴入硫酸铜溶液中 蓝色絮状沉淀后变为深蓝色溶液 先生成氢氧化铜沉淀,后转化为[Cu(NH3)4]2+ A. A B. B C. C D. D 7.室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol·L-1的三种碱溶液。滴定曲线如图所示,下列判断正确的是 A. 滴定前,三种碱液中水电离的c(H+)大小关系:DOH>BOH>AOH B. 满定至P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+) C. pH=7时,c(A+)=c(B+)=c(D+) D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH) =c(H+)-c(OH-) 8.常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是 A. 用pH试纸测定E点对应的溶液,其pH=3 B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-) C. 加水稀释H点对应的溶液,溶液的pH增大 D. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+) 9.NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS 沉淀,装置如图所示: 下列对实验的叙述正确的是 A. 在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C 装置中与NiSO4溶液反应 B. 装置B 中盛放浓硫酸 C. 装置D 中的洗涤液应用煮沸过的蒸馏水 D. 反应结束后继续通入N2 可将C装置中产生的沉淀压入过滤沉淀漏斗中 10.三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是 A. 允许离子X通过的隔膜属于阴离子交换膜 B. 充电时,A 为阴极,Li+被氧化 C. 可从无法充电的废旧电池的石墨电极中回收金属锂 D. 放电时,正极反应式为 Li1-aNixCoyMnzO2+aLi ++ae-= LiNixCoyMnzO2 11.W、X、Y、Z是四种短周期非金属元素,原于序数依次增大,X、Y原子核外L电子层的电子数之比为3:4,且Y的原子半径大于X的原子半径,X、Y、Z的最外层电子数之和为16,W的简单离子W-能与水反应生成单质W2。下列说法正确的是 A. 最简单氢化物的沸点:Z>X B. W与X形成的化合物中只有极性键 C. 最高价氧化物对应水化物酸性:Y>Z D. 阴离子的还原性:W>X 12.H2RO3是一种二元酸,常温下,用1L lmol/LNa2RO3溶液吸收RO2 气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法不正确的是 A. a点溶液中2c(Na+)>3c(RO32-) B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4 C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3) D. 当吸收RO2 的溶液呈中性时,c(Na+)=2c(RO32-)+c(HRO3-) 13.已知:pK=-lgK,25℃时,二元酸H2A的pK1= 1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是 A. a点所得溶液中:Vo=10mL B. C点所得溶液中:c(A2- )=c(HA-) C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19 14.X、Y、Z、W是原子序数依饮增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由元素Z形成的单质,0.1mol/LD溶液的pH=13(25℃)。它们满足如图转化关系,则下列说法正确的是 A. 元素Z的最高正价为+6 B. F中含有共价键和离子键 C. 常温下,X、Y、Z、W四种元素组成的盐溶液的pH一定小于7 D. 0.1mol B 与足量C完全反应共转移电子数为0.2×6.02×1023 15.25℃时,向盛有50mLpH=2的HA溶液的绝热容器中加入pH =13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是 A. a→b 的过程中,混合溶液中可能存在:c(A-)=c(Na+)=c(H+) =c(OH-) B. HA的物质的量浓度为0.01mol/L C. b点时,溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+) D. b→c的过程中,温度降低的原因是溶液中发生了吸热反应 16.短周期元素X、Y、Z、W的原子序数依次增大。Z在短周期主族元素中原子半径最大;m、n、p、q为它们的单质;常温下,q为黄绿色气体,a为无色液体;各物质间转化关系如图所示。下列说法不正确的是 A. d中可能含有非极性共价键 B. Y、Z、W分别与X形成的化合物沸点:Z查看更多
相关文章
- 当前文档收益归属上传用户