- 2021-07-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年河南省顶级名校高二10月阶段性检测化学试题 Word版
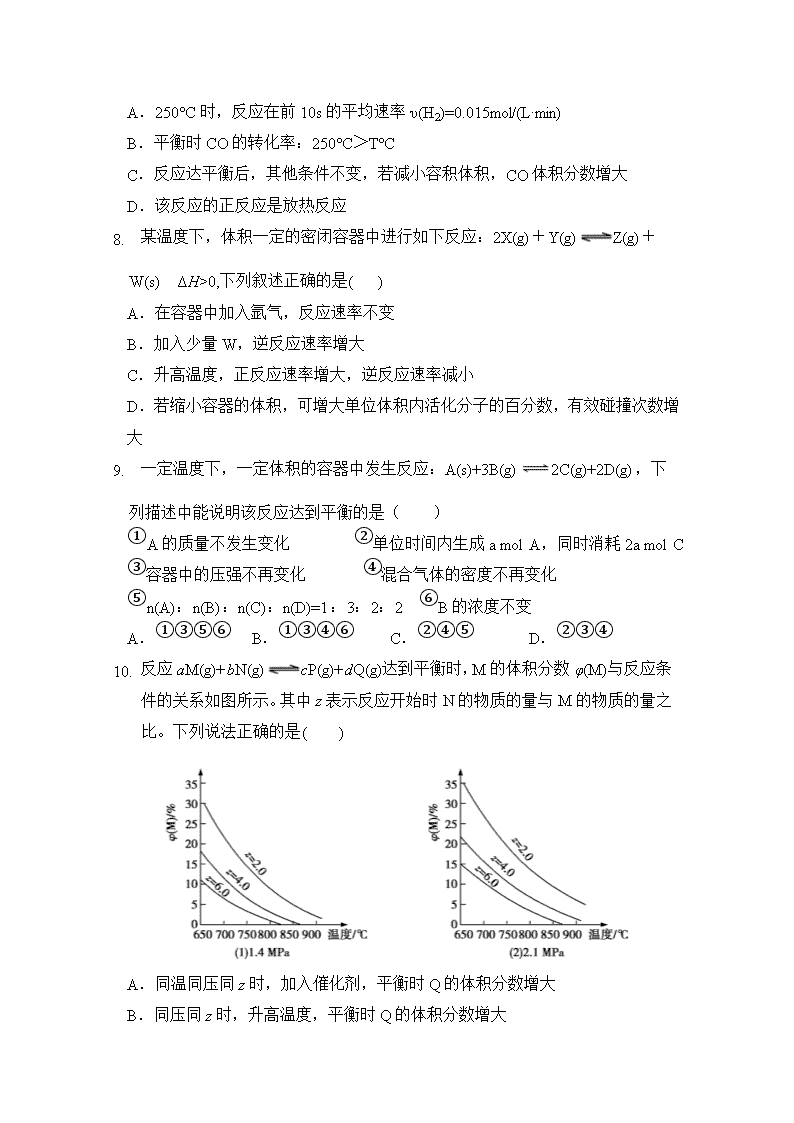
河南省顶级名校2019-2020学年高二10月阶段性检测 化学试题 考试时间: 60 分钟 试卷分值: 100 分 考察内容:必修四前三章 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Mn-55 一、选择题(共18小题,每题4分,共72分) 1. 下列说法正确的是( ) A.1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 B.热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 C.热化学方程式中的化学计量数表示物质的量,因此可用分数表示 D.1 mol碳燃烧所放出的热量为燃烧热 2. 碘升华的过程中( ) A. 吸收了热量 B. 化合价升高 C. 破坏了化学键 D. 生成了新物质 3. 下列关于反应热和热化学反应的描述中正确的是( ) A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1 B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH= +2×283.0 kJ·mol-1 C.氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)== 2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1 D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 4. 在同温同压下,下列各组热化学方程式中Q2>Q1的是( ) A.2H2(g)+O2(g) == 2H2O(g); ΔH =-Q1 2H2 (g)+O2 (g) == 2H2O(l); ΔH =-Q2 B. S(g)+O2(g) SO2(g); ΔH =-Q1 S(s)+O2(g) SO2(g); ΔH =-Q2 B. C(s)+O2(g) == CO2(g); ΔH =-Q1 C(s)+1/2O2 (g) == CO(g); ΔH =-Q2 D.H2(g)+Cl2(g) == 2HCl(g); ΔH =-Q1 1/2H2(g)+1/2Cl2(g) == HCl(g); ΔH =-Q2 4. 下列推论正确的是( ) A.2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则碳的燃烧热的数值大于110.5kJ·mol-1 B.C(石墨,s)=C(金刚石,s) ΔH=+1.9 kJ·mol-1,则金刚石比石墨稳定 C.OH-(aq)+H+(aq) = H2O(l) ΔH=-57.4 kJ·mol-1,则:含20 g NaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7 kJ D.C(g)+O2(g)=SO2(g) ΔH1;C(s)+O2===SO2(g) ΔH2,则ΔH1>ΔH2 5. 四位同学同时进行反应A(g)+3B(g)2C(g)+2D(g),的速率测定实验,分 别测得反应速率如下:①v(A)=0.15mol/(L•s),②v(B)=0.6mol/(L•s),③v(C)=0.4mol/(L•s),④v(D)=0.45mol/(L•s)。其中反应进行得最快的是( ) A.① B.② C.③ D.④ 6. 下列自发反应可以用熵判据来解释的是( ) A.2NO2(g)=N2O4(g) ΔH=-56.9 kJ·mol-1 B.2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1 C.N2(g)+3H2(g)=2NH3(g) ΔH=-92.3 kJ·mol-1 D.2H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 7. 将 1mol CO和 2mol H2充入一容积为 1L的密闭容器中,分别在250°C、T°C 下发生反应:CO(g)+2H2(g)CH3OH(g)。根据图,下列分析中正确的是( ) A.250°C时,反应在前10s的平均速率υ(H2)=0.015mol/(L·min) B.平衡时CO的转化率:250°C>T°C C.反应达平衡后,其他条件不变,若减小容积体积,CO体积分数增大 D.该反应的正反应是放热反应 4. 某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)Z(g)+ W(s) ΔH>0,下列叙述正确的是( ) A.在容器中加入氩气,反应速率不变 B.加入少量W,逆反应速率增大 C.升高温度,正反应速率增大,逆反应速率减小 D.若缩小容器的体积,可增大单位体积内活化分子的百分数,有效碰撞次数增大 5. 一定温度下,一定体积的容器中发生反应:A(s)+3B(g)2C(g)+2D(g),下 列描述中能说明该反应达到平衡的是( ) ①A的质量不发生变化 ②单位时间内生成a mol A,同时消耗2a mol C ③容器中的压强不再变化 ④混合气体的密度不再变化 ⑤n(A):n(B):n(C):n(D)=1:3:2:2 ⑥B的浓度不变 A.①③⑤⑥ B.①③④⑥ C.②④⑤ D.②③④ 6. 反应aM(g)+bN(g)cP(g)+dQ(g)达到平衡时,M的体积分数φ(M)与反应条件的关系如图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( ) A.同温同压同z时,加入催化剂,平衡时Q的体积分数增大 B.同压同z时,升高温度,平衡时Q的体积分数增大 C.同温同z时,增大压强,平衡时Q的体积分数增大 D.同温同压时,增大z,平衡时Q的体积分数增大 4. 室温下,能说明NH3·H2O为弱电解质的实验事实是( ) A.铵盐受热都易分解 B.0.1 mol·L-1 NH4Cl溶液的pH<7 C.氨水溶液中只有少量的OH- D.0.1 mol·L-1的氨水能使无色酚酞试液变红色 5. 某学生提供的实验数据如下,其中肯定错误的是( ) ①用100毫升的量筒量取67.60 mL的液体 ②用托盘天平称取22.5 g KCl ③酸碱中和滴定时,消耗0.1000 mol/L的盐酸23.25 mL ④用广泛pH试纸测得某溶液的pH=4.4 A.①② B.②③ C.③④ D.①④ 6. 相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( ) A. 相同浓度的两溶液,分别与镁粉反应,开始时反应速率相同 B. 相同浓度的两溶液,c(CH3COOˉ) < c(Clˉ) C. 分别中和pH相等、体积相等的两溶液,盐酸所需NaOH的物质的量较多 D. pH=3的两溶液分别加水稀释10倍后,醋酸溶液的pH比盐酸大 7. 在10 mL 0.1 mol/L的NaOH溶液中加入等体积、等浓度CH3COOH溶液, 反应后溶液中各微粒的浓度关系不正确的是( ) A. c(Na+)=c(CH3COO-)+c(CH3COOH) B. c(OH-)=c(H+)+c(CH3COOH) C. c(Na+)+c(H+)=c(CH3COO-)+c(OH-) D. c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 4. 常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至 体积为V,溶液pH随lg 的变化关系如图所示,下列叙述错误的是( ) A.常温下:Ka(HB)>Ka(HC) B.HC的电离度:a点查看更多
相关文章
- 当前文档收益归属上传用户